Для лечения онкологических заболеваний, являющихся одной из основных причин смерти и инвалидизации населения в мире [3], в мировой практике наблюдается тенденция увеличения использования плотноионизирующих излучений. Актуальной проблемой современной радиобиологии остается оценка относительной биологической эффективности излучений. Это связано с перспективой использования плоноионизирующих излучений в лучевой терапии благодаря нескольким факторам. Во-первых, эффективность таких излучений значительно превышает действие редкоионизирующих излучений. Во-вторых, при использовании плотноионизирующих излучений подавляется способность клеток восстанавливаться от потенциально летальных и сублетальных повреждений [5, 9]. Кроме того, доступное в настоящее время формирование полей облучения плотноионизирующими излучениями может обеспечивать меньшую дозу на нормальные, незлокачественные клетки. Малоисследованным аспектом этой проблемы является зависимость ОБЭ от предрадиационных условий культивирования клеток. Поэтому в данной работе анализируется зависимость ОБЭ α–излучения от предрадиационных условий культивирования клеток – состава питательных сред.
Изучение зависимости вариабельности ОБЭ от генотипа клеток и от их формы кривой выживаемости проанализирован для бактерий и дрожжевых клеток [4, 5, 10]. В этих монографиях показана корреляция ОБЭ со способностью клеток к пострадиационному восстановлению. Молекулярный процесс восстановления от радиационных повреждениях детально изучен на бактериальных клетках [5]. Представляют значительный интерес данные [6], продемонстрировавшие изменение способности клеток к восстановлению за счет их культивирования до облучения на средах, содержащих глюкозу. Такое культивирование снижало радиочувствительность штамма E. coli B/r. Было выявлено, что при культивировании бактерий на средах, содержащих глюкозу, изменяется форма дозовой кривой по сравнению с клетками, росшими на стандартной среде. Наиболее интригующими результатами является сигмоидная форма кривой доза-эффект после α-облучения в условиях культивирования клеток на средах, содержащих глюкозу. Вместе с тем, хорошо известно, что сигмоидная форма кривой доза-эффект после действия редкоионизирующего излучения превращается в экспоненциальную после облучения α-частицами клеток млекопитающих [7, 8] и дрожжей [9, 10]. Наличие сигмоидной кривой доза-эффект у бактерий, облученных α-частицами, представляет интерес с фундаментальной точки зрения. Не исключено, что четко выраженная сигмоидная форма кривой доза-эффект после действия плотноионизирующего излучения могла быть обусловлена восстановлением клеток в процессе длительного облучения за счет очень низкой мощности дозы. Применение значительно большей мощности дозы подтвердило наличие плеча кривой выживаемости после α-облучения [6]. Однако в этой работе мощность дозы была не известна, что не позволило авторам оценить ОБЭ α-частиц. Целью данного исследования являлось изучение влияния состава питательных сред, модифицирующих способность клеток к восстановлению, на ОБЭ и форму кривых выживаемости бактерий E. coli B/r, облученных редко- и плотноионизирующим излучением.
Материалы и методы исследования
Работа выполнена на бактериальных клетках E. coli, радиоустойчивый штамм В/r. Для исследования использовали культуру клеток, выращенную или на стандартной твердой питательной среде (пептон – 10 г/л, агар – 20 г/л, хлорид натрия – 10 г/л, дрожжевой экстракт – 20 мл/л), или на среде, содержащий солод. Эту среду готовили на основе неохмеленного солодового экстракта Maltax 10 (6 % или 13 %) с добавлением 2 % агара. Клетки культивировали при 37 °С в течение 18 часов, когда бактерии выходили на стационарную фазу роста.
Выращенные на стандартной среде или на солодовом агаре клетки в каждом опыте делили на две порции, одну из которых облучали разными дозами γ-излучения, а вторую – разными дозами α-частиц. В опытах с редкоионизирующим излучением облучали бактерии, суспендированные в физиологическом растворе (концентрация клеток составляла 106 кл/мл). Источником γ-излучения являлся 60Со установки «Исследователь» (мощность дозы 22 Гр/мин). Дозиметрию осуществляли ионизационными и ферросульфатными методами. В опытах с плотноионизирующим излучением в качестве источника использовали плоский α-источник 239Pu (мощность дозы 25 Гр/мин). Из-за малого пробега α-частиц в ткани (около 40 мкм) облучали монослой клеток. Для этого 0,02 мл суспензии бактерий (108 кл/мл) наносили на поверхность водного агара (20 г агара на 1 л воды) и перед облучением на 20–30 мин помещали в термостат для выпаривания воды из капли. После облучения слой агара вместе с облученными клетками помещали в пробирку с 2 мл физиологического раствора и интенсивно встряхивали для получения однородной суспензии. Облучение бактерий всеми типами излучений проводили при комнатной температуре.
После воздействия любого из исследуемых видов ионизирующего излучения, а также контрольные интактные клетки высевали на чашки Петри на поверхность стандартной твердой бактериальной среды и инкубировали при 37 °С в течение 20 часов. Выживаемость клеток рассчитывали как относительное содержание клеток, сформировавших видимые невооруженным глазом колонии, среди всех облученных клеток. Каждый эксперимент повторяли 5–7 раз. Детали экспериментальных исследований описаны ранее [2, 9].
Результаты исследования и их обсуждение
Биологическим тестом, использованным в данной работе, является выживаемость клеток, которая для теста репродуктивной гибели определялась [4] как способность облученных клеток к бесконечному размножению. Относительное содержание жизнеспособных клеток среди всех облученных, то есть выживаемость S рассчитывали как:
S = N/No, (1)
где N – число макроколоний, образовавшихся из облученных клеток в единице объема облученного образца, а No – то же в контрольном образце.
Результаты влияния γ- и α-излучения с разной ЛПЭ на выживаемость бактерий E. coli B/r при выращивании их до облучения на различных питательных средах приведены на рис. 1. На этом рисунке представлены кривые выживаемости E. coli B/r после γ- (светлые значки) и α-облучений (темные значки). В одной серии экспериментов клетки выращивали в течении 20 часов до облучения на стандартной бактериальной среде (рис. 1, А), а в другой – на субстрате, содержащем 6 %-й солод (рис. 1, Б). Следует подчеркнуть, что после облучения бактерии этих двух серий экспериментов культивировали на одинаковом стандартном бактериальном субстрате. Из рисунка видно, что предрадиационное культивирование клеток на солодовом агаре (панель Б), приводит к значительному увеличению радиорезистентности бактерий по сравнению с предрадиационным выращиванием культуры на стандартной среде (панель А) независимо от вида излучения. Видно, что главной особенностью влияния данной питательной среды на выживаемость E.coli B/r к воздействию излучения является изменение формы кривой доза-эффект с экспоненциальной на S-образную, а наклон экспоненциальных участков кривых выживаемости изменялся незначительно. Так для γ-излучения такая характеристика зависимости выживаемости бактерий от дозы как Do меняется не очень сильно – 65 Гр для клеток E.coli, росших до облучения на стандартной твердой питательной среде (рис. 1, А, кривая 2), и 75 Гр для бактерий, росших на 6 % солодовом агаре (рис. 1, Б, кривая 2).
Наличие плеча у «солодовой» культуры бактерий свидетельствует об активации процессов репарации повреждений. Формирование плеча в большей степени обусловлено восстановлением клеток от сублетальных, но не от потенциально летальных повреждений. То есть предрадиационное культивирование бактериальных клеток на средах, содержащих солод, потенцирует восстановительные процессы в клетках.
На основании представленных данных рассчитана ОБЭ α-излучения, определяемая отношением изоэффективных доз для γ- и α-излучений. ОБЭ α-частиц по отношению к γ-излучению составляет 1 для популяции клеток, выращенных на стандартной среде, а для бактерий, выросших на солодовом агаре, ОБЭ зависит от дозы излучения и варьирует от 1,2 для больших доз облучения до порядка 4–5 в области сигмоидного плеча кривой доза-эффект. Из рис. 1, Б видно, что наклоны кривых выживаемости не зависят от качества излучения, но уменьшается экстраполяционное число кривых доза-эффект после α-излучения. Интерпретация такой закономерности основывается на формировании более «тяжелых» повреждений, формируемых плотноионизирующими излучениями, от которых клетки не способны восстанавливаться.
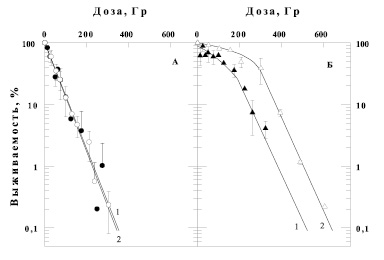
Рис. 1. Зависимость выживаемости бактерий E. coli B/r от дозы ионизирующего излучения (темные значки – α-облучение, светлые значки – γ-излучение), а также от условий предрадиационного культивирования клеток: стандартная среда (панель А) или 6 % солодовый агар (панель Б)
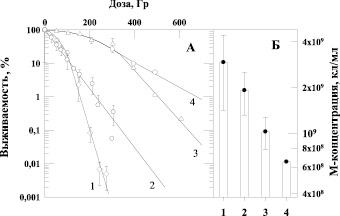
Рис. 2. Зависимость выживаемости бактерий E. coli B/r от дозы γ-излучения (панель А) и величина М-концентрации клеток (панель Б) при выращивании культуры до облучения на различных питательных средах: 1 – бактоагар Плоскирева, 2 – стандартная среда, 3 – 6 % солодовый агар, 4 – 13 % солодовый агар
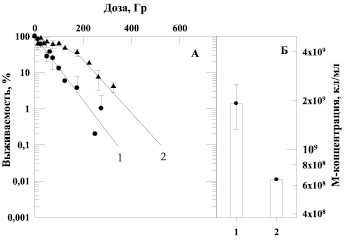
Рис. 3. Зависимость выживаемости бактерий E. coli B/r от дозы α-излучения (панель А) и величина М-концентрации клеток (панель Б) при выращивании культуры до облучения на различных питательных средах: 1 – стандартная среда, 2 – 6 % солодовый агар
Известно, что биологическая эффективность излучений разного типа определяется как физическими характеристиками излучений с высокими ЛПЭ, которые индуцируют широкий спектр первичных повреждений ДНК, так и биологическими механизмами, направленными на репарацию этих повреждений [1, 5, 9]. В опытах по изучению выживаемости бактерий после действия как α-частиц, так и ускоренных электронов было продемонстрировано [1], что эффективная работа систем репарации радиорезистентного мутанта E. coli K-12 приводит к формированию плеча на кривой выживаемости, в то время как выживаемость исходного родительского штамма бактерий характеризуется экспоненциальной зависимостью. Эти данные подтверждают точку зрения о влиянии систем репарации на формирования плеча кривой доза-эффект.
Подтверждением этих наблюдений являются данные, приведенные на рис. 2, которые отражают зависимость выживаемости бактерий E. coli B/r, облученных γ-квантами, от состава питательной среды, на которой клетки культивировали до облучения. На рис. 3 приведены аналогичные данные о влиянии воздействия α-частиц на выживаемость этой же культуры клеток при ее предрадиационном выращивании на различных средах. В наших экспериментах было отмечено, что максимальные концентрации клеток (М-концентрация), достигаемые за 20 часов культивирования на разнообразных средах, заметно различаются (рис. 2, Б и рис. 3, Б). Мы использовали как питательные среды, в состав которых входят органические субстраты (6 %-й или 13 %-й солодовый агар), так и солевую синтетическую среду – бактоагар Плоскирева, включающую в качестве источника энергии углеродсодержащие соединения (7,5 % сахара). Четко прослеживается зависимость радиочувствительности от максимальной концентрации (М-концентрации) бактерий в стационарной фазе роста: чем меньше М-концентрация, тем меньше радиочувствительность клеток. Тем самым продемонстрировано, что состав питательных сред, на которых культивировали бактерии, приводит к снижению М-концентрации бактерий и возрастанию радиоустойчивости штамма как к γ-излучению (рис. 2, А), так и к воздействию α-частиц (рис. 3, А).
Характер зависимости выживаемости клеток от дозы ионизирующего излучения может быть обусловлен процессами, связанными с образованием поврежденых участков ДНК, приводящими к возникновению двунитевых разрывов. Одним из факторов, влияющих на формирование плеча на кривой выживаемости, может являться увеличение числа копий генома [1]. Сигмоидность кривых выживаемости полигиномных клеток бактерий обуславливается тем, что для их инактивации необходимо возникновение нескольких эффективных повреждений, возможно, в каждой из копий генома. Явление формирования многокопийности генома у бактерий E. coli, выращенных на питательных средах, содержащих глюкозу, также отмечена и в работе [6].
В данной работе показано, что сигмоидная форма кривой выживаемости бактерий, выращенных на солодовом агаре, сохраняется и при облучении α-частицами. Следовательно, системы репарации, ответственные за формирование сигмоидного участка кривой выживаемости, эффективно работают после действия редко- и плотноионизирующих излучений. Более подробное исследование биохимических процессов, приводящих к изменению формы кривой доза-эффект с экспоненциальной на S-образную, выходит за рамки данной работы.
Таким образом, нами было продемонстрировано, что состав питательной среды, на которой культивировали клетки до облучения, оказывает существенное влияние не только на выживаемость бактерий, но и на относительную биологическую эффективность плотноионизирующего излучения. Полученные закономерности могут представлять интерес не только для фундаментальной радиобиологии, но и в прикладных областях. Так, в клинической радиобиологии остро стоит проблема радиоустойчивости нормальных тканей к воздействию ионизирующего излучения при радиотерапии. Устойчивость микроорганизмов к повышенному радиационному фону востребована в системах биологической очистки радиоактивных отходов.

