Гетероциклические системы, содержащие в своем составе, пиридопиримидиновый фрагмент давно привлекают внимание исследователей своей разнообразной фармокологической активностью. Особенно большой интерес пиридопиримидины привлекли к себе в последние годы в связи с обнаружением у них способности селективно ингибировать деятельность различных протеин-киназ. В настоящее время большое число разнообразных пиридопиримидинов проходят разные стадии клинических испытаний в качестве противоопухолевых препаратов для лечения практически всех видов злокачественных опухолей. Кроме того, многие из этих же соединений оказались эффективными препаратами для лечения артритов, астмы, остеопороза, сердечной недостаточности, воспаления легких, атеросклероза и т.д. Поэтому разработка новых универсальных методов синтеза различных замещенных производных пиридопиримидинов является актуальной проблемой.
С этой точки зрения удобными и доступными субстратами для синтеза гетероциклических систем, содержащих пиридрпиримидиновый фрагмент явились 3Н-фуран-2оны. Структурные фрагменты исследуемых нами 3Н-фуран-2-онов входят в состав природных соединений (протоанемонин, аскорбиновая и пеницилловая кислоты), синтетических лекарственных средств, используемых при лечении болезней желудочно-кишечного тракта, сердечно-сосудистой системы. Ранее было изучено взаимодействие арилметилиденовых производных 3Н-фуран-2-онов с различными реагентами [1-5].
Изучено взаимодействие эквимолярных количеств фуран-2-она с глюкозой и карбонатом гуанидина. Осуществление реакции при кипячении реагентов в безводном толуоле (бензоле), этаноле, диметилсульфоксиде в присутствии каталитических количеств триэтиламина в течение 10 часов ни привело к ожидаемым результатам. Выделить конечный продукт реакции не удалось.
Данное взаимодействие было изучено в условиях микроволновой активации. В условиях микроволновой активации в реакцию были введены эквимолярные количества фуран-2-она с глюкозой и карбонатом гуанидина, с использованием силикагеля, в качестве твердой подложки.
Микроволновый нагрев отличатся от традиционного высокими объемным и временными градиентами, а также неодинаковой способностью различающихся по составу растворов и компонентов гетерогенных систем к поглощению энергии излучения. Кроме того, в электромагнитном микроволновом поле происходит ориентация заряженных частиц и диполей, присутствующих в растворе, что влияет на их взаимодействие. Синтез в условиях микроволновой активации позволяет отказаться от растворителей, в данном случае температура реакционной смеси не ограничивается температурой кипения растворителя и реакция протекает значительно быстрее. Все это приводит как к изменению выхода продуктов реакции, скорости протекания процесса, возможности отказа от высококипящих и токсичных растворителей.
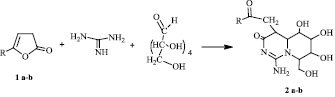
Реакция проводилась в СВЧ-печи в течение 15 минут с образованием 1-амино-5,6,7-тригидрокси-8-(гидроксиметил)-4-(2-оксо-2R-этил)-4,4a,5,6,7,8-гексагидро-3H-пиридо[1,2-c]пиримидин-3-онов (2 a-b). Вероятно, первоначально происходит образование 2,3,4,5,6-пентагидроксигексилиденгуанидина, за счет взаимодействия глюкозы с гуанидином, сопровождается элиминированием молекулы воды. Дальнейшая конденсация замещенного гуанидина с фуран-2-оном сопровождается раскрытием лактонного кольца и образованием пиридопиримидиноновой системы, за счет последовательной атаки атома азота иминогруппы по электронодефицитному атому углерода и отщепления молекулы воды.
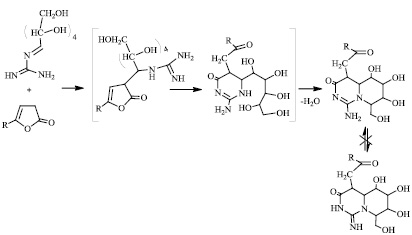
Не исключалось образование иминоформы пиридопиримидиноновой системы, однако на основании эксперимента HMBC сделано заключение о существовании аминоформы.
По данным виртуального скринига 1-амино-5,6,7-тригидрокси-8-(гидроксиметил)-4-(2-оксо-2R-этил)-4,4a,5,6,7,8-гексагидро-3H-пиридо[1,2-c]пиримидин-3-оны можно использовать как антинеопластические, противоаллергенные, противовоспалительные, обезболивающие средства, также данные соединения проявляют анти-ВИЧ активность.
Экспериментальная часть
Спектры ЯМР1Н записаны на спектрометре Varian-400, при 20-25 °С в CDCl3, внутренний стандарт ТМС. Рабочая частота 400 МГц. ТСХ проводили на пластинах Silufol UV-254, элюент – гексан:этлацетат:хлороформ – 2:2:1, проявитель – пары йода. Температуры плавления определены в открытом капилляре. Элементный анализ проводили на CHNS-анализаторе Elementar модели «Vario Micro cube».
1-амино-5,6,7-тригидрокси-8-(гидроксиметил)-4-(2-оксо-2-фенилэтил)-4,4a,5,6,7,8-гексагидро-3H-пиридо[1,2-c]пиримидин-3-оны (2).
В термостойком бюксе смешивают 0,01 моль 3Н-фуран-2-она, 0,01 моль глюкозы, 0,01 моль карбоната гуанидина и нагревают в микроволновой печи при максимальной мощности в течение 15 минут. Реакционную массу выливают в стакан с водой, тщательно перемешивают и нейтрализуют соляной кислотой до нейтральной рН среды. Образовавшийся маслянистый слой экстрагируют смесью гексана и хлороформа (1:1), полученную смесь упаривают. Полученные кристаллы сушат на фильтре Шотта.
1-амино-5,6,7-тригидрокси-8-(гидроксиметил)-4-(2-оксо-2-фенилэтил)-4,4a,5,6,7,8-гексагидро-3H-пиридо[1,2-c]пиримидин-3-он (2а).
Выход 58 %, Т.пл. 98-100°С. ЯМР1Н, δ, м.д.: 2.76 м., (2Н, СН2), 2.83 м., (1Н, СН), 2.94 м., (1Н, СН), 3.05 м., (1Н, СН), 3.10 м., (1Н, СН), 3.16 м., (1Н, СН), 3.23 м., (1Н, СН), 3.46 м., (2Н, СН2), 4.17 с., (1Н, ОН), 4.35 с., (1Н, ОН), 5.05 с., (1Н, ОН), 6.10 с., (1Н, ОН), 7.17-7.65 м., (5Н, аром.), 8.15 уш.с (2Н, NH2). Найдено %: С 55.98; Н 5.63; N 12.07. С17H21N3O6. Вычислено %: С 56.19; Н 5.83; N 11.56.
1-амино-5,6,7-тригидрокси-8-(гидроксиметил)-4-(2-оксо-2-(п-толил)-этил)-4,4a,5,6,7,8-гексагидро-3H-пиридо[1,2-c]пиримидин-3-он (2b).
Выход 61 %, Т.пл. 88-90 °С. ЯМР1Н, d, м.д.: 2.15 с., (3Н, СН3), 2.68 м., (2Н, СН2), 2.75 м., (1Н, СН), 2.88 м., (1Н, СН), 3.11 м., (1Н, СН), 3.21 м., (1Н, СН), 3.23 м., (1Н, СН), 3.26 м., (1Н, СН), 3.42 м., (2Н, СН2), 4.24 с., (1Н, ОН), 4.56 с., (1Н, ОН), 5.34 с., (1Н, ОН), 6.34 с., (1Н, ОН), 7.19-7.52 м, (4Н, аром.), 8.23 уш.с (2Н, NH2). Найдено %: С 57.58; Н 6.56; N 10.85. С18H23N3O6. Вычислено %: С 57.29; Н 6.14; N 11.13.
1-амино-5,6,7-тригидрокси-8-(гидроксиметил)-4-(2-(4-метоксифенил)-2-оксоэтил)-4,4a,5,6,7,8-гексагидро-3H-пиридо[1,2-c]пиримидин-3-он (2с).
Выход 65 %, Т.пл. 112-114 °С. ЯМР1Н, d, м.д.: 2.83 м., (2Н, СН2), 2.79 м., (1Н, СН), 2.80 м., (1Н, СН), 3.15 м., (1Н, СН), 3.28 м., (1Н, СН), 3.33 м., (1Н, СН), 3.37 м., (1Н, СН), 3.47 м., (2Н, СН2), 3.75 с., (3Н, ОСН3), 4.15 с., (1Н, ОН), 4.70 с., (1Н, ОН), 5.40 с., (1Н, ОН), 6.10 с., (1Н, ОН), 7.34-7.68 м., (4Н, аром.), 8.10 уш.с (2Н, NH2). Найдено %: С 57.58; Н 6.56; N 10.85. С18H23N3O6. Вычислено %: С 57.29; Н 6.14; N 11.13.
Найдено %: С 55.14; Н 6.21; N 10.37. С18H23N3O7. Вычислено %: С 54.96; Н 5.89; N 10.68.
Работа выполнена при финансовой поддержке РФФИ (грант № 16-03-00530).

