Гепатоцеллюлярная карцинома (ГК), преобладающая форма опухолей печени, занимает шестое место в мире по распространенности и второе по уровню смертности среди злокачественных новообразований [9]. Высокая смертность и низкая эффективность лечения ГК определяются поздними сроками выявления заболевания и устойчивостью к стандартным схемам химиотерапии [6]. Основными факторами риска развития ГК являются хроническая инфекция вирусами гепатита В (HBV) или С (HCV), цирроз печени, воздействие гепатоканцерогенов, метаболические нарушения. Поскольку по спектру генетических нарушений ГК является крайне гетерогенной опухолью, биомаркеров, которые с достаточной чувствительностью и специфичностью позволяли бы выявлять ГК, предсказывать ее рецидивирование или чувствительность к терапии, к настоящему времени не описано. Таким образом, поиск новых диагностических и прогностических маркеров ГК, а также идентификация потенциальных мишеней для направленной терапии этого типа опухолей являются важной задачей молекулярной онкологии, решение которой может существенно улучшить результаты лечения.
Гиперэкспрессия гена топоизомеразы II альфа (TOP2A) описана в нескольких типах злокачественных новообразований; TOP2A рассматривается как потенциальная мишень для противоопухолевой терапии или биомаркер для предсказания ответа опухолей на химиотерапию. Ген TOP2A кодирует ядерный белок размером 170 кДа, который регулирует топологические структуры ДНК во время транскрипции и репликации, сегрегацию хромосом и осуществляет контроль клеточного цикла. Топоизомеразы класса 2 осуществляют АТФ-зависимое расщепление двойных цепей ДНК с последующим лигированием, что способствует релаксированию суперскрученной ДНК и облегчает расплетание двойной спирали при репликации, рекомбинации или транскрипции [3]. Способность TOP2A «распутывать» сложные петли двуцепочечной ДНК определяют ее важную роль в расхождении хромосом при митозе и контроле генетической стабильности [4]. Это свойство позволяет рассматривать TOP2A как специфический маркер клеточной пролиферации.
TOP2A является мишенью для различных химиотерапевтических препаратов, таких как антрациклины (доксорубицин, эпирубицин) и эпиподофилотоксины (этопозид, тенипозид) [4]. Коамплификация гена TOP2A и онкогена HER2, расположенных на хромосоме 17, предложена в качестве маркера чувствительности опухолей молочной железы к терапии антрациклинами.
Активация экспрессии TOP2A в тканях ГК человека описана несколькими группами авторов на небольших выборках, в которые были включены образцы разной этиологии, и была наиболее выражена в случаях, ассоциированных с хронической инфекцией HBV или HCV [8]. Целью настоящего исследования стал количественный анализ изменения экспрессии гена TOP2A в парных образцах ГК, не ассоциированных с инфекцией вирусами гепатита, и неопухолевой ткани печени тех же пациентов.
Материалы и методы исследования
Для выделения тотальной клеточной РНК использовали замороженные в жидком азоте образцы опухолевой и неопухолевой ткани печени, измельченные в охлажденном гомогенизаторе Поттера. Выделение РНК проводили с использованием набора PureLink RNA Mini Kit (Ambion, США) согласно протоколу производителя. Концентрацию РНК определяли с помощью спектрофотометра NanoDrop 1000 (Thermo Scientific, США).
Из выделенной РНК с помощью метода обратной транскрипции с использованием случайных гексануклетидных праймеров и обратной транскриптазы M-MLV (Promega, США), получали препараты кДНК как описано ранее [1].
Для проведения количественной полимеразной цепной реакции с детекцией в реальном времени (ПЦР-РВ) использовали набор реактивов для проведения ПЦР-РВ в присутствии красителя SYBR Green I (Синтол, Россия). Подбор праймеров проводили при помощи программы Primer-BLAST [Интернет-сервис NCBI/Primer-BLAST]. Синтез праймеров осуществляла фирма «Синтол» (Россия). Для нормализации результатов ПЦР-анализа в качестве внутреннего контроля использовали уровень экспрессии гена TATA-box-связывающего белка (TBP). Были использованы следующие праймеры – TOP2A: прямой 5’-ATTCAGGCTCAACACGCTGGT-3’, обратный 5’-TGCAGCCCATTGGTCAGTTTG-3’ TBP: прямой 5’-TGCACAGGAGCCAAGAGTGA-3’, обратный 5’-ACTTCACATCACAGCTCCCCA-3’.
ПЦР проводили в амплификаторе «Bio-Rad CFX96» (Bio-Rad Laboratories, США). Детекцию и обработку результатов производили с помощью программного пакета «Bio-Rad CFX96 Manager software» (Bio-Rad Laboratories, США). Температура отжига праймеров была подобрана для достижения наибольшей эффективности ПЦР и составила 67,7°С для TOP2A и 62,8°С для TBP. Специфичность реакции проверяли, анализируя кривую плавления продуктов в ПЦР-смеси после реакции. Расчет уровней экспрессии генов проводили с помощью метода градуировочного графика. Эксперименты проводили в 3–4 независимых повторах. В каждом независимом повторе вычисляли двоичный логарифм каждого значения уровня экспрессии гена, после чего рассчитывали разность между нормализованными уровнями экспрессии TOP2A в соответствующих образцах опухолевой и неопухолевой ткани. Полученные в независимых повторах результаты усредняли. Достоверность наблюдаемых отличий определяли с помощью U-теста Манна-Уитни и критерия знаков для парных наблюдений, достоверными считали различия, для которых показатель p < 0,05.
Результаты исследования и их обсуждение
Для анализа экспрессии TOP2A было использовано 19 пар клинических образцов нормальных (по макроскопической оценке не затронутых опухолевым процессом) и опухолевых тканей пациентов с гистологически подтвержденным диагнозом «гепатоцеллюлярный рак», полученных при резекции опухолей. Были исследованы только случаи, не ассоциированные с инфекцией HBV или HCV. Клинические характеристики исследованных случаев представлены в табл. 1.
При анализе уровня экспрессии гена TOP2A с помощью метода ПЦР-РВ более чем двукратное статистически достоверное повышение экспрессии TOP2A в опухоли относительно соответствующего образца неопухолевой ткани печени наблюдалось в 17 из 19 исследованных случаев (89,5 %) (рис. А). Интересно, что наименее значимое повышение экспрессии TOP2A наблюдалось в двух случаях (3, 6), представленных образцами фиброламеллярных опухолей – отдельного подтипа ГК, возникающем преимущественно у пациентов молодого возраста при отсутствии цирроза и характеризующегося наличием «драйверной» хромосомной перестройки, приводящей к возникновению слитного белка DNAJB1–PRKACA с ярко выраженными онкогенным свойствами [2]. По данным полноэкзомных исследований, вследствие экспрессии химерного белка с сильным трансформирующим потенциалом, количество других потенциально онкогенных мутаций и хромосомных перестроек в таких опухолях значительно снижено. Максимальный уровень активации экспрессии TOP2A (более чем в 50 раз) выявлен у пациента с множественными хромосомными перестройками, по-видимому, связанными с хромотрипсисом.
Таблица 1
Клинические характеристики ГК, включенных в исследование
|
Характеристика образца |
Количество образцов (n=19) |
|
Возраст, лет (среднее значение ± SD) |
48,1 ± 19,2 |
|
Пол, мужской / женский |
11 / 8 |
|
TNM стадия, I / II / III / IV |
4 / 4 / 6/ 5 |
|
Размер опухоли, см (среднее значение ± SD) |
10,1 ± 5,6 |
|
Структура опухоли (трабекулярная/ тубулярная/ фиброламеллярная / скиррозная/ плейоморфная/ светлоклеточная) |
10/ 2/ 4/ 1/ 1/ 1 |
|
Капсула опухоли, отсутствует / слабовыраженная / выраженная / НД |
4 / 9 / 5 / 1 |
|
Инвазия в кровеносные сосуды, есть / нет |
11 / 8 |
|
Васкуляризация опухоли, низкая / средняя / высокая / НД |
2 / 5 / 5 / 7 |
|
Уровень дифференцировки, классификация Эдмондсон-Стайнер, G1 / G2 / G3 / Gx |
3/ 8 / 3 / 5 |
|
Внутрипеченочные метастазы, есть / нет |
8 / 11 |
|
Метастазы в лимфатические узлы, есть / нет |
3 / 16 |
|
Отдаленные метастазы, есть / нет |
1 / 18 |
|
Серологический уровень альфа-фетопротеина, низкий (<50 нг/мл) / высокий (>50 нг/мл) / НД |
9 / 9 / 1 |
|
Цирроз, есть / нет |
5 / 14 |
|
Некроз опухоли, есть / нет |
12 / 7 |
НД – нет данных, Gx – уровень дифференцировки не применим.
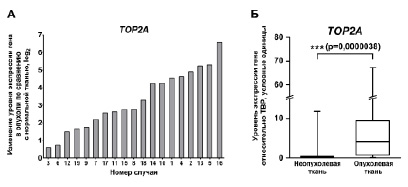
Рис. 1. Изменение экспрессии TOP2A в парных образцах ткани печени и ГК
А) Изменение уровня экспрессии TOP2A в образах ГК относительно соответствующих образцов неопухолевой ткани печени рассчитано как разница логарифмов нормализованного уровня экспрессии гена в опухолевой ткани и прилежащей неопухолевой ткани. Положительные значения полученной величины соответствуют повышению, а отрицательные – понижению экспрессии гена в опухоли. Результаты ранжированы по возрастанию изменений. – p < 0,05 (U-тест Манна-Уитни).
Б) Попарное сравнение экспрессии TOP2A во всех образцах опухолевой и неопухолевой ткани печени. – p < 0,001 (критерий знаков для парных наблюдений).
При попарном сравнении уровней экспрессии гена в объединенных группах образцов опухолевой и неопухолевой ткани сохранялась тенденция повышения экспрессии TOP2A в ГК относительно неопухолевой ткани печени (рис. Б). В неопухолевой ткани печени экспрессия TOP2A практически не детектировалась. Корреляционный анализ выявил достоверные положительные корреляции повышения экспрессии TOP2A в опухоли с возрастом пациента и наличием цирротических изменений в печени, ранее не описанные в литературе (табл. 2).
Таблица 2
Корреляция повышения экспрессии гена TOP2A с клиническими характеристиками опухолей
|
Параметр |
Коэффициент корреляции Спирмена |
Значение параметра p |
|
Пол мужской/женский |
-0,039 |
0,874 |
|
Возраст, лет |
0,635 |
0,003 |
|
Стадия опухолевого процесса, цифровая |
0,218 |
0,370 |
|
Размер наибольшего очага |
-0,149 |
0,542 |
|
Капсула опухоли (нет/ слабовыраженная/ выраженная) |
0,121 |
0,632 |
|
Инвазия в кровеносные сосуды (нет/ есть) |
0,325 |
0,175 |
|
Уровень васкуляризации узлов (нет/ низко/ умеренно/ высоко) |
-0,023 |
0,944 |
|
Уровень дифференцировки опухоли (высокая/средняя/ низкая/ не определяется) |
0,054 |
0,854 |
|
Метастазы в лимфатические узлы (есть/ нет) |
0,211 |
0,386 |
|
Удаленные метастазы (есть/ нет) |
-0,172 |
0,481 |
|
Уровень альфа-фетопротеина (низкий: <50 нг/мл, высокий: >50 нг/мл) |
0,161 |
0,524 |
|
Цирроз (есть/ нет) |
0,589 |
0,008 |
|
Спонтанный некроз опухоли (есть/ нет) |
0,359 |
0,132 |
|
Внутрипеченочные метастазы (есть/ нет) |
0,195 |
0,425 |
Активация экспрессия TOP2A описана при раке ротовой полости, носоглотки, пищевода, легкого, желчного пузыря, молочной железы, колоректальном раке и ряде других типов опухолей [4,8,10]. По данным Panvichian и соавторов, увеличение экспрессии TOP2A наблюдалось в 72.5 % (в 29 из 40) образцов ГК по сравнению с неопухолевой тканью, и было наиболее выражено в случаях, ассоциированных с инфекцией HBV [8].
Поскольку при гепатоканцерогенезе амплификации гена TOP2A не наблюдается, механизмы активации экспрессии этого гена в ГК пока неясны. Одним из предполагаемых механизмов является нарушение функции негативного регулятора транскрипции TOP2A – опухолевого супрессора ТР53, инактивация которого является одним из наиболее частых геномных нарушений при гепатоканцерогенезе [4].
Имеются данные о том, что повышенный уровень TOP2A связан с неблагоприятным прогнозом выживаемости пациентов с мелкоклеточным раком легкого, яичника, толстой кишки, молочной железы, предстательной железы и карциномой носоглотки. Ряд авторов предполагает, что повышение экспрессии TOP2A в ГК коррелирует с ранним возникновением опухоли (у пациентов моложе 40 лет), плохим прогнозом выживаемости и химиорезистентностью [5,10], а также, возможно, ассоциировано с появлением рецидивов [7,8]. При применении доксорубицина была показана корреляция возникновения лекарственной устойчивости с повышением уровня экспрессии TOP2A [7]. Можно ожидать, что дальнейшие исследования на расширенных выборках клинического материала позволят точнее определить клинический потенциал использования уровня экспрессии TOP2A в качестве маркера прогноза течения ГК и их чувствительности к химиотерапии с использованием ингибиторов этого фермента.
Заключение
В настоящем исследовании нами выявлено значительное повышение экспрессии гена TOP2A в подавляющем большинстве образцов ГК, не ассоциированных с инфекцией вирусами гепатита, по сравнению с неопухолевой тканью тех же пациентов, где этот ген практически не экспрессируется. Это наблюдение полностью согласуется с литературными данными о том, что высокий уровень экспрессии TOP2A является индикатором повышенного пролиферативного статуса опухолевых клеток. Таким образом, TOP2A может рассматриваться как перспективный маркер для оценки пролиферативного потенциала клеток ГК [8,10] и многообещающая мишень для направленной противоопухолевой терапии ввиду растущего числа новых ингибиторов этого фермента, находящихся в стадии разработки или клинических испытаний [4].

