Извлечение ионов поливалентных металлов из сточных вод промышленных предприятий в настоящее время является одной из актуальных проблем, связанной с одной стороны, с возможностью регенерации ценного сырья в промышленности, а c другой стороны, с решением природоохранных мероприятий [5-7].
В работе представлен анализ химической активности различных окислителей по отношению к ионам марганца. В качестве окислителей рассматривались: хлорсодержащие окислители, озон и перманганат-ионы.
Окисление хлором. При взаимодействии хлора с водой протекает его гидролиз с образованием хлорноватистой кислоты по схеме:
Сl2 + Н2О - НСl + НСlО.
Скорость окисления Mn (II) молекулярным хлором сильно зависит от рН раствора. Так, в кислой среде протекает обратная реакция, идущая с образованием молекулярного хлора, а в нейтральной и слабощелочной среде происходит разложение хлорноватистой кислоты с образованием атомарного кислорода, который является более сильным окислителем, чем Сl2 [2, 4, 8]:
НСlО - НСl + О•.
При рН =7 молекулярный хлор окисляет Мn2+ за 60 – 90 минут всего на 50%. При повышении рН воды до 8 путем подщелачивания ее известью процесс окисления Мn2+ хлором проходит более глубоко и за 60 – 90 минут завершается полностью [8]. Таким образом, использование молекулярного хлора в качестве окислителя нецелесообразно при извлечении марганца из кислых подотвальных вод, т.к. требуется дополнительный реагент для подщелачивания воды. Использование молекулярного хлора для реагентного окисления ионов Мn2+ нецелесообразно и с экологической точки зрения, т. к. хлор является ядовитым веществом и в случае его утечки существует опасность не только для обслуживающего персонала, но и для населения, проживающего на территории, прилегающей к водоочистному сооружению.
Окисление двуокисью хлора. Как окислитель СlО2 значительно сильнее Сl2. Он эффективен в достаточно широком диапазоне рН раствора. Двуокись хлора полностью окисляет ионы Мn2+ в растворе за 10 –15 минут (в зависимости от исходной концентрации металла в растворе) [8, 9]. Однако, использование двуокиси хлора в качестве реагента-окислителя имеет существенные недостатки: он сильно токсичен, взрывоопасен, не может храниться и перевозиться.
Окисление озоном. Озон – сильный и эффективный окислитель. Основным достоинством озона является то, что он разлагается в воде с образованием кислорода, т. е. обладает полной экологической безопасностью [8].
Озон легко окисляет ионы Mn2+ с образованием нерастворимых соединений по схеме:
МnSО4 + О3 + Н2О > МnО2 v + О2 + Н2SО4
Процесс полного окисления Mn (II) озоном протекает за 5 –10 минут при рН раствора в диапазоне от 6,5 до 7,0. Доза озона по стехиометрии составляет 1,45 мг на 1 мг двухвалентного марганца. Однако при озонировании техногенных вод озон подвержен каталитическому разложению образующимися оксидами марганца, и поэтому с увеличением концентрации ионов Mn2+ в воде доза вводимого озона должна прямопропорционально увеличиваться. Так при концентрации ионов Мn2+ 0,4 мг/дм3 расход озона составит 2 мг/мг Мn2+, а при концентрации ионов Мn2+ 0,8 мг/дм3 расход О3 составит 4 мг/мг Мn2+ [8, 9].
По мнению специалистов, работающих в области исследования процесса озонирования применительно к очистке сточных вод, использование озона в качестве реагента-окислителя для извлечения Mn (II) нерационально ввиду того, что данная технология имеет ряд существенных недостатков: сложность его производства на месте пользования, в связи с чем данная технология требует больших первичных затрат; большие дозы расходуемого озона и энергоемкость при его получении, достигающая 8,4–11 кВт на получение 1 кг озона; малое время жизни молекул; низкий коэффициент полезного действия озонаторов [8].
Окисление перманганатом калия. Перманганат калия окисляет ионы Мn2+ с образованием коллоидного осадка марганца (IV) по схеме:
3Мn2+ + 2КМnО4 + 2Н2О > 5МnО2v + 4Н+
В отечественной практике использование перманганата калия в качестве окислителя при извлечении ионов Мn2+ из сточных вод не находит широкого применения в связи с высокой стоимостью реагента. В основном этот метод применяется при очистке поверхностных и подземных вод, характеризующихся невысоким содержанием Mn (II) [9].
Окисление хлорной известью. Хлорная известь имеет следующий состав: СаО·3Сl·СаОСl·6Н2О. Высококачественная хлорная известь содержит 25–27% «активного хлора» [8]. Хлорная известь в растворе так же, как и молекулярный хлор, гидролизуется с образованием хлорноватистой кислоты (окислителя), однако, процесс протекает значительно медленнее, чем при гидролизе хлора, благодаря известной стойкости гипохлорита кальция в растворе. При этом техническая хлорная известь содержит много неактивных примесей, снижающих ее ценность как реагента-окислителя. Процесс полного окисления Mn (II) хлорной известью протекает за 60–90 минут при рН раствора в диапазоне от 4,5 до 10,5 [8]. Хлорная известь в качестве реагента-окислителя имеет ряд существенных недостатков: длительность протекания процесса окисления и необходимость специальных помещений для хранения и соответствующего оборудования для его предподготовки.
Окисление гипохлоритом натрия. Водные растворы гипохлорита натрия могут быть получены как химическим, так и электрохимическим путем. Наибольшей окислительной способностью характеризуются растворы NaClО, полученные электролизным путем из водных растворов NaCl [5, 6].
Из работ Флиса И.Е. и Тумановой Т.А. известно, что в растворах кислородных соединений хлора окислительные процессы обусловлены действием атомарного кислорода, образующимся в результате разложения «активного хлора» при взаимодействии с восстановителями (в качестве восстановителей могут выступать катионы металлов – Mn2+, Fe2+ и др.) [13, 14]:
НСlО > НСl + О٠
В чистых растворах гипохлоритов реакция сопровождается образованием хлоратов. Образование атомарного кислорода в результате разложения НСlО термодинамически менее вероятно, чем такой же процесс разложения ионов СlО-. При совместном присутствии в растворе хлорноватистой кислоты и гипохлорит-иона разложение их с образованием атомарного кислорода термодинамически более вероятно, чем процесс образования кислорода в результате разложения одного из компонентов [1-3].
Скорость реакции, протекающей с участием атомарного кислорода, зависит от рН среды. Выводы ряда авторов по данному вопросу [11-14], говорят о том, что в щелочной среде скорость переноса кислорода в 50 раз меньше, чем в нейтральной и слабокислой средах. Следовательно, наиболее активно процесс окисления в растворах «активного хлора» протекает с участием HClO, т. е. в диапазоне рН 3,5 – 7,0 (рис. 1).
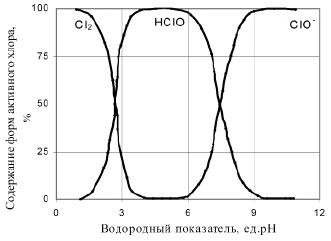
Рис. 1. Содержание форм «активного хлора» в растворе при различных значениях рН
В общем случае процесс окисления ионов Mn2+ электролизными растворами «активного хлора» до нерастворимых форм протекает по схеме:
Мn2+ + 2СlО٠ > 2Сl– + МnО2v
Мn2+ + НСlО + Н2О > Сl– + МnО2v + 3Н+
Согласно представленным уравнениям реакций, скорость и полнота протекания процесса окислительного осаждения ионов Mn2+ из растворов напрямую зависит от окислительной активности образующихся в процессе электролиза кислородных соединений хлора, а так же от способа контакта окислителя с марганецсодержащей системой [6, 10].
Более энергичное действие растворов гипохлоритов по наблюдается при непосредственной электрообработке растворов, содержащих одновременно ионы Мn2+ и Сl–. Такая особенности может объясняться тем, что в процесс электролиза, помимо гипохлоритов, образуются и побочные продукты, обладающие сильными окислительными свойствами (СlO2, НСlO, ClO٠, О٠, Н2О2, О3, О2, Сl2,) [11-14].
Использование электролизных растворов гипохлорита натрия в качестве реагента-окислителя при извлечении Mn (II) из технических растворов имеет следующие преимущества: процесс окисления обеспечивает использование безопасного реагента; позволяет проводить окисление всего объема сточной воды без создания зон с повышенной концентрацией реагента благодаря его дозированной и пропорциональной обрабатываемому потоку воды подаче; отсутствует вторичное загрязнение воды [4].
Таким образом, исходя из физико-химических особенностей возможных способов извлечения Mn (II) из технических растворов, а также учитывая окислительную активность рассмотренных окислителей, наиболее целесообразно для количественного извлечения ионов Mn2+ применять метод окислительного осаждения с использованием в качестве реагента-окислителя электролизных хлорсодержащих растворов.
Процесс окислительного осаждения Mn (II) «активным хлором» сопровождается образованием осадка, что обусловливает необходимость последующего применения процессов извлечения его отделения из водных растворов [6]. Наиболее эффективным и экологически безопасным методом извлечения дисперсной фазы металлов из водных растворов является электрофлотационный, который в сочетании процессов «осаждение-флотация» позволяет достигать высоких показателей извлечения марганца из растворов.

