Анализ опыта использования кислородных соединений хлора в качестве окислителя при окислении переходных металлов показал, что участниками окислительных процессов могут быть все компоненты растворов кислородных соединений хлора. Доля же участия этих компонентов в окислительных процессах зависит от рН и природы восстановителя. Скорость протекания процесса окисления в нейтральных растворах кислородных соединений хлора обусловлена только свойствами окислительной системы. При этом, реакции, протекающие в растворах «активного хлора», относятся к типу реакций, катализируемых в слабокислой и нейтральной средах ионами Н+ и ОН−. Ионы Н+ и ОН− в окислительно-восстановительных реакциях могут быть как участниками процесса, так и его катализаторами. Кроме того, реакции, протекающие в растворах «активного хлора», следует отнести к типу реакций общего кислотно-основного катализа, т.к. НСlО и СlО− являются сопряженными кислотами и основанием [2, 6, 8]:
НСlО + H2O - Н3О+ + СlО−
СlО− + H2O - НСlО + ОН−
В щелочной среде катализ ионами Н+ и ОН– отсутствует, а подвижность ионов СlО− значительно меньше, чем в кислой и нейтральной.
В растворах кислородных соединений хлора окислительные процессы обусловлены действием атомарного кислорода, образующегося в результате разложения «активного хлора» при взаимодействии с восстановителями (в качестве восстановителей могут выступать катионы металлов: Mn2+, Fe2+ и др.) [5, 7]:
Mn2+
НСlО > НСl + О·
На скорость кислородного разложения «активного хлора» значительно влияет присутствие катализаторов. Известно, что в качестве катализаторов могут выступать ионы переходных металлов: Mn, Cr, Fe и др. При этом процесс каталитического разложения «активного хлора» может протекать с образованием свободных радикалов СlО−, CI−, ОН−, Н−, неустойчивость которых может вызывать цепные реакции. В образовании радикалов участвуют как НСlО, так и ион СlО−[9-12].
В нейтральной и слабокислой средах разложение «активного хлора» происходит по следующему механизму [11, 12]:
НСlО + СlО− > О2 + 2Сl– + H+
НСlО + 2СlО− > СlО3− + 2Сl– + H+
В кислой среде разложение идет по следующим реакциям:
НСlО > О2 + 2Сl− + 2H+
3НСlО > СlО3− + 2Сl− + H+
Прокопчиком А.Ю. [10] разложение гипохлорита в щелочной среде также рассматривается постадийно из двух последовательных реакций хлорид-хлоратного типа:
СlО− + СlО− - СlО2− + Сl−
СlО2− + СlО− - СlО3− + Сl?
и хлорид-кислородного типа:
СlО− + СlО− - 2Сl− + О2
Самоокисление гипохлоритной системы и образование хлората ? сравнительно медленный процесс. Условия, при которых разложение гипохлорита с образованием кислорода значительно ускоряются, приводят к быстрому уменьшению концентрации тех составляющих, окисление которых ведет к образованию хлората [2].
На скорость кислородного разложения «активного хлора» значительно влияет присутствие катализаторов [11, 12]. Ряд авторов указывают [9, 12], что в качестве катализаторов могут выступать ионы металлов переменной валентности. При этом процесс каталитического разложения гипохлорита может протекать с образованием свободных радикалов СlО-, CI?, ОН-, Н?, неустойчивость которых может вызывать цепные реакции. В образовании радикалов участвуют как хлорноватистая кислота, так и ион СlО- [10].
Активные радикалы СlО- могут способствовать реакциям образования атомарного кислорода, и ОН- радикала:
2СlО- + СlО- + ОН- > ЗСl– + ОН- + 3/2О2
(процесс, определяющий скорость разложения гипохлорита)
ОН- + ОН- > Н2О + О-
(быстрый процесс выделения атомарного кислорода)
ОН- + СlО- > СlО- + ОН–
(менее вероятный процесс продолжения побочного развития цепи в сильнощелочной среде).
По данным работ [126, 131] каталитическая активность металлов уменьшается в ряду Со2+ > Ni2+ > Сu2+ > Fе2+. В отличие от этих ионов соединения марганца значительно повышают степень окисления в сильнокислой и слабощелочной средах [12].
Высокую окислительную способность растворов «активного хлора» в присутствии марганца также отмечают в работе [9]. Марганец, по сравнению с другими металлами, имеет отличительную особенность − он способен менять свою валентность на 4 и 5 единиц (от Mn+2 до Mn+7), оставаясь устойчивым в водном растворе. Энергетические затраты при последующем окислении марганца мало зависят от степени его окисления, т.е. ион марганца может одновременно взаимодействовать с несколькими молекулами «активного хлора». Этим можно объяснить высокую активность марганца [11].
В присутствии ионов металлов переменной валентности, помимо процесса восстановления «активного хлора» до хлорид-ионов могут так же протекать процессы восстановления хлоратов до ионов Cl− [8, 12]. Поэтому можно предположить, что атомарный кислород можно получить каталитическим разложением «активного хлора» во всем диапазоне рН, в котором хлор находится в растворе в виде кислородных соединений (рисунок).
Таким образом, на основании вышеизложенного, можно констатировать, что процесс окисления ионов Mn2+ в растворе до нерастворимых форм Mn+3 и Mn+4 будет протекать под действием атомарного кислорода, образующегося в результате разложения «активного хлора» ионами Mn2+. Причем в реакции разложения «активного хлора» Mn (II) будет выступать не только как восстановитель, но и как катализатор, что значительно ускоряет время протекания процесса.
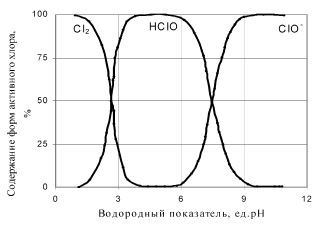
Содержание форм активного хлора в растворе при различных значениях рН [8]
В общем случае процесс окисления ионов Mn2+ электролизными растворами «активного хлора» до соединений Mn+3, Mn+4 протекает по схеме:
2Мn2+ + СlО- + 6ОН- > Сl− + +2МnО(ОН)2 v + Н2О
Мn2+ + НСlО + Н2О > Сl− + МnО(ОН)v + 2Н+
Согласно представленным уравнениям реакций, скорость и полнота протекания процесса окислительного осаждения ионов Mn2+ из растворов напрямую зависит от окислительной активности образующихся в процессе электролиза кислородных соединений хлора, а так же от технологическим параметров процесса электрообработки хлорсодержащих растворов.
Концентрация «активного хлора», образующегося в процессе электролиза, зависит от материала анода, исходной концентрации ионов Cl− в растворах, плотности тока на электродах, продолжительности электролиза и ионного состава растворов.
При электролизе растворов, содержащих ионы Cl–, на аноде возможно протекание реакций выделения хлора и кислорода. Для того чтобы в процессе электролиза преимущественно выделялся хлор, в работе использовался титановый анод с рутениевым покрытием, на котором Cl2 выделяется с минимальным, а О2 с максимальным перенапряжением.
Экспериментальные исследования влияния основных параметров процесса электролиза на выход «активного хлора» показали, что, исходя из экономической и экологической целесообразности, процесс электрообработки хлоридсодержащих растворов рекомендуется проводить при исходной концентрации ионов Cl− в системе не менее 600 мг/дм3. Кроме того установлено, что концентрация «активного хлора» в процессе электролиза возрастает с увеличением плотности тока, подаваемой на электроды, и времени электрообработки.
Также следует отметить, что выход по току «активного хлора» существенно зависит от исходной концентрации в обрабатываемых растворах ионов SO42–и СO32–. Данные ионы имеют примерно одинаковую с хлорид-ионами подвижность в растворах, поэтому могут одновременно разряжаться на анодах, тем самым снижая выход целевого продукта электродной реакции – «активного хлора». При этом карбонаты и гидрокарбонаты могут также окислять выделяющийся в процессе электролиза хлор.
Проведенные экспериментальные исследования по установлению оптимальных параметров работы электролизера при электроокислительном осаждении ионов Mn (II) в виде дисперсной фазы (Сисх. Mn2+ до 200 мг/дм3) показали, что процесс электрообработки растворов эффективно и экономически целесообразно проводить при исходной концентрации ионов Cl– не менее 600 мг/дм3, в интервале анодной плотности тока (IsА) от 100 до 300 А/м2 (в зависимости от исходной концентрации ионов Mn2+ в растворе), в течение 1 минуты.
Выводы. Таким образом, для количественного осаждения ионов поливалентных металлов (и в частности ионов Mn2+) из технических растворов в качестве реагента-окислителя наиболее эффективно использовать электролизные растворы, образующиеся при электрообработке хлоридсодержащих водных систем.
На основании проведенного анализа изменения окислительных свойств кислородных соединений хлора, можно констатировать, что окислительный процесс во многих случаях происходит с разложением «активного хлора» на атомарный кислород и хлорид-ион. Атомарный кислород участвует в окислительном процессе, а хлорид-ион остается в растворе. Присутствие катионов поливалентных металлов оказывает катализирующее действие на процесс восстановления «активного хлора», что значительно ускоряет время протекания процесса.

