В настоящее время в медицине одним из актуальных направлений помощи больным с повреждениями и заболеваниями опорнодвигательного аппарата является поиск новых технологий, основанных на использовании имплантатов с биоактивным покрытием. Их основная цель – не только гарантировать успех лечения, но и осуществить это в очень короткие сроки [1, 2, 8].
Остеоиндуктивные и остеокондуктивные свойства используемых материалов зависят от химического состава поверхности (наличие биоактивных элементов), ее топографии и архитектоники (шероховатость, размер пор) [10].
Доказано, что металлические имплантаты, поверхность которых покрыта наночастицам фосфатов кальция, стимулируют остеогенную активность. при этом степень последней может зависеть от способа нанесения биоактивного слоя [5–7, 9].
Одним из критериев обоснования использования новых видов имплантационных материалов и изделий медицинского назначения являются результаты доклинических испытаний. Основная цель данного вида исследований заключается в определении биологического действия и местной реакции тканей на имплантацию.
В этом плане, одним из информативных является методов оценки местной температурной реакции, что косвенно может отражать особенности локального кровообращения, интенсивность воспалительной реакции и активность процессов костеобразования в целом. в клинической практике этот метод может использоваться в качестве дополнительного при диагностике, прогнозе течения и оценки качества проводимого лечения различных патологических состояний опорно-двигательной системы [3, 4].
Целью настоящего исследования являлось определение температурной реакции тканей в области имплантации накостных титановых пластин с биоактивным покрытием, нанесенным разными способами.
Материалы и методы исследования
Проведено пилотное исследование на взрослых (старше 1 года) беспородных собаках обоего пола. Животные были разделены на 4 серии в зависимости от вида имплантируемого изделия и способа нанесения биоактивного покрытия.
Во всех случаях в условиях операционной с медиальной поверхности диафиза большеберцовых костей моделировали повреждение надкостницы. Для этого выполняли продольный разрез параоссальных мягких тканей протяженностью 2,5 см. Надкостницу разрезали так же в продольном направлении и при помощи шпателя отслаивали от компактной кости. После этого на корковую пластинку устанавливали титановые накостные имплантаты, выполненные в виде пластин шириной 1,0 см, длиной 2,0 см и толщиной 1 мм. при этом пластины имели изгиб, повторяющий рельеф кости. Затем на надкостницу и мягкие ткани накладывали узловые швы. Все изделия были изготовлены с использованием аддитивных технологий (методом 3D печати).
Во всех сериях на поверхности имплантатов был слой биоактивного покрытия на основе гидроксиапатита.
В серии 1 использовали пластины без отверстий (n=3), а в качестве способа нанесения покрытия был применен метод микродугового оксидирования (КФ МДО). Данная технология позволяет формировать покрытия с развитой пористой поверхностью.
В серии 2 на пластины без отверстий (n=3) было нанесено покрытие методом высокочастотного магнетронного распыления (КФ ВЧМР). Оно позволяет формировать тонкие плотные, эластичные кальций-фосфатные покрытия с высокими адгезионными свойствами.
В серии 3 и 4 использовали пластины с отверстиями с покрытием нанесенным методом КФ МДО (n=3) и КФ ВЧМР (n=3) соответственно.
Температурную реакцию покровных тканей в области расположения имплантата регистрировали в периоды: перед операцией, через 7, 14, 21 и 28 суток после выполнения оперативного вмешательства. Для этого использовали реограф-полианализатор РГПА-6/12 «РЕАН-ПОЛИ» (НПКФ «МЕДИКОМ-МТД», Россия) и входящий в комплект принадлежностей, контактный температурный датчик термисторного типа – ДТ-3. Показания снимали с участков, освобожденных от шерстного покрова. в качестве физиологической нормы, которую принимали за 100%, использовали результаты, полученные перед операцией, а так же данные от 15 клинически здоровых (интактных) животных соответствующего возраста.
Дополнительно выполняли визуальную оценку состояния мягких тканей в проекции имплантации.
Исследования проводили в утренние часы перед первым кормлением. Температура воздуха в помещении во время проведения обследования составляла 28,6 ± 0,1°С.
При выборе основных периодов обследования руководствовались регламентирующими стандартами, относящимися к времени кратковременной имплантации биостабильных материалов, которое в норме составляет от 1 до 4 недель (по «ГОСТ Р ИСО 10993–6–2009. Национальный стандарт Российской Федерации. Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 6. Исследования местного действия после имплантации»).
Анализ количественных данных проводили методами описательной статистики. Результаты исследований обрабатывали методами непараметрической статистики (критерий Вилкоксона для независимых выборок). Различия показателей считали достоверными при р ? 0,05.
Эксперименты выполнены на базе вивария ФГБУ «РНЦ «ВТО» им. акад. Г.А. Илизарова» Минздрава России. Животные содержались в индивидуальных боксах (по одному). Получали одинаковые стандартные, сбалансированные по питательным веществам, корма и чистую питьевую воду.
До начала исследований было получено одобрение Комитета по этике ФГБУ «РНЦ «ВТО» им. акад. Г.А. Илизарова» на их выполнение.
Результаты исследования и их обсуждение
При визуальной оценке состояния мягких тканей в проекции имплантации тестируемых материалов определили, что процессы эпителизации раневых поверхностей в области швов протекали без особенностей. Признаков острого воспаления, гематомы и очагов некроза выявлено не было. Швы были сняты в общепринятые сроки (через 7–10 суток после оперативного вмешательства).
При изучении температурных данных выявили, что эти значения у интактных животных и экспериментальных собак в области планируемого оперативного вмешательства варьировали в диапазоне 30,06–33,76°С и в среднем составляли 31,43±1,1°С.
Во всех сериях опытов через 7 суток после операции регистрировали однонаправленные изменения локальной температуры тела в сторону увеличения, значения которой между собой достоверных различий не имели (р=0,8). Разница показателей по отношению к нормальным значениям составляла в среднем 2,78±0,5°С (p=0,002). Следует отметить, что в сериях 1 и 3, когда применяли накостные пластины с покрытием, нанесенным методом КФ МДО, температура тканей в зоне расположения имплантатов была выше на 0,75°С в сравнении с аналогичными значениями при использовании пластин покрытых методом КФ ВЧМР (серии 2 и 4).
К 14 суткам эксперимента температура тканей продолжала равномерно увеличиваться во всех сериях. Ее значения были достоверно выше нормы на 3,69±0,3°С (p=0,002) и составляли 35,12±0,3°С. в этот период, не смотря на отсутствие достоверных различий между сериями, температура тканей в сериях 1 и 2 (пластины без отверстий) была выше на 0,42°С чем в случаях, когда использовали имплантаты с отверстиями.
Через 21 сутки поле операции регистрировали наиболее выраженные различия изучаемого показателя между сериями в зависимости от типа изделия. Так, в сериях с пластинами без отверстий (1 и 2) температура в области расположения имплантата продолжала увеличиваться и составляла в среднем 35,29±0,3°С. Тогда как в сериях 3 и 4 – происходило ее резкое достоверное понижение до верхней границы нормы. у этих животных разница по отношению к предыдущему сроку обследования была в среднем 2,0°С.
К окончанию эксперимента во всех сериях температура тканей в проекции имплантации снижалась до нормальных значений. при этом достоверное уменьшение по отношению к предыдущему сроку обследования было зарегистрировано в случаях использования накостных пластин без отверстий (р=0,03).
Динамика локальной температуры тканей в периоде эксперимента представлена на рисунке.
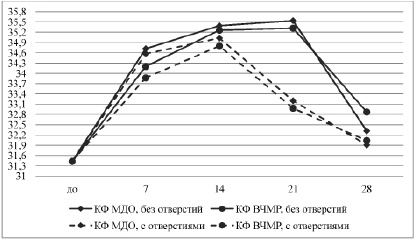
Динамика температурной реакции тканей в области расположения накостных имплантатов с биоактивным покрытием, изготовленных из титановых сплавов по аддитивным технологиям
Таким образом, в результате выполненного исследования была определена местная температурная реакция тканей на материалы, имплантируемые под поврежденную надкостницу большеберцовой кости собаки в периоды 1–4 недели эксперимента. в качестве тестируемых образцов использовали накостные пластины без отверстий и с отверстиями, изготовленные из титана по аддитивной технологии, методом 3D печати. Каждая из пластин была покрыта слоем гидроксиапатита, нанесенного по технологии микродугового оксидирования, либо высокочастотного магнетронного распыления.
Анализ полученных результатов показал, что в течение первых двух недель после операции температура тканей в области расположения имплантатов резко повышалась и ее динамика особо не зависела от типа тестируемого изделия, а также способа нанесения биоактивного покрытия. не смотря на то, что в этот период при использовании накостных пластин с покрытием, нанесенным методом КФ МДО, температурные значения были несколько выше, чем у изделий с покрытием КФ ВЧМР, мы считаем, что подобный эффект мог быть обусловлен в большей степени самой процедурой хирургического вмешательства.
Наиболее значимые различия температуры между сериями были зарегистрированы через 3 недели эксперимента. В этот период установили, что динамика температурной реакции зависела от типа имплантата (с отверстиями либо без отверстий), а способ нанесения биоактивного покрытия не оказал особого влияния.
Заключение
Полученные данные в последующем будут использованы как дополнительные, при оценке особенностей кровообращения в тканях области имплантации тестируемых изделий. Будут учитываться при анализе результатов гистологических исследований. Подобный комплексный подход позволит определить оптимальную пористость и топографию поверхности для накостных и внутрикостных имплантатов с биоактивным покрытием на основе гидроксиапатита, изготовленных из титановых сплавов с помощью аддитивных технологий.
Данное исследование выполнено при финансовой поддержке гранта РНФ «Установление закономерностей остеоинтеграции медицинских имплантатов на основе аддитивного производства с биоактивным покрытием», соглашение № 16–17–00176, в рамках задачи по выявлению оптимальной пористости и топографии поверхности для адгезии биоактивного покрытия на основе гидроксиапатита.

