Целью данного исследования является выявление зависимости реакционной способности соединений от прочности химических связей и энергетических закономерностей на примере цепных реакций галогенов с водородом.
Цепные реакции весьма распространены как в неорганической, так и в органической химии. По цепному механизму осуществляются, например, процессы:
• хлорирования метана, этилена и других непредельных соединений; [5]
• окисления углеводородов, а также сульфитов до сульфатов, бензальдегида до бензойной кислоты;[3]
• крекинг углеводородов;[4]
• очень многие реакции полимеризации и другие.
Известно, что цепная реакция водорода с хлором может идти с такой скоростью, что смесь реагентов взрывается. Однако не всем известно, что пары брома также реагируют с водородом по цепному механизму, только эта реакция идет при более высокой температуре и значительно медленнее.
А реакция водорода с парами иода идет при еще более высокой температуре и не является цепной.
Возникает вопрос о причине таких различий.
Суммарные уравнения реакций:
H2 + Cl2 = 2HCl,
H2 + Br2 = 2HBr,
H2 + J2 = 2HJ.
не указывающие на их механизм, не дают ответа на этот вопрос. Более того, известно, что энергия связи в молекулах хлора наибольшая, тогда как связь в молекулах иода самая слабая:
|
Химическая связь |
Cl – Cl |
Br – Br |
J – J |
|
Есв., кДж/моль |
243 |
193 |
149 |
Постараемся выяснить, почему наибольшей реакционной способностью обладает именно хлор, хотя его молекулы труднее всех распадаются на атомы.
Причина связана с механизмом цепной реакции, в ходе которой разрыв химической связи в одной единственной молекуле хлора приводит к образованию очень большого числа молекул продукта реакции – хлороводорода (в благоприятных условиях их может образоваться до миллиона на одну распавшуюся молекулу хлора). Схематически механизм цепной реакции представлен в верхней части таблицы 1.
Первую стадию реакции – распад молекул хлора на атомы – называют стадией зарождения цепи (инициирования):
Cl2 > 2Cl˚
Реакции образования новых активных частиц – атомов хлора – происходят сравнительно редко: связь Cl – Cl прочная, поэтому энергия активации этой реакции высока и реакция идет лишь при повышенной температуре или ультрафиолетовом облучении.
Хлороводород образуется в результате чередования двух реакций, при этом количество атомов хлора, образовавшихся при первоначальном распаде молекул Cl2, остается неизменным:
Cl˚ + H2 > HCl + H˚
H˚ + Cl 2 > HCl + Cl˚
Эти две реакции называют реакциями продолжения цепи [2].
Реакции продолжения цепи будут повторяться одна за другой до тех пор, пока два атома хлора случайно не окажутся рядом друг с другом. Встреча двух атомов приводит к образованию молекулы хлора, в результате цепи обрываются (обрыв цепи). Так как концентрация атомов хлора исключительно мала по сравнению с концентрацией молекулярного хлора и водорода, соединение атомов хлора происходит очень редко, что и объясняет большую длину цепи. Атомы водорода тоже могут встречаться друг с другом или с атомами хлора, что также приводит к обрыву цепей. Однако, вероятность таких столкновений еще меньше, так как вследствие значительной реакционной способности концентрация атомов водорода примерно в 100 раз меньше концентрации атомов хлора. Поэтому обрыв цепи можно связать только с взаимодействием атомов хлора друг с другом:
2Cl˚ > Cl2
Хлороводород образуется в ходе двух реакций продолжения цепи. Энергетика именно этих реакций определяет в основном скорость и даже саму возможность цепного процесса. Рассмотрим в связи с этим тепловые эффекты и энергии активации двух реакций продолжения цепи в случае хлорирования, бромирования и иодирования водорода (левая часть таблицы 1).
При взаимодействии водорода с хлором первая реакция практически термонейтральна (ΔН = 5 кДж/моль), а вторая – экзотермическая (ΔН = -189 кДж/моль), соответственно, значения энергии активации обеих реакций малы, и они идут с высокой скоростью уже при комнатной температуре. Изменение энергии при переходе от реагентов к продуктам, включая энергию активации этих реакций представлен кривой справа на Табл. 1; видно, что общий выигрыш в энергии велик (184 кДж при образовании 2 моль HCl), если в системе в единицу времени образуется достаточно много атомов хлора, то очень быстрое выделение энергии в ходе этой реакции и приводит к взрыву. Благоприятная энергетика обеих стадий продолжения цепи объясняет также тот факт, что при наличии атомов хлора, образовавшихся в результате облучения смеси ультрафиолетовым светом, хлорирование водорода идет уже при комнатной температуре.
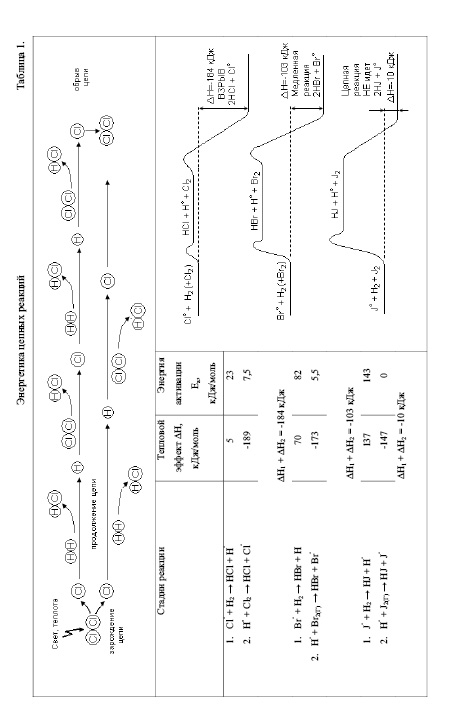
В случае бромирования водорода суммарная реакция продолжения цепи также экзотермична, имеет довольно большой тепловой эффект (ΔН = -103 кДж на 2 моль HBr) [1]. Однако, известно, что смесь водорода с бромом не взрывается, а длина цепи в этой реакции значительно меньше, чем в реакции водорода с хлором. Объясняется это тем, что первая реакция продолжения цепи имеет высокую энергию активации (более 80кДж/моль); атом брома с большим трудом, чем атом хлора, отрывает атом водорода от молекулы Н2, потому что прочность образующейся при этом новой связи H – Br меньше прочности связи H – Cl (365 и 432 кДж/моль соответственно). Таким образом и обе реакции продолжения цепи, и суммарная реакция в целом идут намного медленнее, чем в случае хлорирования, - самая медленная стадия фактически тормозит и другие. Действительно, одна из двух повторяющихся реакций не может перегонять по скорости другую: обе они должны идти с одинаковой скоростью. Значит, энергетический барьер на одной из стадий цепной реакции становится барьером и для реакции в целом, поэтому реакция брома с водородом при прочих равных условиях идет значительно медленнее, чем реакция хлора с водородом.
Если посмотреть на энергетические характеристики и энергетический профиль реакции иода с водородом, то станет ясно, что картина еще более неблагоприятна для для протекания цепной реакции. Из-за малой прочности связи в молекуле H – J реакция отрыва атома водорода от молекулы Н2 атомом иода энергетически не выгодна: разрывается очень прочная связь Н – Н (436 кДж/моль), а образуется гораздо менее прочная связь H – J (299 кДж/моль). В результате, несмотря на экзотермичность второй реакции, общий энергетический баланс двух реакций продолжения цепи оказывается почти нулевым: ΔН = -10кДж/моль.
Высокая эндотермичность и, соответственно, высокая энергия активации первой реакции приводит к тому, что взаимодействие водорода с иодом вообще не может осуществляться по цепному механизму. Эта реакция идет при высокой температуре, но по другому механизму, который упрощенно можно представить так: два атома, образовавщиеся при диссоциации молекулы иода, одновременно как бы растаскивают молекулу водорода на атомы и образуют сразу две молекулы HJ:
2J˚ + H2 > 2HJ
Если сравнить энергию связи в молекулах (432 кДж/моль) и HJ (299 кДж/моль), то видно, что в случае образования сразу двух молекул HJ выделяется энергия, которой достаточно для разрыва связи Н – Н. Поэтому энергия активации этой реакции значительно ниже, и она успешно конкурирует с более медленной цепной реакцией. Скорость же суммарной реакции водорода с иодом определяется в основном скоростью диссоциации молекул иода на атомы, а эта реакция возможна только при высокой температуре.
Ранее считалось, что реакция водорода с иодом является элементарной, т.е. идущей непосредственно при столкновении молекул H2 и J2, мы постарались показать ее более сложный механизм.
Рассматривая энергетические кривые таблицы 1, необходимо учитывать, что уровни энергии приведены для всех реагентов в газовой фазе, тогда как стандартное состояние принято для газообразного хлора, жидкого брома и кристаллического иода. Поэтому на кривых учтены энергии.
Выводы
1. В работе проведено исследование механизмов цепных реакций хлорирования галогенов (хлора, брома, иода) с водородом.
2. Выявлено зависимость скоростей реакций хлора, брома, иода с водородом и их зависимость от энергии связей и теплового эффекта.
3. Построены энергетические профили всех трех процессов позволившие сделать заключение о скоростях всех трех процессов.

