Целью данного исследования является изучение отклонения значений рН в приэлектродных областях при проведении операций электрохимических технологий [3]. Ранее этому вопросу внимания не уделялось, поэтому наблюдались серьезные отклонения в технологических процессах, связанных с операциями по омеднению и никелированию образцов.
В связи с этим были сформулированы задачи исследования: установить факт изменения кислотности и сравнить наблюдаемые значения рН с вычисленными теоретически, с последующим внесением изменений в технологические карты.
Вопросом исследования, таким образом, явилось комплексное экспериментальное изучение следующих разделов химии, физики и математики:
1. Электролитическая диссоциация кислот, оснований, солей, воды. Сильные и слабые электролиты [3].
2. Ионные равновесия в водных растворах. Константа диссоциации. Ионное произведение воды [1].
3. Логарифмическая функция и ее свойства, рН водных растворов [4].
4. Реакции ионного обмена и окислительно – восстановительные процессы в водных растворах. Влияние рН раствора на протекание реакций [4].
5. Механизм электропроводности растворов электролитов. Подвижность ионов. Числа переноса ионов [2].
6. Электролиз. Катод и анод. Католит и анолит. Условия и причины изменения рН католита и аналита [6].
7. Законы Фарадея [3].
Методика исследования состояла в следующем: эксперименты поставлены в прямоугольной электрохимической ячейке из полистирола размером 15*2*1,5 см3 с инертными (графитовыми электродами). В ячейку заливали по 30 мл раствора. Использовали 0,1М K2SO4. В отдельных опытах применяли трехкомпонентный раствор:
0,1М K2SO4 + 0,05M ZnSO4.
Электролиз проводили в режиме постоянного тока (от 10 до 50 мА). О кислотности растворов судили с помощью индикаторов (фенолфталеин, метиловый оранжевый, лакмус); для определения рН отбирали пробы и использовали универсальную индикаторную бумагу (рН 0-12).
Результаты эксперимента
В рабочем растворе содержатся ионы K+, SO42-, H+ и OH-, концентрации которых соответственно равны 0,2, 0,1~ 10-7 и ~ 10-7 моль/л. При включении электрического тока катионы K+ и Н+ движутся к катоду, анионы SO42- и OH- к аноду. На электродах ни K+ ни SO42- электрохимическим превращениям не подвергаются; вместо них разлагается вода.
Катод:
4 Н2О + 4e > 2Н2^ + 4ОН- (1)
Анод:
2 Н2О - 4e >О2^ + 4Н+ (2)
Следовательно, мигрирующие к катоду ионы К+ и выделяющиеся электрохимически ионы OH- приводят к накоплению КОН, т.е. к подщелачиванию катодного пространства (католита). Аналогичным образом было сделано заключение о подкислении анолита вследствии накопления H2SO4.
В работе было дано экспериментальное подтверждение изменения кислотности приэлектродных зон.
1. Подщелачивание католита зарегистрировано с помощью фенолфталеина, добавленного в рабочий раствор K2SO4. При включении тока поверхность графитового катода приобретает малиновый цвет, постепенно распространяющийся на прикатодную область ячейки. Замена индикатора на метиловый оранжевый позволила наблюдать изменение кислотности как в католите, так и в анолите.
2. Другое доказательство подщелачивания католита получено с помощью ионов электрохимически отрицательных металлов, восстановление которых на графитовом катоде затруднено и которые способны к образованию малорастворимых гидроксидов (Zn2+, Mg2+, Al3+ и др.). Как уже говорилось, в нашем исследовании электролизу подвергался раствор с добавкой ZnSO4. Через несколько секунд после включения тока католит помутнел из-за образования гидроксида цинка (II).
3. Значимым результатом представляется получение зависимости рН раствора от координаты х. Расположив электроды на максимальном удалении друг от друга (для катода х=0, для анода х≈15 см), включили ток на определенное время, а после прекращения электролиза, не допуская перемешивания раствора, быстро отбирали пробы остроконечной пипеткой в разных точках ячейки. Каждую пробу испытывали на рН. Из Рис. 1 следует, что первоначально нейтральный раствор изменил рН вблизи катода до 11, а вблизи анода до 2,5-3.
Рис. 1. Изменение рН раствора вдоль ячейки после пропускания электрического тока (10 мА) в течение 5 минут
Получив подтверждение ожидаемым изменениям рН, перешли к изучению количественных аспектов явления. Из уравнений реакций (1) и (2) следует, что H+ и OH- выделяются в строго эквивалентных количествах. Этот факт был доказан опытным путем (п. 4 и 5).
При изменении направления тока катод и анод меняются местами, развитие процессов идет в противоположном направлении. Пропустив определенное количество электричества 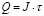 одного направления, изменяли полярность включения и снова пропускали тот же заряд. В результате такого цикла установили, что рН приэлектронных зон постепенно, по завершении диффузионных процессов в зонах, восстанавливается до исходного значения.
одного направления, изменяли полярность включения и снова пропускали тот же заряд. В результате такого цикла установили, что рН приэлектронных зон постепенно, по завершении диффузионных процессов в зонах, восстанавливается до исходного значения.
В перемешиваемом растворе электролиз не должен сопровождаться изменением рН. Заменив прямоугольную ячейку химическим стаканом с магнитной мешалкой регистрировали постоянное значение рН (≈7) в течение длительного опыта.
В заключительной части исследования предстояла задача сопоставить наблюдаемые изменения рН с теоретически вычисленными значениями. С этой целью катодное и анодное пространство отделяли от центральной части ячейки диафрагмами из картона (координаты диафрагм х1=2,5 и х2=12,5), что позволило говорить об относительно определенных значениях объемов католита и анолита (Vкат=Vан=(2,5*2*1)см3=5 мл и получить более резкий скачок в изменении рН по координате.
Расчет рН был проведен для католита 1 (Рис. 2). Предположим, что через ячейку пропущен 1 F электричества (F- постоянная Фарадея). Тогда согласно реакции (1), в католит выделится 1 моль ионов OH. Одновременно в результате миграции из католита в центральную часть ячейки уйдет tˉ/2 моль ионов SO42-, а из центральной части в католит прибудет t+ моль ионов К+ (tˉ и t+ - числа переноса ионов SO42- и К+ соответственно, причем tˉ + t+=1). Баланс количества вещества (+1 моль ОНˉ- tˉ/2 моль SO42- + t+ моль К+) показывает, что в католите сохраняется электронейтральность и появляется 1 моль КОН.
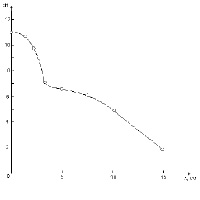
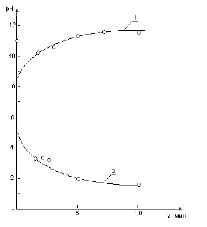
Рис. 2. Зависимость рН католита (1) и анолита (2) от времени электролиза. Сплошные линии – значения, рассчитанные в соответствии с уравнениями (4) и (6) при силе тока J=10 мА. Кружки – значения полученные в опыте
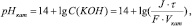
Следовательно, произвольному заряду 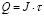 соответствует количество гидроксида калия, которое можно рассчитать по формуле
соответствует количество гидроксида калия, которое можно рассчитать по формуле
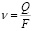
.
Тогда формула для расчета концентрации щелочи будет иметь вид:
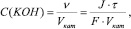
(3)
где J – сила тока, А; 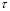 - время электролиза, с; F=96500 Кл/моль – постоянная Фарадея; Vкат - объем католита, л.
- время электролиза, с; F=96500 Кл/моль – постоянная Фарадея; Vкат - объем католита, л.
Поскольку для щелочи С(ОНˉ)=С(КОН), а для водного раствора С(Н+)?С(ОН?)=10-14 (ионное произведение воды), приходим к уравнению изменения рН католита:
(4)
Рассуждая аналогичным образом, находим для анодного пространства:
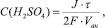
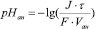
(5)
и
(6)
Следует подчеркнуть, что формулы (3) – (6) приближенные, поскольку при их выводе не учтено неизбежное «просачивание» ионов ОНˉ и Н+ через диафрагмы. По этой причине вычисленные значения рН не зависят от чисел переноса этих ионов.
На Рис. 2 показаны теоретически ожидаемые и практически наблюдаемые значения рН катодной и анодной зон в зависимости от времени электролиза, находящееся в хорошем соответствии друг с другом. Таким образом, исследование завершено на уровне согласующихся с экспериментом числовых данных, полученных с помощью законов электрохимии.
Выводы
Экспериментально зарегистрированы изменения рН приэлектродных областей в процессе электролиза водного раствора сульфата калия, опытные данные находятся в хорошем соответствии с величинами, вычисленными на основе законов электрохимии.
Подщелачивание католита и подкисление анолита свидетельствуют о предпочтительности записи электродных реакций для нейтральных растворов в форме (1) и (2), т.е. с участием молекул Н2О, а не ионов ОНˉ или Н+. Действительно, сразу же после включения тока концентрации Н+ в католите и ОНˉ в анолите становятся исчезающее малыми (см. Рис. 2).
В операциях электрохимических технологий (электросинтез, меднение, никелирование) параллельное восстановление или окисление воды на электродах может стать причиной отклонения рН от нормы и привести к нарушению технологического режима.

