Гипохлорит натрия широко применяется для обеззараживания питьевой воды, промышленных и сточных вод, при обработке воды систем оборотного водоснабжения, воды плавательных бассейнов и пр. наиболее эффективным способом получения хлорсодержащих растворов является электрохимический [4, 8, 9].
На сегодняшний день достаточно широко применяют два способа электрохимического обеззараживания водных растворов: получение гипохлорита натрия электролизом с последующим введением его в обрабатываемую воду и непосредственный электролиз обрабатываемой воды. Получение гипохлорита натрия в электролизере производят в периодическом или непрерывном режимах.
При периодическом режиме работы исходный раствор соли заливают в непроточный электролизер, проводят электролиз до получения требуемой концентрации гипохлорита натрия, затем сливают в бак-накопитель и используют его оттуда по мере необходимости.
Проточный режим предусматривает непрерывный электролиз раствора хлорида натрия с одновременным дозированием гипохлорита в обрабатываемую воду [1–3].
Электролизный способ получения гипохлоритов имеет следующие преимущества: процесс обеззараживания обеспечивает использование безопасного реагента, а так же позволяет проводить обеззараживание всего объема сточной воды без создания зон с повышенной концентрацией окислителя благодаря его дозированной и парциальной подаче в раствор [7–11].
При реализации электрохимических способов окисления обеспечивается обеззараживание жидкости, в результате чего наблюдается необратимое агрегатирование микроорганизмов, что позволяет их отделить на фильтре для грубодисперсных примесей.
В последние годы наибольшее применение находят электролизные установки, позволяющие получить реагенты для обеззараживания воды непосредственно на месте потребления. Часто в качестве сырья используются хлоридные растворы естественного происхождения – подземные минерализованные воды и морская вода [11, 12].
Основными узлами установок являются: электролизер с титановыми электродами с ОРТА покрытием, источник питания, электролизная емкость [5, 6].
Получение гипохлорита натрия из разбавленных растворов хлорида натрия электрохимическим методом проводят с использованием электролизеров бездиафрагменного типа. Процесс электролиза протекает по суммарному уравнению
NaCl + H2O → NaClO + H2↑.
При пропускании электрического тока через раствор, содержащий хлорид-ионы, в электролизере протекают следующие процессы [13–16].
На аноде разряжаются ионы хлора по реакции:
2Cl- – 2e → Cl2↑.
Образующийся при этом молекулярный хлор растворяется в прианодном слое и подвергается гидролизу по реакции:
Cl2 + H2O → H+ + Cl- + HClO.
На катоде разряжаются молекулы воды с образованием водорода и гидроксид-ионов:
2H2O + 2e → H2↑+ 2OH–.
В объеме электролита происходит взаимодействие гидроксид-ионов со слабодиссоциированной хлорноватистой кислотой с образованием гипохлорит-иона:
HClO + OH– → ClO– + H2O.
Наряду с основными, как на электродах, так и в объеме электролита протекают побочные реакции, снижающие выход основного вещества по току.
На аноде разряжаются молекулы воды и ионы гипохлорита по реакциям:
2H2O – 4e → O2↑+4H+
6ClO– + 3H2O – 6e → 2ClO3– +4Cl– +6H+ + 3/2O2↑.
На катоде идет частичное восстановление ионов гипохлорита до хлорида по реакции:
2ClO– + H2O + 2e → 2Cl– + 2OH–.
В объеме электролита при повышенных температурах может протекать реакция химического образования хлората:
3ClO– → ClO3– + 2Cl–,
а в присутствии ионов некоторых тяжелых металлов (Co, Ni, Cu, Fe) каталитическое разложение гипохлорита:
2ClO– → O2 + 2Cl–.
Также необходимо отметить, что при электрохимическом получении растворов гипохлорита натрия из натрий-хлоридных рассолов концентрация в них ионов кальция обычно не превышает 0,15 г/л. Однако, даже при электролизе таких растворов в прикатодном слое электролита происходит выпадение трудно растворимых гидроксидов щелочноземельных металлов:
Ca 2+ + 2OH– → Ca(OH)2,
Mg 2+ + 2OH– → Mg(OH)2.
В присутствии бикарбоната выпадает трудно растворимая соль карбоната кальция:
Ca2+ + HCO3– + OH– → CaCO3 + H2O.
Основная часть нерастворимых соединений уносится электролитом из электролизера, но некоторое их количество осаждается на катоде, что приводит к постепенному росту напряжения на электролизере и расхода электроэнергии на получение 1-го кг активного хлора (ClO-).
Соли жесткости, как правило, периодически удаляют с катода, растворяя их соляной или уксусной кислотами, для чего электролиз прерывают на 40–60 минут. Периодичность остановки электролизера на промывку зависит от исходной концентрации солей жесткости и, как правило, составляет от 1-го до 4-х месяцев.
В работе представлены результаты исследования процесса электрохимического получения хлорсодержащих обеззараживающих растворов. С целью определения оптимальных параметров процесса электролиза натрий-хлоридных растворов проведены исследования по изучению влияния исходной концентрации NaCl в растворах, плотности тока на электродах, продолжительности электролиза, температуры на такие величины как: выход активного хлора по току, удельный расход электроэнергии на получение 1 кг активного хлора и обработку 1 м3 растворов.
Исследования проводились на электролизере бездиафрагменного типа. В работе использовались модельные растворы, содержащие ионы Cl– концентрацией: 400; 600 и 800 мг/дм3 и фоновые электролиты: Na2SO4 с концентрацией сульфат-ионов 2 г/дм3 и Na2CO3 с концентрацией карбонат-ионов 0,5 г/дм3.
Методика проведения эксперимента заключалась в следующем: модельный раствор заливался в электролизер, далее с помощью блока электропитания задавалась необходимая плотность тока на электродах и проводилась электролизная обработка раствора. По окончании процесса электролиза в полученном растворе определяли концентрацию «активного хлора», остаточную концентрацию ионов Cl–. Значения рН в исследуемых растворах контролировали на иономере и –160. Эффективность работы электролизной установки при заданных режимах работы определялась значениями выхода по току «активного хлора» (ВТ).
Полученные результаты исследований представлены на рис. 1 и 2.
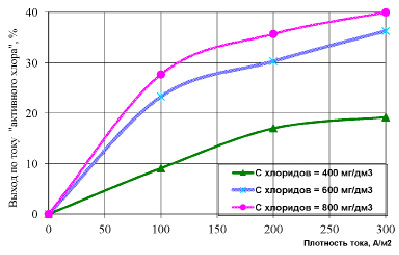
Рис. 1. Влияние исходной концентрации хлорид-ионов на выход по току «активного хлора»
Графические зависимости, отображенные на рис. 1, показали, что при равных параметрах работы электролизера выход по току «активного хлора» увеличивается при увеличении исходной концентрации хлорид-ионов в растворе. При этом отмечено, что увеличение исходной концентрации хлорид-ионов неоднозначно влияет на изменение выхода по току «активного хлора». Так, увеличение исходной концентрации ионов Cl– в растворе от 400 до 600 мг/дм3 увеличивает выход по току «активного хлора» на 18,3 % (Is = 300 А/м2), тогда как увеличение концентрации хлорид-ионов от 600 до 800 мг/дм3 приводит к значительно меньшему приросту выхода «активного хлора» в системе – 2,6 %.
Следовательно, увеличение исходной концентрации ионов Cl– в растворе свыше 600 мг/дм3 незначительно повлияет на выход по току «активного хлора».
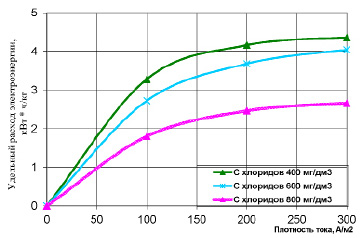
Рис. 2. Удельный расход электроэнергии на получение 1 кг «активного хлора» при разной исходной концентрации хлорид-ионов в системе
Графические зависимости, отображенные на рис. 2, показали, что при равных параметрах режимах работы электролизера, выход по току «активного хлора» увеличивается прямопропорционально увеличению исходной концентрации хлорид-ионов в растворе. При этом следует отметить, что увеличение исходной концентрации хлорид-ионов неоднозначно влияет на изменение выхода по току «активного хлора». Так, увеличение исходной концентрации ионов Cl– в растворе от 400 до 600 мг/дм3 увеличивает содержание «активного хлора» в процессе электролиза на 137,5 мг/дм3 (Is = 300 А/м2), тогда как дальнейшее увеличение концентрации хлорид-ионов (до 800 мг/дм3) приводит к значительно меньшему приросту концентрации «активного хлора» в системе – 62,1 мг/дм3. Следовательно, увеличение исходной концентрации ионов Cl– в растворе свыше 600 мг/дм3 несущественно повлияет на выход «активного хлора» по току.
Анализ зависимостей, представленных на рис. 2, показал, что увеличение концентрации хлорид-ионов в исходном растворе приводит к снижению удельного расхода электроэнергии на получение 1 кг «активного хлора», что связано со снижением электрического сопротивления раствора при возрастании солесодержания в системе.
Таким образом, на основании полученных экспериментальных данных, а так же исходя из экономической и экологической целесообразности, процесс электролиза хлоридсодержащих растворов, с целью получения «активного хлора», рекомендуется проводить при исходной концентрацией ионов Cl– в системе до 600 мг/дм3.
В работе было рассмотрено влияние фактора жесткости воды на выход целевого продукта. Полученные результаты представлены на рис. 3.
Графические зависимости, представленные на рис. 3, отображающие влияние карбонат-ионов на выход по току «активного хлора» в системе, показали, что присутствие ионов CO3 2– снижает выход «активного хлора» при электрооброаботке хлоридсодержащих растворов. Однако, процент снижения значительно меньше, чем в присутствии сульфат ионов. При этом следует отметить, что отрицательное влияние карбонат-ионов на выход «активного хлора» возрастает с увеличением плотности тока на электродах. Так, согласно полученным кривым, представленным на рис. 3, при плотности тока на электродах 100 А/м2 выход по току «активного хлора» снижается от 45 % до 38 %, а при Is 300 А/м2 от 67 % до 47 % (ССO32– = 1 г/дм3). Такая особенность влияния карбонат-ионов на выход целевого продукта электродной реакции – «активного хлора» может объясняться тем, что карбонаты и гидрокарбонаты могут окислять выделяющийся в процессе электролиза хлор, причем, как показали исследования, вероятность протекания процесса окисления возрастает с увеличением плотности тока, подаваемой на электроды.
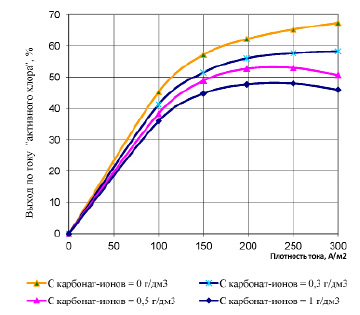
Рис. 3. Влияние карбонат-ионов на выход по току «активного хлора»
На основании полученных экспериментальных данных были установлены оптимальных параметров работы электролизной установки с целью получения «активного хлора» в реакционной системе для эффективного обеззараживания водных растворов: плотность тока на анодах 300 А/м2, время электрообработки – 1 минута, диапазон рН 4,5 – 7,5, минимальная концентрация ионов Cl– – 600 мг/дм3 .

