Исходя из физико-химических особенностей возможных способов извлечения марганца из водных систем, наиболее целесообразно для количественного извлечения ионов Mn2+ применять метод окислительного осаждения используя в качестве реагента-окислителя электролизные растворы активных форм хлора, образующиеся при электрообработке хлоридсодержащих водных систем [2, 9–13].
Эффективность процесса электролиза хлоридсодержащих растворов напрямую зависит от типа электрода, материала и условий работы электролизера. При получении хлора и его кислородных соединений путем электролиза растворов хлорида натрия наиболее значимым является выбор материала анодов, ввиду того, что процессы, протекающие на аноде, во многом определяют концентрацию и активность образующихся окислителей [5–8].
Проведенный анализ литературных источников показал, что для получения хлора и его кислородных соединений электрохимическим способом наибольшее распространение находят малоизнашивающиеся аноды на титановой основе [6, 8]. При этом, в качестве активных покрытий рекомендуют использовать: магнетит, сплавы на серебре, платиново-иридиевые, оксиды железа, свинца, марганца, кобальта и палладия. На сегодняшний день наибольшее распространение нашли окисно-рутениевые покрытия [3, 10]. В качестве материала катода, широко применяются, различные марки стали [5, 8].
В процессе электролиза хлоридсодержащих растворов на электродах возможно протекание следующих процессов [1, 15–18]:
на аноде выделяются:
– молекулярный кислород, в результате разложения гидроксид-ионов и молекул воды:
4ОН - – 4e → 2H2O + О2↑
4H2O – 4e → 4H+ + О2↑
– молекулярный хлор, при разряде хлорид-ионов, который затем в слабокислой и нейтральной среде гидролизуется, образуя хлорид-ионы и кислородсодержащие соединения хлора – «активный хлор»:
2Cl- – 2e → Cl2↑
Cl2 + H2O → H+ + Cl- + HClO
На катоде в основном происходит образование молекулярного водорода и гидроксид-ионов в результате разряжения молекул воды и восстановления катионов водорода:
2H2O + 2e → H2↑ + 2OH-
2H+ + 2e → H2↑
Наряду с основными реакциями, как на электродах, так и в объеме электролита возможно протекание и побочных реакций, снижающих выход основных веществ по току:
- на аноде разряжение молекул воды и ионов гипохлорита по реакциям:
2H2O - 4e → O2↑ +4H+
6ClO- + 3H2O – 6e → 2ClO3– +4Cl- +6H+ +3/2O2↑
- на катоде частичное восстановление ионов гипохлорита до хлорид-иона по реакции:
2ClO- + H2O + 2e → 2Cl- + 2OH-
В объеме электролита при повышенных температурах может протекать реакция химического образования хлората:
3ClO- → ClO3↑ + 2Cl-
Анализ работ Тумановой Т.А., Флиса И.Е., Якименко Л.М., Краснобородько И.Г., Яковлева С.В., Рогова В.М., и др., показал, что в процессе электролиза хлоридсодержащих растворов, образующиеся соединения «активного хлора» разлагаются в присутствии ионов Mn2+ на атомарный кислород и ионы Cl-. Образующийся атомарный кислород, далее участвует в процессе электрохимического осаждения ионов Mn2+ до Mn3+ , Mn 4+ , а ион Cl- остается в растворе [16–18].
В результате протекания электродных процессов в прианодном слое всегда наблюдается кислая среда, а в прикатодном – щелочная, поэтому, в межэлектродном пространстве от анода к катоду рН среды раствора изменяется от кислого к щелочному, не зависимо от рН исходного раствора. Следовательно, в межэлектродном пространстве всегда есть области с нейтральным рН. Существование нейтральных областей рН и постоянная ионизация воды (вследствие пропускания электрического тока) создают благоприятные условия для протекания процесса окислительной электрокоагуляции ионов Mn2+ из растворов в виде дисперсной фазы под действием образующихся кислородных соединений хлора. При этом ионы Н+ и ОН- выступают как катализаторы процесса [10, 14–16].
Следует так же учесть, что при электролизе растворов NaCl в результате образования ионов ОН- на катоде рН среды образующихся электролизных растворов слабощелочная (8,0 – 9,5), а при электролизе марганецсодержащих растворов в присутствии ионов Cl- среда растворов либо слабокислая (5,5–6,5), либо близка к нейтральной (6,5–7,5), в зависимости от исходной концентрации ионов Cl- и от условий проведения процесса электролиза. Этот факт можно объяснить тем, что ионы Mn2+ катализируют процесс восстановления «активного хлора», протекающий с образованием атомарного кислорода и ионов Cl-. В итоге, это приводит к постепенному подкислению электролизного раствора вследствие образования соляной кислоты и вовлечения ионов ОН- в окислительно-восстановительный процесс.
Следовательно, одновременное присутствие ионов Mn 2+ и Cl- в растворах подвергающихся электролизу позволяет замедлять процесс подщелачивания системы и проводить процесс окисления ионов Mn2+ до ионов Mn3+, Mn4+ при оптимальных значениях рН.
Также одним из факторов, влияющим на скорость протекания процесса окисления ионов марганца (II) из растворов, является многократное участие хлорид-ионов в цикле: сначала разряд на аноде и гидролиз с образованием «активного хлора», затем восстановление «активного хлора» с образованием атомарного кислорода и хлорид-иона, и далее вновь разряжение на аноде. В результате многократного участия хлорид-ионов в процессе электролитического образования «активного хлора» повышается общий выход «активного хлора» и существенно улучшается эффективность процесса окисления марганца (II), протекающего с образованием дисперсной фазы. При этом процесс электрохимического окисления марганца (II) «активным хлором» по сравнению с реагентным окислением позволяет многократно использовать ионы Cl- в той же реакционной смеси, поскольку атомарный кислород из-за своей термодинамической неустойчивости немедленно вступает в окислительный процесс, а хлорид-ион опять разряжается на аноде с образованием «активного хлора».
При электрообработке растворов, содержащих ионы Mn2+ и Cl-, наряду с окислительно-восстановительным процессом одновременно протекает и процесс коагуляции марганца. В работах Яковлева С.В., Краснобородько И.Г., Рогова В.М. и др. указывается, что электролизная обработка растворов способствует интенсификации процесса коагуляции [14, 17, 18]. При наложении электрического поля на систему ускоряется процесс формирования и осаждения коагулированной взвеси. В процессе электрообработки системы происходит значительное увеличение удельного содержания твердого вещества в единице объемы раствора. Во всех опытах с электрическим полем происходит более быстрое осветление воды, образование осадка и стабилизация его уровня по сравнению с реагентной коагуляцией. При этом эффект осветления воды при электрокоагуляции увеличивался на 25–35 % [4]. Доказано, что наибольший эффект коагуляции наблюдается при наложении электрического поля в течение всего процесса: коагулирование воды, осаждение взвеси, образования осадка и его уплотнения. Следовательно, воздействие электрического поля на объем коагулированного раствора позволит повысить эффективность и ускорить процесс извлечения Mn (II) в виде дисперсной фазы.
Таким образом, для эффективного извлечения Mn (II) методом электрохимического окисления требуется создать следующие условия: ввести в исходный раствор хлорид-ионы, содержание которых будет достаточно для получения необходимой концентрации «активного хлора» в системе; задать необходимую плотность тока на электродах и провести электрообработку системы при оптимальном временном интервале.
Так как процесс электрохимического окисления Mn (II) происходит под действием «активного хлора», следовательно, для установления оптимальных параметров работы электролизера необходимо проведение экспериментальных исследований по изучено влияние на выход «активного хлора» таких параметров как: исходная концентрация ионов Cl- в растворах; плотности тока на электродах и продолжительность электролиза.
Основной целью экспериментальных исследований являлось установление влияния различных характеристик хлорсодержащих растворов и основных параметров процесса электролиза на эффективность протекания процесса электролиза растворов NaCl, с целью получения «активного хлора», используемого для процесса электрохимического окисления ионов марганца.
В работе были проведены исследования по установлению влияния плотности тока на электродах и продолжительности электрообработки раствора на выход «активного хлора». В эксперименте использовали модельные растворы хлорида натрия с исходной концентрацией хлорид-ионов 600 мг/дм3. Электролиз модельных растворов проводили при плотностях тока: 100, 150, 200, 250 и 300 А/м2 в течение: 20, 30 с, 1 и 2 мин. По окончании процесса в каждом модельном растворе определяли концентрацию «активного хлора». Полученные экспериментальные данные представлены рис. 1 и 2.
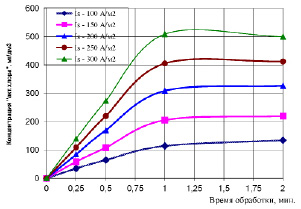
Рис. 1. Изменение концентрации «активного хлора» в зависимости от плотности тока и времени электрообработки системы
Анализ полученных зависимостей, представленных на рис. 1, показал, что концентрация «активного хлора» возрастает с увеличением плотности тока на электродах и времени электрохимической обработки раствора. При этом следует отметить, что характер изменения концентрации «активного хлора» во времени не является прямолинейным. Очевидно, что при электрообработке хлоридсодержащей системы в течение 1 минуты концентрация «активного хлора» практически достигает максимума (в зависимости от плотности тока на электродах), а при дальнейшем проведении электролиза системы она либо незначительно возрастает - Is = 100 – 200 А/м2, либо практически неизменна - Is = 250 А/м2, либо снижается - Is = 300 А/м2.
Таким образом, оптимальным временным интервалом проведения процесса электролиза с целью получения максимальной концентрации «активного хлора» в марганецсодержащей системе (при исходной концентрации ионов Cl- 600 мг/дм3) будет 1 минута и плотность тока на электродах - 300 А/м2.
Далее, для установления наиболее энергосберегающих, режимов работы электролизера, на рис. 2 рассмотрены зависимости между удельными энергозатаратами процесса и соответствующими режимами работы электролизера.
Зависимости, представленных на рис. 2 показали, что удельное энергопотребление на получение 1 кг «активного хлора» возрастает с увеличением плотности тока на электродах. При этом следует отметить, что увеличение времени электрообработки системы влияет неоднозначно на энергопотребление процесса. Так, на отрезке времени 0,25 – 1 минута, увеличение энергозатрат процесса во времени весьма незначительно: от 3,5 до 4,0 кВтч/кг. Дальнейшее увеличение времени протекания процесса электролиза существенно увеличивает энергозатраты процесса: от 3,5 до 7,54 кВт·ч/кг.
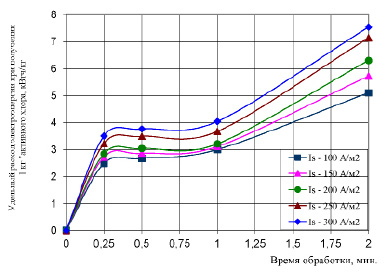
Рис. 2. Удельный расход электроэнергии на получение 1 кг «активного хлора» при разных режимах работы электролизера
Таким образом, анализ полученных результатов показал, что процесс электрообработки хлоридсодержащих растворов эффективно и экономически целесообразно проводить в течение 1 минуты. При этом, варьируя параметрами Is от 200 до 300 А/м2, можно получать необходимую концентрацию «активного хлора» в марганецсодержащей системе, достаточную для количественного осаждения заданного содержания ионов Mn2+ из раствора в виде дисперсной фазы.
Выводы
Проведенные исследования по определению оптимальных параметров работы электролизера с целью получения «активного хлора», достаточного для окислительного осаждения Mn (II) из растворов в виде осадка показали:
- при осуществлении процесса электрохимического окисления Mn (II) «активным хлором» более целесообразно варьировать значениями плотности тока подаваемого на электроды, нежели значениями исходных концентраций хлорид-ионов в марганецсодержащей системе и продолжительностью процесса электролиза;
- оптимальной исходной концентрацией хлорид-ионов в марганецсодержащей системе подвергаемой электрообработке, следует считать 600 мг/дм3. Уменьшение исходного содержания ионов Сl- приведет к значительному снижению выхода «активного хлора» в электролизной системе, а также существенно увеличит энергозатраты процесса;
- процесс электрохимического окисления ионов марганца (II) «активным хлором» более эффективно и экономически оправданно проводить при продолжительности электрообработки раствора в течение 1 минуты и плотности тока на электродах 200–300 А/м2 (в зависимости от исходного содержания марганца (II) в системе).

