Актуальность. В настоящее время проблема исследования микроциркуляции занимает одно из ведущих мест в медицинской практике. Актуальность этой проблемы определяется реакцией микроциркуляторного русла на воздействие факторов внешней и внутренней среды, обеспечивая приспособление местной гемодинамики в соответствии с потребностями организма.В патогенезе многих заболеваний важную роль играет изменение состояния микроциркуляции крови, от которой непосредственно зависит поддержание жизнеспособности органов и тканей, дальнейшее течение воспалительныхпроцессов. Изменения микроциркуляции возникают раньше и исчезают позже клинических проявлений повреждения тканей, и в этом отношении позволяют адекватно отражать состояние их жизнеспособности. При многих заболеваниях изменения микроциркуляции составляют важное звено патогенеза. Поэтому в клинике различных заболеваний и экстремальных состояний, а также при коррекции микроциркуляторных нарушений необходима как оперативная информация о состоянии кровотока на тканевом уровне, так и длительный мониторинг за состоянием микроциркуляции [3,5].
Артериальное кровоснабжение желудка осуществляется за счет ветвей чревного ствола (truncus coeliacus), который, начинаясь от брюшной аорты на уровне XII грудного позвонка коротким стволом в 1–1,5 см, сейчас же распадается на три основные свои ветви – левую желудочную артерию (a.gastrica sinistra), селезеночную артерию (a.lienalis) и общую печеночную артерию (a.hepatica communis), принимающие участие в кровоснабжении желудка. Непосредственное участие в кровоснабжении желудка принимают 5 сосудов: левая и правая желудочные артерии, левая и правая желудочно-сальниковые артерии и короткие желудочные артерии. Наиболее мощной и важной в практическом отношении является левая желудочная артерия (a.gastrica sinistra), отходящая в 75 % случаев от чревного ствола в остальных – от общей печеночной или селезеночной артерий. Различают восходящую, или проксимальную, часть и нисходящую, или дистальную, часть a.gastrica sinistra. Восходящая часть артерии идет в желудочно-поджелудочной связке и подходит к малой кривизне желудка на границе верхней и средней третей ее длины, где располагается между листками печеночно-желудочной связки уже как нисходящая (или дистальная) часть артерии. В этой связке она идет слева направо вдоль малой кривизны, отдавая передние и задние ветви соответственно стенкам желудка.
Правая желудочная артерия (a.gastrica dextra) является ветвью чаще всего собственной печеночной артерии (a.hepatica propria) из системы общей печеночной артерии. Реже она отходит от общей печеночной артерии (a.hepatica communis) или одной из ее основных ветвей – желудочно-двенадцатиперстной артерии (a.gastroduodenalis). Правая желудочная артерия идет справа налево по малой кривизне желудка между листками печеночно-двенадцатиперстной связки (lig.hepatoduodenale), отдавая ветви к желудку и анастомозируя с a.gastrica sinistra. Таким образом, на малой кривизне образуется мощная анастомотическая артериальная дуга, формированная правой и левой желудочными артериями. Из этих двух артерий малой кривизны желудков правая обычно выражена значительно слабее и имеет меньшее значение для кровоснабжения желудка, чем левая желудочная артерия. Ведущим звеном в развитии микроциркуляторных нарушений является расстройство капиллярного кровотока, начинающееся со снижения его интенсивности, а заканчивающееся развитием капиллярного стаза. Очевидно, что объективная регистрация состояния именно капиллярного кровотока важна как для оценки системных и локальных расстройств микроциркуляции, так и для прогноза течення тех или иных патологических состояний [1,4,6].
Цель исследования. Изучить изменения гемомикроциркуляторного русла желудка после гастротомии.
Материалы и методы исследования
Для выполнения поставленных задач нами были проведены экспериментальные исследования. Они проводились на беспородных крысах массой 160–250г. обоего пола. Животные до и после операции содержались в условиях вивария.
Материалом исследования являлись ткани желудка крыс. Все животные до операции наблюдались в карантине, где изучались контрольные данные гемодинамики. Сроки наблюдения за экспериментальными животными составили от 3 часа до 7 суток.
После лапаротомии на передней стенке кардиального отдела желудка проводили гастротомию. Рану желудка ушивали двухрядным швом. Затем ушивалась операционная рана.
Микротомные срезы желудка толщиной 5–7 мкм окрашивали гематоксилином и эозином, по ван-Гизону.Сосудистая сеть желудка наполнялась 0,5 % раствором азотнокислого серебра, после промывание теплым (37°С) физиологическим раствором, под строгим контролем манометра. При морфометрии применяли стандартную методику определения диаметра сосудов с помощью окулярометра и объектмикрометра.
Результаты исследования и их обсуждение
Гастротомия влечет за собой перестройку сосудистых конструкций[2]. Через 6 часов после операции диаметр коротких артерий дна желудка до их погружения увеличивается почти на 12 %, а одноименных вен на 9 %. Отмечалось характерное нарастание количества артериальных и венозных анастомозов в области шва желудка. На месте анастомоза наблюдается хорошо развитая сеть тончайших капилляров.
При изучении интраорганных сосудов вблизи шва желудка получены следующие данные. Через 6 часов после операции по обе стороны от шва в стенке желудка начинает развиваться отек и клеточная инфильтрация. Между соединенными швами стенками желудка сосудистых связей нет. Края их разобщены бессосудистой фибринной спайкой, образовавшейся по линии швов. Внутриорганные сосуды вблизи спайки расширены, переполнены форменными элементами крови. На границе со спайкой некоторые сосуды образовали булавовидное утолщение (рис. 1).
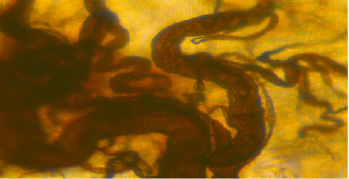
Рис. 1. Через 6 часов после гастротомии. Булавовидное утолщение сосудов на границе со спайкой. Ув.100. Наливка 0,5 % раствором азотнокислого серебра
К концу 1-х суток развивается лейкоцитарная инфильтрация, степень выраженности которой непосредственно зависит от уровня деструктивных изменений в микроциркуляторном русле. Степень выраженности микроциркуляторных изменений наибольшая в подслизистой основе стенки желудка и серозной оболочке, менее выраженная – в слизистой оболочке и наименьшая – в мышечной оболочке.
При рассмотрении срезов, докрашенных гематоксилином и эозином, во многих местах по обе стороны от спайки обнаруживаются сосуды, в которые краситель во время инъекции либо совсем не проник, либо заполнил сосуд только частично. Эти сосуды видны в пределах тканей, захваченных швами. Это связано с тем, что часть сосудов сдавливается швами, в результате чего образуются ишемические участки.
В течение трех-шести дней после операции явления воспаления нарастают. Увеличиваются воспалительный отек и инфильтрация. Участки слизистой оболочки в пределах внутренних швов некротизировались, во многих местах некроз распространяется на другие слои. Воспалительная инфильтрация наиболее выражена на границе с омертвевшими тканями (рис. 2).
В эти сроки по обе стороны от спайки обнаруживаются тромбированные сосуды. Свежие тромбы видны не только в мелких сосудах и капиллярах, но и в крупных сосудах подслизистого слоя в очагах интенсивной инфильтрации. В ряде случаев тромбы в сосудах можно обнаружить на расстоянии приблизительно 0,5–1 см от спайки, в этих же местах определяется воспалительная инфильтрация и отек тканей.
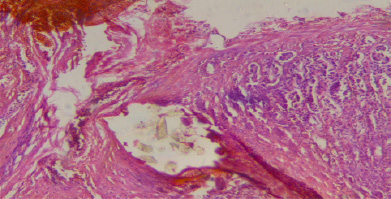
Рис. 2. Через 3 суток после операции. Полнокровие и клеточная инфильтрация вокруг шовного материала. Ув.х 200. Окраска: гематоксилин и эозин
В результате тромбирования части интраорганных сосудов по обе стороны от спайки сосудистые сети в различных слоях желудка изменяют свой характерный рисунок. Особенно это заметно в капиллярной сети мышечных слоев, петли которых в ряде случаев разомкнуты, теряют свою форму.
Изменения рисунка интраорганных сосудистых сетей еще больше происходит к концу первой недели связи с тем, что в эти сроки начинается процесс новообразования капилляров. Этот процесс находится в тесной связи с нарушением кровообращения в оперированном органе и с восстановлением новых сосудистых связей в области соустья в результате прорастания фибринной спайки новообразованными капиллярами.
На основании полученных результатов установили, что в ближайшие три часа после шести минутной острой внепеченочной портальной гипертензии наблюдаются значительные изменения в ГМЦР желудка. Диаметр артериол серозной оболочки составил 28,5±2,4 мкм, что на 3,7 % больше контрольных цифр. Диаметр прекапилляров расширен до 19,6±1,7 мкм (р<0,05), что превышает контрольные показатели на 30,7 %. Капилляры расширены на 52,3 % (9,9±0,6). Посткапилляры полнокровны, извитые, расширены до 27±2,1 мкм (р<0,05), что на 58,8 % больше контрольных показателей. Венулы расширены до 38,4±2,8 мкм (р<0,05), что на 32,4 % выше исходных данных. В мышечном слое диаметр артериол составил 38,4±3,0 мкм, что на 12,9 % больше, чем контрольные показатели. Диаметр прекапилляр составил 19±1,8мкм, что на 26,7 % больше по сравнению с контролем. Капилляры расширены на 27,8 % (6,9±0,9). Посткапилляры достоверно расширены до 24±2,2 мкм (р<0,05), что на 33,3 % больше контрольных величин. Диаметр венулы достигл до 59±3,8 мкм (р<0,05) , что на 47,5 % больше исходных цифр.
При изучении серозной оболочки через шесть часов после острой внепеченочной портальной гипертензии наблюдается равномерное расширение артериол на 14,8 % (31±2,4 мкм). Следовало ожидать, что с чрезмерным переполнением венулярного отдела сосудистого русла артериолы будут суженными. Однако они имеют тенденцию к расширению. Остальные микрососуды серозной оболочки резко расширены и полнокровны. Диаметр прекапилляров расширен до 21±1,8 мкм (р<0,05), капилляров до 9,1±0,6 (р<0,05), посткапилляров до 27±2,3 (р<0,05), венул до 34±2,7 мкм (р<0,05). В мышечном слое наблюдается расширение артериол на 14,7 % (39±3,2 мкм). Диаметр прекапилляров составил 19±1,6 мкм, что на 26,7 % больше контрольных показателей. Капилляры достоверно расширены на 55,6 % (8,4±0,7 мкм). Диаметры посткапилляров достигли 27±1,8 мкм (р<0,05), что на 50 % больше контрольных показателей. Венулы расширились до 59±3,4мкм (р<0,05), что на 47,5 % больше исходных данных. Заметно увеличивается количество артериоло-венулярных коллатералей. Процесс преобразования внутриорганных сосудов захватывает все слои желудка. Наблюдается полнокровие венул подслизистого слоя с кровоизлияниями.
Через двенадцать часов после 6 минутной острой внепеченочной портальной гипертензии продолжают наблюдаться выраженные изменения в микрососудах желудка. При измерении диаметра артериол серозной оболочки наблюдалось расширение их просвета до 32±2,6 мкм (р<0,05), что на 18,5 % больше контрольных данных. Значительные изменения в других микрососудах серозной оболочки сохраняются. Прекапилляры расширены на 33,3 % (20±1,8), капилляры на 38,5 % (9±0,6), посткапилляры на 41,2 % (24±2,1), венулы на 24,1 % (36±2,4) выше контрольных величин. Диаметр артериол мышечного слоя составил 39±3,0 мкм, что превышает контрольные показатели на 14,7 %. Прекапилляры расширены на 32 % (19,8±2,4 мкм). Диаметр капилляров составил 7±0,9 мкм, что больше контрольных цифр на 29,2 %. Посткапилляры расширены до 27±1,1 мкм (р<0,05), что на 50 % больше по сравнению с контрольными показателями. Венулы достоверно расширены на 42,5 % (57±3,2 мкм).
Через одни сутки после 6 минутной острой внепеченочной портальной гипертензии наблюдается резкое увеличение диаметра артериол серозной оболочки. Диаметр артериол составил 35±2,8 мкм (р<0,05), что превышает контрольные цифры на 29,6 %. Прекапилляры расширены на 33,3 % (20±1,4 мкм). Диаметр капилляров составляет в среднем 9±0,8 мкм, что больше контроля на 38,5 %. Посткапилляры расширены на 35,3 % (23±2,0 мкм). Венулы расширены до 35±2,8 мкм (р<0,05), что на 20,7 % выше контрольных показателей. В мышечном слое артериолы расширены на 8,8 % (37±2,4 мкм). Резкое расширение и полнокровие сохраняется в остальных микрососудах мышечного слоя. Диаметр прекапилляров составил 18±1,7 мкм, капилляров – 6,2±0,7 мкм (р<0,05), посткапилляров – 25±1,8 мкм (р<0,05), венул – 56±3,4 мкм. Процесс преобразования внутриорганных сосудов захватывает все слои желудка. Наблюдаются кровоизлияния между мышечной оболочкой и подслизистой основой.
Через трое суток после 6 минутной компрессии воротной вены диаметры звеньев гемомикроциркуляторного русла(ГМЦР) желудка по сравнению с предыдущим сроком уменьшаются. Диаметр артериол серозной оболочки составил 30±2,4 мкм, что больше по сравнению с контролем на 11,1 % прекапилляров – 18±1,6 мкм, капилляров- 7,2±0,4 мкм, посткапилляров – 20±1,5 мкм (р<0,05), венул – 32±2,4 мкм. Диаметры артериол мышечного слоя составили 36±3,0 мкм, прекапилляров – 17±1,7 мкм, капилляров – 5,8±0,9 мкм, посткапилляров – 21±1,6 мкм, венул – 44±3,1 мкм.
Через семь суток после 6 минутного пережатия воротной вены наблюдается дальнейшее уменьшение диаметра микрососудов и приближение их к контрольным цифрам. Диаметр артериол серозной оболочки составил 27±1,8 мкм, что одинаково с контрольными данными. Прекапилляры расширены на 6,7 % (16±1,4), посткапилляры – на 7,7 % (7,0±0,5), капилляры – на 11,8 % (19±1,7), венулы – на 3,4 % (30±2,8). Артериолы мышечного слоя расширены на 2,9 % (35±3,0), прекапилляры – на 6,7 % (16±1,4), капилляры – на 3,7 % (5,6±0,8). Диаметр посткапилляров составил 18±1,6 мкм, что совпадает с контрольным показателем. Диаметры венул расширились на 5 % (42±2,8) от контрольных величин. В слизистом слое полнокровие капилляров сохраняется.
К концу первой недели после операции происходит обратное развитие воспалительного процесса. Уже к концу первой недели уменьшается отек тканей, края слизистых оболочек очищаются от некротических тканей, уменьшается воспалительная инфильтрация, дно дефекта слизистых оболочек выстилается однослойным цилиндрическим эпителием.
В эти сроки фибринная спайка замещается грануляционной тканью с образованием густой капиллярной сети. Большое количество беспорядочно вросших новообразованных капилляров видно также по обе стороны от спайки.
Установление большого числа связей между новообразованными капиллярами в стенке органа и капиллярами спайки еще в большей степени меняет рисунок интраорганных сосудистых сетей по обе стороны от спайки.
Новообразованные сосуды отличаются не только строением стенки, но и направлением, что особенно отчетливо заметно на уровне мышечного слоя, где интраорганные сосуды имеют определенную ориентацию, а новообразованные сосуды располагаются в самых различных направлениях.
Выводы. Таким образом, экспериментальные исследования показали, что выраженность лейкоцитарной инфильтрации в области шва желудка после гастротомии зависит от степени изменений в микроциркуляторном русле.

