Дегенерацию разных органов, в том числе мезонефросов, нынче модно рассматривать с позиций генетически детерминированного апоптоза [14]. Значение апоптоза в раннем развитии человека пока можно определить лишь в общих чертах. и все же следует считать, что тонкая система равновесия между дифференциацией и апоптозом (развитием и управляемой гибелью клеток) – ключевой механизм развития. Но сведения о пролиферации и апоптозе клеток почки, механизме редукции мезонефроса отсутствуют в доступной литературе [1]. Е.Ю. Шаповалова с соавторами [11] убеждены, что в «основе пренатального онтогенеза человека лежит эмбриональный гистогенез». и соответственно рассматривают проблему апоптоза и пролиферации, их роль в процессе дегенерации первичных почек в эмбриогенезе человека. Однако тело человека и других млекопитающих (и не только) животных состоит из органов, а уже они – из тканей. Поэтому гистогенез, я считаю, лежит в основе органогенеза и без учета взаимодействий органов между собой и с сосудами невозможно понять механику онтогенеза. Е.Ю. Шаповалова с соавторами [13] думают, что возможно «именно высокая экспрессия антиапоптотического гена Bcl-2 обеспечивает дифференцировку клеток и препятствует их гибели». Е.Ю. Шаповалова с соавторами [11] признают, что «вопрос о механизме инволюции мезонефроса окончательно не решен. По нашим данным, в клетках редуцирующих мезонефронов и окружающей их эмбриональной соединительной ткани индекс пролиферации и антиапоптотический индекс низки. Отсутствие экспрессии гена Bcl-2 позволяет таким клеткам запустить генетическую программу клеточной гибели [12]. Индекс апоптоза высок и с возрастом незначительно увеличивается. Вместе с тем индекс готовности к апоптозу мал. Обновление такой клеточной популяции слабое, что приводит к дегенерации мезонефронов и, в конечном счете, всей первичной почки». Но остается вопрос: чем вызваны такие изменения в функциональном, а затем и морфологическом состоянии органов? Что конкретно приводит к апоптозу?
Я описывал развитие почек в эмбриогенезе человека и млекопитающих животных ранее, главным образом в связи с развитием вен и лифатической системы [2–10], но при этом в той или иной мере рассматривал их взаимоотношения с аортой и ее ветвями. Именно данный аспект дегенерации мезонефросов является главной темой предлагаемой статьи.
Цель исследования: изучить анатомотопографические взаимоотношения почек, мезонефросов и их сосудов в эмбриогенезе для объяснения механики дегенерации мезонефросов.
Материалы и методы исследования
Развитие почек и окружающих органов и сосудов изучено на 52 трупах эмбрионов и плодов человека 5–72 мм теменно-копчиковой длины (4–12 нед.), а также на 30 трупах зародышей 13–21 сут. и новорожденных белой крысы, 10 эмбрионов свиньи и 10 эмбрионов овцы 8–26 мм теменно-копчиковой длины (4-я – 5-я нед). После фиксации в 10 % растворе нейтрального формалина или в жидкости Буэна материал заливали в парафин, изготавливали серийные срезы толщиной 5–7 мкм в трех основных плоскостях. Срезы окрашивали гематоксилином и эозином, пикрофуксином по Ван Гизон и Вергеффу, по Маллори, азур-II-эозином, альциановым синим (рН = 2,0–3,0) в комбинации с ШИК-реакцией, толуидиновым синим (рН = 1,0–5,0), импрегнировали солями серебра по Карупу и Футу.
Результаты исследования и их обсуждение
Вначале кратко опишу начальные этапы развития окончательной или вторичной почки в эмбриогенезе человека. у эмбриона 5 мм длины (4 нед.) появляется дорсальный вырост на протоке каждого из двух мезонефросов, причем каудальнее бифуркации нисходящей аорты и ее конечных ветвей, двух пупочных артерий, а также каудальных концов мезонефросов, поворачивающих вместе с хвостом эмбриона в вентромедиальном направлении. Так на уровне примерно IV поясничного сомита образуется парная закладка тазовой почки. Она заметно расширяется – это почечная лоханка, которая у эмбрионов 5–6-й нед ветвится с образованием почечных чашек. Их окружает плотное скопление мезодермальных клеток, метанефрогенная бластема. По мере роста эти быстро увеличивающиеся закладки тазовых почек сближаются своими краниальными концами около бифуркации аорты, а затем в конце 6-й нед. «восходят» краниальнее ее уровня и оказываются в брюшной полости, между, но дорсальнее мезонефросов, т.е. растут через зоны прохождения артерий мезонефросов.
Проанализируем в заданном аспекте данные, представленные мною в статьях [2–10].
В статье «Развитие восходящей поясничной и непарной вен в эмбриогенезе человека» [2] мной отмечается, что у «зародышей 8–12 мм ТКД почки «восходят» над уровнем пупочных артерий, впереди аорты. Под бифуркацией последней возникает сакрокардинальный анастомоз… Почка растет дорсолатеральнее каудального продолжения надпочечника … мезонефрос и гонада находятся впереди почки». Причем правые почка и надпочечник сближаются раньше (у зародышей 13–14 мм длины), чем левые (у зародышей 14,5–15 мм длины). На представленных рис. 3 и 4 (поперечный и сагиттальный срезы эмбрионов 14,5 и 14 мм длины) видно, что почки «восходят» между брюшной аортой, нисходящей дорсомедиально, и мезонефросами, расположенными вентролатерально, причем их артерии проходят на пути «восхождения» тазовых почек.
В моей статье «Закладка начального отдела грудного протока человека в эмбриогенезе человека» [3] отмечается, что у « зародышей 13–14 мм длины… Дегенерирует грудная часть мезонефроса… Интенсивный рост легких и дегенерация мезонефроса обусловливают постепенное снижение границы грудной аорты до XII грудного позвонка к началу 8-й недели… Расположенные в окружении синуса ветви аорты и симпатических стволов инвагируют в его просвет и расчленяют периферическую часть... у предплодов 17–25 мм длины (6,5–7,5 нед.)… Канализация ЗЛМ сочетается с дегенерацией брюшной части мезонефроса, артерии которого проходят в истончающихся перегородках мешка». На рис. 1 этой статьи (сагиттальный срез эмбриона 14 мм длины) ясно видна артерия мезонефроса, проходящая между субкардиальным синусом, краниально, через инвагинацию в его периферической части, и почкой, каудально, в почечное тельце мезонефроса.
В статье «Начальные этапы формирования корней грудного протока» [4] я описал, как артерии мезонефроса разделяют периферическую часть субкардинального синуса на лимфатические «щели»: «У эмбрионов длиной 13–15 мм… Верхний интерсубкардинальный анастомоз… расширяется в субкардинальный синус… На пути роста субкардинального синуса находятся артерии мезонефроса и ветви симпатических стволов, что обусловливает деформацию синуса. …суженные участки ограничены артериями и нервными пучками с постепенным разделением на «щели». у предплодов 16–18 мм длины (6.5 нед)… В перегородках между «щелями» забрюшинного лимфатического мешка проходят артерии мезонефроса. Рост надпочечников и почек, дорсолатеральное смещение мезонефроса приводят к значительному удлинению, искривлению этих артерий с истончением их стенки».
В статье «Морфогенез корней нижней полой вены в эмбриогенезе человека» [5] описаны преобразования системы кардинальных вен в систему корней и саму нижнюю полую вену в связи с «восхождением» тазовых почек у эмбрионов 4–8 нед, влияние почек на пупочные и каудальную артерии. В статье «Особенности морфогенеза начального отдела грудного протока в пренатальном онтогенезе крысы» [6] отмечены видовые особенности развития: у эмбрионов белой крысы на сопоставимых с эмбрионами человека стадиях развития обнаружены замедление дегенерации мезонефросов и гонад, сближения почек и надпочечников, особенно слева, огромная печень, особенно ее дорсальная часть (область хвостатой доли), и небольшие надпочечники, небольшой забрюшинный лимфатический мешок и вертикальная цистерна грудного протока (у человека – поперечная), которые формируются позднее, чем у человека. Ствол задней полой вены у эмбрионов крысы 15–15,5 сут. имеет дугообразную форму (у эмбрионов человека 6,5 нед. – штопорообразную).
В статье «Морфогенез нижней полой вены в эмбриогенезе» [7] весьма информативны иллюстрации. На рис. 2 (сагиттальный срез эмбриона 8,5 мм длины) видно, что закладка надпочечника (инрерреналовое тело – № 3) размещается на пути сосудов мезонефроса, в дальнейшем растет каудально, туда, где сейчас размещаются мезонефроны. На рис. 4 (сагиттальный срез эмбриона 14 мм длины) показано, что через инвагинацию в полости субкардинального синуса (№ 4) проходит артерия мезонефроса в направлении мезонефрона.
В статье «Морфогенез задней полой вены в эмбриогенезе млекопитающих животных» [9] на рисунках 1,2 и 4 показано, что тазовая почка «восходит» в брюшной полости между мезонефросом и брюшной аортой, т.е. в зоне прохождения артерий мезонефроса. С увеличением возраста зародышей, по мере краниального подъема метанефроса брюшная часть мезонефроса дегенерирует в краниокаудальном направлении.
В статье «Происхождение лимфатического эндотелия. I. Эмбриогенез человека» [8] я выделю следующее: «В результате образуется и постепенно расширяется крупная полость забрюшинного лимфатического мешка. Он… имеет очень тонкие эндотелиальные стенки. Дольше сохраняются те более толстые межщелевые перегородки, покрытые тонким эндотелием, в которых сохраняются артерии мезонефроса. На данном уровне первичные почки дегенерируют, с ними – и большинство их артерий, кроме тех, которые преобразуются в артерии дефинитивных органов, например почек…». На рис. 1 (эмбрион 14 мм длины, начало 7-й нед), сагиттальные срезы (А-В): стрелками показаны ветви артерий мезонефроса, которые идут в инвагинации в полости субкардинального синуса, направляясь в мезонефрон. Видна эндотелиальная выстилка стенок синуса и инвагинаций его дорсальной стенки.
В статье «Происхождение лимфатического эндотелия. II. Эмбриогенез млекопитающих животных» [10] обращаю внимание на следующее: «У эмбрионов свиньи и овцы 13–14 мм ТКД (4–я нед) краниальный интерсубкардинальный анастомоз резко расширяется между почками и надпочечниками, становится субкардинальным венозным синусом. Тонкие эндотелиальные стенки синуса при этом сильно деформируются: местами их участки вместе с артериями мезонефроса, которые обладают гораздо более толстыми стенками и адвентициальной оболочкой, и с межсосудистой соединительной тканью инвагинируют в просвет синуса… у эмбрионов 5-й нед. межщелевые перегородки истончаются и разрываются. В результате образуется и расширяется крупная полость забрюшинного лимфатического мешка… Мешок имеет тонкие эндотелиальные стенки. Дольше сохраняются те более толстые межщелевые перегородки, покрытые тонким эндотелием, в которых сохраняются артерии мезонефроса. Первичные почки на данном уровне дегенерируют, а с ними – и большинство их артерий, кроме тех, которые преобразуются в артерии дефинитивных органов, например почек, или их закладок, например, артерии тел Цукеркандля … у эмбрионов свиньи. Дегенерация ее громадных мезонефросов и канализация (путем слияния лимфатических щелей) закладки забрюшинного лимфатического мешка протекают медленнее, чем у человека. у овечьих эмбрионов определяется промежуточное состояние». На рис. 2 (А, Б) показана крупная, ветвящаяся инвагинация артерии мезонефроса с окружающей соединительной тканью в полости забрюшинного лимфатического мешка, где видны истончающиеся и прерывающиеся перегородки, причем данный фрагмент мешка находится вентральнее почки. Она, как это отмечалось ранее, «восходит» через зоны прохождения артерий мезонефроса.
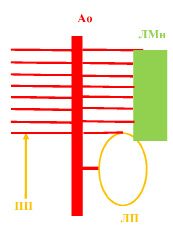
Рис. 1. Взаимоотношения тазовых почек и артерий мезонефроса, ветвей нисходящей аорты, при «восхождении» тазовых почек: Ао – аорта и ее ветви; ЛМн – левый мезонефрос; ПП, ЛП – правая и левая (тазовые) почки
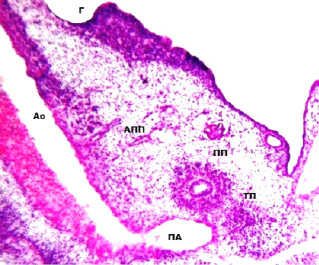
Рис. 2. Эмбрион человека 12 мм длины (6 недель): Ао – брюшная аорта; ПА – пупочная артерия; ТП – тазовая почка; ПП – первичная почка; АПП – артерии первичной почки; Г – гонада. Гематоксилин и эозин. Ув. 120
Заключение
Представленные мною материалы свидетельствуют, что дегенерация мезонефросов в эмбриогенезе человека и млекопитающих животных, пусть и с разными темпами, происходит по мере «восхождения» тазовых почек в брюшной полости и роста таких дефинитивных органов, как легкие и надпочечники. Особенно демонстративно влияние тазовых почек на интересующий нас процесс: почки растут между брюшной аортой и мезонефросами, оказывая давление на артерии мезонефроса (рис. 1, 2). Артерии, кстати, проходят в составе инвагинаций в полости субкардинального венозного синуса, а затем в межщелевых перегородках забрюшинного лимфатического мешка. Деформация этих артерий путем сдавления и растяжения под воздействием интенсивно растущих органов приводит, очевидно, к нарушению кровоснабжения и дегенерации мезонефросов, истончению и разрыву межщелевых перегородок, канализации полости забрюшинного лимфатического мешка. Кстати, параллельно сходное влияние испытывают вены, дренирующие мезонефросы. Конечно, приведенные разными авторами [1,11,12] данные (индексы пролиферации, апоптоза, готовности к апоптозу, их возрастные изменения) интересны. Эти данные свидетельствуют о разном функциональном и морфологическом состоянии изученных органов, но не объясняют причины их изменений. Что касается генетической запрограммированности дегенерации первичных почек (и других органов), то геном в конечном счете содержит информацию о первичной структуре белков и порядке ее реализации. Белки участвуют в формировании клеток всех органов индивида, причем в совершенно ином состоянии (вторичная, третичная или четвертичная структуры), в связи с другими веществами. Изменения морфологического и функционального состояний белков и их соединений, а затем клеток и их соединений, тканей и органов зависят от состояния их окружения и окружения индивида в целом. В нашем случае, важным эпигенетическим фактором становится взаимодействие органов и их сосудов в процессе неравномерного интенсивного роста формирующихся органов. Иначе говоря, гибель и пролиферация клеток могут служить механизмами развития, но не его причинами, и сами имеют свои причины.

