С целью очистки теплообменных аппаратов разрабатываются различные по составу промывочные растворы на основе различных кислот в сочетании с ингибиторами различного состава. Однако, в настоящее время возникают проблемы с утилизацией промывных отходов после промывки систем теплоснабжения [1–4].
В настоящее время вопрос утилизации промывных вод стоит очень остро. Изыскиваются возможности переработки сливных промывных вод для получения востребованных побочных продуктов.
Использование промывных растворов для переработки на востребованную продукцию дает возможность значительно снизить затраты на утилизацию и связанные с этим экологические проблемы – чистота атмосферы, почвы, экономические показатели и др.
При проведении профилактических работ, связанных с консервацией систем теплоснабжения и их очисткой на малых объектах, а тем более в жилых помещениях, использование минеральных кислот связано с большими неудобствами и некоторыми другими проблемами [5]. При использовании минеральных кислот для целей очистки возникают вопросы регенерации и утилизации отработанных промывочных растворов, что сопряжено с большой дороговизной и сложностью реализации процесса утилизации.
Целью исследований является получение данных о влиянии состава промывных растворов на основе минеральных кислот на процесс коррозии стального оборудования в системах теплоснабжения во время промывки систем. Для этого нами были исследованы растворы кислот различной концентрации. В качестве объектов стальные трубки, используемые в системах теплоснабжения. Химический контроль железа, переходящего с внутренней поверхности стальной трубки в промывные растворы, осуществлялся на циркуляционной установке, состоящей из емкости 20 литров, водяного насоса, качающего раствор через стальную трубку по виниловым шлангам. По изменению массы стальной трубки в процессе промывки рассчитывались скорости коррозии.
Данные исследований приведены в таблице.
Изменения массы образца в растворах кислот различной концентрации
|
№ п.п. |
Кислоты |
Концентрация кислот |
Объем кислот, V,мл |
Масса образца до опыта, г |
Масса образца после опыта, г |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
1 |
Сульфаминовая |
0.1 М |
20 |
26,4188 |
26,4320 |
|
2 |
Сульфаминовая |
1 М |
20 |
45,7188 |
45,7543 |
|
3 |
Сульфаминовая |
2 М |
20 |
28, 9167 |
28,9385 |
|
4 |
Щавелевая |
0.1 М |
20 |
28,4807 |
28,5028 |
|
5 |
Щавелевая |
1 М |
20 |
25,4268 |
25,4258 |
|
6 |
Щавелевая |
2 М |
20 |
24,6388 |
24,6441 |
|
7 |
Лимонная |
0.1 М |
20 |
20,4997 |
20,5088 |
|
8 |
Лимонная |
1 М |
20 |
78,5528 |
78,1810 |
|
9 |
Лимонная |
2 М |
20 |
22,6478 |
22,5684 |
Для каждого раствора кислоты проводили расчеты скорости коррозии по изменению массы образца.
Для сульфаминовой кислоты скорость коррозии в пределах 0,0044–0,0097г/м2•ч;
Для щавелевой кислоты скорость коррозии в пределах 0,020–0,039 г/м2•ч;
Для лимонной кислоты скорость коррозии в пределах 0,589–0,572 г/м2•ч;
Как видно из расчетов и рис.1 наименьшая скорость коррозии стального образца наблюдается в растворе сульфаминовой кислоты, скорость коррозии в растворе лимонной кислоты на два порядка выше.
Невысокая скорость коррозии стального образца в растворе сульфаминовой кислоты позволяет использовать ее для дальнейших исследований в составе промывочных растворов.
Предварительные исследования, проведенные нами, показали, что отложения накипи в конкретной системе теплоснабженияпрактически полностью растворяются промывными растворами на основе сульфаминовой кислоты[6].
Регенерацию сульфаминовой кислоты в отработанном промывочном растворе и попытки создания условий для утилизации побочных продуктов проводили в несколько этапов:
– на первом этапе получали продукты, приближенные по составу к фунгицидам, используемые для обработки растений от фитофтороза;
– на втором этапе с помощью химических превращений получали материалы, по свойствам близкие к огнестойким;
– на третьем этапе получали сульфат кальция и чистую сульфаминовую кислоту, которую возможно повторно использовать для промывки;
– на четвертом этапе получали продукты, из которых возможно приготовление школьного мела и извести для побелки бытовых помещений.
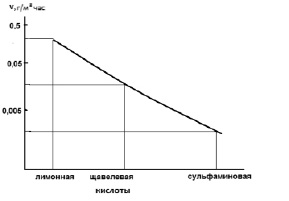
Рис. 1. Зависимость скорости коррозии стального образца от раствора кислоты
Отходы промывных растворы на основе сульфаминовой кислоты в системах теплоснабжения), разнообразные по составу и физико-химическим показателям, не могут быть слиты как сточные воды без соответствующей очистки и регенерации. В настоящее время вопрос утилизации промывных вод стоит очень остро. Изыскиваются возможности переработки сливных промывных вод для получения побочных продуктов.
Использование промывных растворов для переработки на востребованную продукцию дает возможность значительно снизить затраты на утилизацию и связанные с этим экологические проблемы – чистота атмосферы, почвы, экономические показатели и др.
При проведении профилактических работ, связанных с консервацией систем теплоснабжения и их очисткой на малых объектах, а тем более в жилых помещениях, использование минеральных кислот связано с большими неудобствами и некоторыми другими проблемами. При использовании минеральных кислот для целей очистки возникают вопросы регенерации и утилизации отработанных промывочных растворов, что сопряжено с большой дороговизной и сложностью реализации процесса утилизации.
Нами были проведены исследования с растворами сульфаминовой кислоты HSO3NH2c концентрациями от 9 % до 16 %.
Отработанный промывочный раствор на основе сульфаминовой кислоты имеет остаточную концентрацию от 2,9 % до 3,7 %. Для исследований отобрали пять литров отработанного промывочного раствора:
На первом этапе отработанный промывочный раствор подвергали известкованию с получением чистого раствора сульфамата кальция по реакции:
Me(SO3NH2)2 + Ca(OH)2 = Me(OH)2 + +Ca(SO3NH2)2,
где в качестве металла выступают ионы магния (Mg2+), меди (Cu2+), железа (Fe2+), а также другие ионы металлов, присутствующие в коррозионно-накипных отложениях или стравливаемые из конструкционных материалов (труб систем водо- и теплоснабжения.
Плотность раствора соли сульфамата кальция имеет значение 1,18 г/см3. Если рассчитать массу пяти литров полученного раствора, то она составит 5900 г. Используя такие расчеты можно рассчитать массусульфамата кальция, которая может быть получена из 100 литров и более отработанных промывочных растворов. Эту соль можно использовать на нужды сельского хозяйства, в каких-то других отраслях народного хозяйства
На втором этапе проводили испытания уже с продуктами переработки промывных растворов. Анализ литературных источников [7]позволяет предположить выводы, что состав полученного сульфамата кальция Ca(SO3NH2)2близок к составу фунгицидов, используемых в качестве фунгицидного вещества, обладающего биотехнологическими свойствами и применяющегося для обработки верхней кроны растений (ботвы картофеля, лозы виноградника, комнатных растений, зараженных фитофторозом и мучнистой росой, а также обработки клубней картофеля, семян овощей перед посадкой).
Особенно велика роль этого продукта, обладающего свойствами фунгицидных веществ, в условиях концентрации и специализации сельскохозяйственного производства, когда очень широка разветвленность парниковых хозяйств. Несмотря на применение широкого ассортимента средств, методов и приемов защиты растений общие потери от вредных организмов составляют примерно 35 % потенциальной урожайности (треть из них вызывают болезни растений, такие как фитофтороз, мучнистая роса и др.).
Исследования влияния процесса обработки растений заключались в разбавлении чистого раствора Ca(SO3NH2)2 водой для получения концентрации основного вещества при разбавлении до 4–6 %. Полученный продукт, содержащий серу, после проведенного химического анализа и некоторых лабораторных испытаний, путем действия раствора на комнатные растения, зараженные мучнистой росой, или фитофторозом, можно использовать для обработки и наблюдать положительный эффект.

Рис. 2. Фотографии комнатных растений после обработки и до обработки сульфаматом кальция

Рис. 3. Фотографии лозы винограда после обработки и до обработки сульфаматом кальция
Обработка комнатных растений проводилась многократно через 5–7 суток в течение пяти – семи недель. Если пораженность листьев в первые сроки обработки составляла примерно 30–40 %, то после обработки пораженные участки исчезали практически полностью (рис. 2, 3).
На третьем этапе переработки промывочный раствор фильтровали, отфильтрованный прозрачный раствор выпаривали на водяной бане до состояния кристаллического состояния, осадок многократно промывали дистиллированной водой, высушили в сушильном шкафу при температуре 60оС. Дополнительные исследования состава данного продукта позволят его применять в качестве компонента в огнестойком материале. Такой материална основе минерального сырья, отличающийся способностью сохранять свои свойства в условиях эксплуатации при высоких температурах, может служить в качестве конструкционных материалов и в качестве защитных покрытий [8]. Необходимо провести дополнительный химический анализ состава и свойств и рекомендовать полученный продукт для использования в производстве огнестойких материалов. Исследования в этом направлении будут продолжены дипломниками следующего выпуска.
Четвертый этап переработки раствора сульфамата кальция заключался в отстаивании его в течение 5–8 суток, с целью повторного использования, если произошло полное отстаивание и раствор стал прозрачным (осадок весь на дне колбы).
Для этого раствор подкисляли серной кислотой и доводили рН до 1–2. При многократном определении концентрации раствора сульфамата кальция установили его конечную концентрацию 12 %, при этом наблюдали образование осадка сульфата кальция и чистой сульфаминовой кислотыпо реакции:
Ca(SO3NH2)2+ Н2SO4 = CaSO4 + +2HSO3NH2.
Осадок CaSO4 легко отделяли декантацией или фильтрованием. Осадок представляет собой продукт близкий по свойствам со свойствами гипса и может быть использован как добавка в строительный материал.
Полученный сульфат кальция в естественных условиях не представляет угрозы для окружающей среды, если в больших количествах будет находиться в открытом пространстве. Но в открытом пространстве может происходить его быстрая нейтрализация за счет взаимодействия с углекислым газом из атмосферы воздуха и образованием карбоната кальция (СаCO3), также не представляющего угрозы для окружающей среды. Такое превращение приведено уравнением:
CaSO4 + CO2 + H2O = CaCO3 + H2SO4
Полученная по реакции серная кислота пригодна для повторного использования, а карбонат кальция может быть пригоден, как дополнительный компонент при изготовлении школьного мела, белильной извести и других материалов.
Проведенный эксперимент позволяет сделать некоторое заключение.
Заключение
1. Исследовано влияние различных кислот на процесс и скорость растворения коррозионно-накипных отложений.
2. Установленые в процессе исследований показатели изменения массы накипных отложений, позволили рассчитать скорость коррозии, по значениям которых сделаны соответствующие выводы о процессе коррозии.
3. Установленные в процессе исследований показатели скорости коррозии, создадут условия для подбора состава промывочных растворов по удалению коррозионно-накипных отложений, что будет способствовать увеличению пропускной способности трубопроводов и приведет к снижению расхода топлива на обогрев.
4. Проведены исследования по утилизации и экспертизе отходов промывных растворов для их переработки на нужные продукты.

