Биологически активные белки – полифункциональные естественные факторы защиты живых организмов, участвующие в регуляции многих физиологических и иммунологических функций. Актуальным считается использование в технологии пищевых продуктов и производстве лекарственных препаратов белков молока, которые выполняют защитную, антимикробную, регенерирующую, антиоксидантную, иммуномодулирующую, регуляторную и другие функции.
Перспективным направлением развития биотехнологии является получение биологически активных веществ молока с сохранением их биологической активности из вторичных молочных ресурсов, которые содержат комплекс специфических (иммуноглобулины различных классов) и неспецифических (лактопероксидаза, лизоцим, лактоферрин, нуклеазы др.) белковых защитных компонентов. Особый интерес среди неспецифических компонентов вызывают лактопероксидаза, лизоцим и лактоферрин – полноценные по аминокислотному составу и характеризующиеся высокой биологической активностью сывороточные белки.
В молоке биологически активные белки существуют в комплексе. Сочетание биологически активных белков молока с учетом взаимного влияния компонентов может обеспечивать возможность создания высокоэффективных биологически активных препаратов и продуктов лечебно-профилактической направленности широкого спектра действия. Применение таких препаратов, характеризующихся высокой биологической ценностью, сегодня рассматривается как наиболее легкий, физиологичный и доступный метод обеспечения иммунной защиты против вирусных и бактериальных инфекций, при лечении социально значимых гастроэнтерологических и онкологических заболеваний, с целью снижения побочного действия медикаментозной терапии.
В связи с этим актуальной является цель исследования – разработка технологии получения комплекса биологически активных белков молочной сыворотки с учетом природного соотношения компонентов, их взаимного влияния, биологической активности и безопасности, перспективности его применения в качестве продуктов лечебно-профилактической направленности, а также эффективного способа получения разработанного комплекса, входящего в схему безотходной переработки молочного сырья. Около 50 % образующейся при производстве сыра, творога и казеина сыворотки (1,5 – 3 млн т в год) утилизируют, что значительно ухудшает состояние окружающей среды и приводит к потере ценных продуктов [7].
Материалы и методы исследования
Свойства используемого сырья
Молочная сыворотка – побочный продукт при производстве сыров, творога и казеина. Сыворотка является одним из продуктов при сепарации молока, после его сворачивания или добавления кислых веществ.
В сыворотку переходит около 60 % сухих веществ молока, в том числе 30 % белков, поэтому она обладает высокой пищевой и биологической ценностью [8].
Лактоферрин (от лат. lac (lactis) – молоко и ferrum – железо) – бактерицидный железосвязывающий белок. Это полифункциональный белок из семейства трансферринов, является глобулярным гликопротеином с молекулярной массой около 80 кДа и широко представлен в различных секреторных жидкостях, таких как молоко, слюна, слезы, секреты носовых желез. Выделенный из коровьего молока лактоферрин является отличной основой для приготовления заменителя грудного молока, не вызывающего аллергию, но обладающего при этом всеми лечебными и иммуностимулирующими свойствами [3]. Основные физико-химические свойства лактоферрина представлены в табл. 1.
Лизоцим – антибактериальный агент, фермент класса гидролаз, разрушающий клеточные оболочки бактерий путём гидролиза мурамилглюкозамина клеточной стенки грам-положительных бактерий. Молекулярная масса лизоцима 14 300–14 600 Да, изоэлектрическая точка в пределах рН 10,7. В природе содержится в различных органах и тканях организма человека (слизистая рта и носовой полости, печень, селезенка) и животных, в биологических жидкостях (слезы, слюна, пищеварительный секрет, молоко), где в основном выполняет барьерную функцию защиты от микробной инфекции. Наиболее изученным является лизоцим, выделенный из белка куриных яиц [6].
Таблица 1
Физико-химические свойства лактоферрина
|
Свойство |
Описание |
|
Внешний вид |
Аморфный порошок |
|
Цвет |
от белого до светло-желтого |
|
Запах |
специфический |
|
Молекулярная масса, Да |
80 000 |
|
Изоэлектрическая точка |
8,7 |
|
Концентрация в молоке, мг/мл |
1 |
|
Рабочий диапазон рН |
2–7 |
|
Рабочий диапазон температур, °С |
0–100 |
Лактопероксидаза является ферментом выделяемой из молочной железы, слюнных и других желез слизистой оболочки, которые функционирует как природный антибактериальный агент. Лактопероксидаза является членом семьи гем-пероксидазы ферментов, катализирует окисление ряда органических и неорганических субстратов перекисью водорода. Совместно с неорганическим субстрат ионом, перекисью водорода и продуктами окисления известна как лактопероксидазная система [1]. Основные физико-химические свойства лактопероксидазы представлены в табл. 2.
Таблица 2
Физико-химические свойства лактопероксидазы
|
Свойство |
Описание |
|
Внешний вид |
Аморфный порошок |
|
Цвет |
от белого до светло-желтого |
|
Запах |
специфический |
|
Молекулярная масса, Да |
82 000 |
|
Изоэлектрическая точка |
6,8 |
|
Концентрация в молоке, мг/л |
от 30 до 100 |
|
Рабочий диапазон рН |
2–7 |
|
Рабочий диапазон температур, °С |
0–80 |
|
Ингибиторы активности |
Азиды, сульфиды, цианиды |
|
Активаторы |
Ионы кальция, тиоцианат и пероксид водорода |
Антимикробную активность лактопероксидаза проявляет синергически с лактоферрином и лизоцимом.
Для проведения процесса сорбции были выбраны различные ионогенные и неионогенные сорбенты, характеристика которых представлена в табл. 3 [5].
Таблица 3
Характеристика ионогенных и неионогенных сорбентов
|
Сорбент |
Функциональная группа |
Насыпной вес, г/мл |
Средний радиус зерна сорбента, мкм |
Средний диаметр пор, Е |
Удельная поверхность, м2/г |
Коэффициент набухания |
Тип полимерной матрицы |
|
Ионогенные |
|||||||
|
КУ-23 |
-SO3H |
0,75–0,9 |
> 400 |
5500 |
300–400 |
1,1 |
Макропористый, сополимер стирола и дивинилбензола |
|
Purolite C150 |
-SO3H |
0,79–0,83 |
– |
– |
1,6 |
макропористый |
|
|
Purolite C160 |
-SO3H |
0,82–0,86 |
– |
– |
1,4 |
макропористый |
|
|
Purolite C115E |
-COOH |
0,66–0,71 |
– |
– |
1,8 |
Пористая сшитая метакриловая кислота |
|
|
Биокарб |
-COOH |
– |
– |
– |
5 |
Гетеросетчатый, сополимер метакриловой кислоты с длинноцепочечным сшивающим агентом |
|
|
Неионогенные |
|||||||
|
Purasorb |
– |
0,64–0,67 |
> 400 |
1300 |
180–200 |
1,14 |
макропористый, СДБ |
|
Полисорб |
– |
0,29–0,32 |
2500 |
270–350 |
1 |
макропористый, сшитый полистирол |
|
Концентрацию белка в растворе определяли с помощью реактива Фолина – Чиокальтеу по методике, в основу которой положен метод Лоури [2]. Ферментативную активность лактопероксидазы определяли по пирогаллолу [9]. Определение ферментативной активности лизоцима проводили методом диффузии в агар (Каграманова, Ермольева, 1966). Анализ белкового состава исходной молочной сыворотки, полученного после очистки элюата и всех растворов, получаемых по ходу разработки технологии, проводили методом гельхроматографии. В качестве молекулярно-ситового геля использовали сефадекс фирмы «Sigma» марки G-50-150.
Результаты исследования и их обсуждение
Выбор основного источника сырья на основе молока и отходов молочного производства
В качестве потенциальных источников сырья для получения лактоферрина, лизоцима и лактопероксидазы можно рассматривать само молоко (как человеческого, так и животного происхождения), молочные железы крупного рогатого скота и молочную сыворотку, которая является промышленным отходом кисломолочного производства и сыроварения. Так как молоко содержит огромное количество белков, что значительно усложняет процесс, то целесообразно использовать сыворотку сыроварения, которая обрабатывалась сычужным ферментом (выделяется из желудка телёнка, или добавляется сам телячий желудок- сычужина) для свёртывания казеина при температуре 37 °С и в которой не происходит денатурация белка.
Для проведения экспериментов приобретали свежее домашнее непастеризованное коровье молоко на рынке и из него получали молочную сыворотку по технологии получения казеиновой сыворотки.
Провели сравнительный анализ методов коагуляции молока с целью удаления казеина. Сравнивали методы высаливания с применением насыщенного 4 М раствора сернокислого аммония (1), кристаллического сульфата аммония (2) с методом осаждения створаживающим агентом (3). Измеряли концентрацию общего белка по методу Лоури и активность лактопероксидазы по пирогаллолу в надосадочной жидкости и в осадке для каждого метода коагуляции. В случае (1) оптимальная степень насыщения равна 0,3, так как при этом обработанное молоко легко и быстро фильтруется, а в сыворотке содержится комплекс лактоферрина, лизоцима и лактопероксидазы. В случае осаждения кристаллическим сульфатом аммония (2) и порошком пепсина (3) в осадке не наблюдали активность лактопероксидазы и лизоцима, тогда как в случае осаждения насыщенным раствором сульфата аммония (1) небольшая часть ферментов осталась в осадке. При использовании пепсина (3) как створаживающего агента концентрация белка почти в 3 раза больше, чем при использовании кристаллического сульфата аммония (2). По показаниям активности лизоцима и лактопероксидазы при обработке реагентами (2) и (3) получились соизмеримые результаты. При обработке реагентом (3) осадок получили более плотный, легко отделимый от надосадочной жидкости. Это свидетельствует о более качественном разделении. Экспериментальные данные гельхроматографического анализа полученной надосадочной жидкости после обработки (3) представлены на рис. 1 в виде зависимости:
Сi/Сисх = f (Vi – Vо/Vкол), (1)
где Vi – объём фракции, мл;
Vо – свободный объём колонки, мл; Vо = 3 мл;
Vкол– общий объём колонки, мл; Vкол = 18 мл;
Сi – концентрация белка в каждой фракции, мг/мл;
Сисх – концентрация белка в исходном растворе, мг/мл.
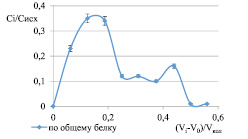
Рис. 1. Гельхроматограмма надосадочной жидкости по общему белку при обработке молока порошком пепсина
Экспериментальные данные, представленные на рис. 1, показывают, что в результате фракционирования отделили большую часть высокомолекулярных примесей, но осталось достаточно большое количество низкомолекулярных примесей, которые возможно отделить с помощью более эффективного сорбционно-хроматографического метода очистки биологически активных белков.
Изучение сорбционных свойств лактоферрина, лизоцима и лактопероксидазы из молочной сыворотки
Для проведения процесса очистки комплекса биологически активных белков провели экспериментальную работу по подбору оптимального сорбента. Для этого исследовали процесс сорбции на следующих ионогенных и неионогенных сорбентах в статических условиях при t = 20-22 °С: КУ-23; Purolite C 150; Purolite C 160; Purasorb; Полисорб; Purolite C 115 Е; Биокарб.
Расчет емкости сорбции m проводили по формуле:
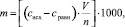 (2)
(2)
где cисх – исходная концентрация общего белка в растворе, мг/мл;
сравн – равновесная концентрация общего белка в растворе, мг/мл;
V – объем раствора, мл;
n – величина навески сорбента, мг
На основании полученных экспериментальных данных была построена зависимость между равновесной концентрацией белка в фазе сорбента (m, мг/г) и равновесной концентрацией белка в фазе раствора (Сравн, мг/мл). Изотермы сорбции белков молочной сыворотки на различных сорбентах представлены на рис. 2.
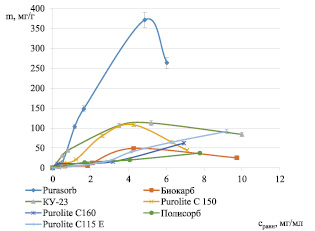
Рис. 2. Изотермы сорбции лактоферрина, лизоцима и лактопероксидазы на различных сорбентах при t = 20 – 22 °С
Как видно из данных, представленных на рис. 2, практически все изотермы относятся к аномальным, т.е. изотермам с максимумом. Это может быть связано с протеканием процессов ассоциации-диссоциации при сорбции. Для каждого сорбента максимум наблюдается при разных концентрациях в зависимости от размеров пор сорбентов.
Сорбент Полисорб имеет наименьшую емкость. У молекулярных сорбентов, к которым относится Purasorb, десорбция идет только при наличии органического растворителя. Для сорбентов Purolite тоже необходимо небольшое количество органического растворителя. Изотерма сорбции на КУ-23 наиболее близка к изотерме Ленгмюра, элюировать белки можно методом перезарядки. Последующие эксперименты проводили на сорбенте КУ-23.
После проведения эксперимента рассчитывали коэффициент распределения Кd, мл/г по формуле:
Кd = m/Cравн, (3)
где m – емкость сорбента, мг/г;
Cравн – равновесная концентрация белка, мг/мл.
Результаты расчётов представлены на рис. 3.
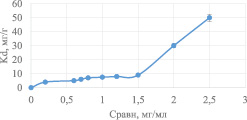
Рис. 3. Зависимость коэффициента распределения от равновесной концентрации белка в растворе
Из данных, представленных на рис. 3 видно, что максимальный коэффициент распределения достигаются при равновесных концентрациях белка больше 2 мг/мл, то есть при использовании неразбавленной молочной сыворотки.
Исследование рН-оптимума сорбцuu
Экспериментальные исследования показали, что ёмкость сорбции на сульфокатионите КУ-23 как по белку, так и по активности зависит от рН, и в диапазоне от нейтральных значениях рН до кислого наблюдается плато, а при рН > 7 происходит резкое снижение ёмкости сорбции. Десорбция с этого сорбента может успешно проводиться слабыми растворами неорганических оснований, которые не летучи, нетоксичны и невзрывоопасны. При этом ёмкость сорбции достаточно большая для рационального проведения процесса.
В результате проведённого исследования процесса сорбции белков молочной сыворотки в статических условиях на сульфокатионите КУ-23 показано, что процесс сорбции следует вести при рН = 7, процесс десорбции при рН близкой к изоточкам смеси белков, без разбавления исходной сыворотки.
Исследование процессов сорбции-десорбции лактоферрина, лизоцима и лактопероксидазы на сульфокатионите КУ-23 в динамических условиях
Изучение динамики сорбции проводили на лабораторных колонках. Подбирали оптимальную скорость сорбции (Wсорб), скорость промывки (Wпром.) и скорость десорбции (Wдесорб.). Рассчитывали критерий регулярности режима сорбции λ, который позволил определить оптимальный режим сорбции.
Критерий регулярности режима сорбции λ характеризует динамический процесс, проходящий в неравновесных условиях, когда в колонке не существует равновесия между концентрацией вещества в сорбенте и в растворе. Это связано с высокими молекулярными массами объектов и медленной внутридиффузионной кинетикой. Кинетико-динамический параметр λ дает возможность создать условия, которые приблизят процесс к равновесному. Теоретически [4] было выведено, что при λ > 0,35 процесс близкий к регулярному, кривая сорбции симметрична, наблюдается высокая емкость сорбции. При λ < 0,35 процесс далек от равновесия, кривая сорбции несимметрична. Наблюдается низкая емкость сорбции и длительное время достижения исходной концентрации.
Выражение для расчета критерия регулярности режима сорбции:
λ = 12 (1 – ε0) Kd Dэфф/(Wраб d2ч) H0, (4)
где λ – критерий регулярности режима сорбции,
ε0 – порозность слоя сорбента, ε0 = 0,4,
Kd – коэффициент распределения, мл/г,
Wраб – рабочая скорость процесса, мл/ч,
dч – диаметр частиц сорбента, мкм. dч (КУ-23) = 500 мкм,
H0 – начальная высота сорбента, м. H0 (КУ-23) = 4,5 см,
Dэфф – эффективный коэффициент диффузии, м2/с : D=2*10-11 м2/с.
По результатам расчета λ = 0,92 > 0,З5, что позволяет говорить о близком к равновесному режиму сорбции при выбранных нами условиях на лабораторной колонке. В дальнейшем, основываясь на Wраб и D зерна и меняя габариты колоны, можно подобрать оптимальное соотношение величин, соответствующее равновесному режиму сорбции при масштабировании процесса.
Ввиду того, что лактопероксидаза и лактоферрин имеют сходные молекулярные массы, то условия десорбции подбирали отдельно для комплекса лактоферрина с лизоцимом и комплекса лактоферрина с лактопероксидазой. Динамический процесс проводили методом дробной элюции.
Для комплекса лактоферрина с лактопероксидазой в качестве первого элюента использовали раствор аммиака рН = 9, в качестве второго раствор аммиака рН =1 0. Общий выход после сорбции и десорбции по активности лактопероксидазы составил: ηактив. перокс. сорб. = 75 %, ηактив. перокс. десорб = 92,5 %.
При пропускании сыворотки через катионит последний поглощает из нее катионы кальция и магния. Многозарядные ионы удерживаются ионитом сильнее однозарядных. Оставшихся в элюате ионов кальция может быть недостаточно для проявления активности лактопероксидазы. Поэтому провели исследования, в которых в качестве элюента выбрали раствор аммиака с 5 % СаСl2 при рН = 10,0. Полученная выходная кривая представлена на рис. 4.
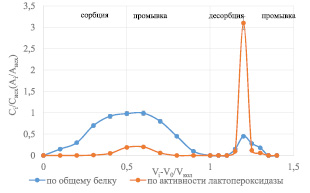
Рис. 4. Выходная кривая сорбции-десорбции лактоферрина с лактопероксидазой на КУ-23 (десорбция раствором аммиака с 5 % СаСl2, pH = 10,0)
Из данных, представленных на рис. 4, видно, что при использовании в качестве элюента СаСl2 наблюдали обострение пика по активности лактопероксидазы. Эффективность десорбции раствором аммиака с 5 % СaCl2 оценивали по гельхроматограмме элюата: по белку выходит один единый пик вместо трех исходных, лактопероксидаза приходится на первые объемы этого пика, что дает резерв для повышения удельной активности.
Для комплекса лактоферрина с лизоцимом в качестве первого элюента использовали 2М раствор сульфата аммония в аммиаке рН = 9, в качестве второго раствор аммиака рН = 11,5. Экспериментальные данные представлены на рис. 5.
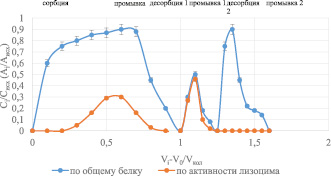
Рис. 5. Выходная кривая сорбции-десорбции лактоферрина с лизоцимом на КУ-23
Такое проведение процесса оказалось эффективным: после первой десорбции выходит только лизоцим (пик по белку с активностью лизоцима), а после второй десорбции только лактоферрин. Общий выход после десорбции по активности лизоцима составил: ηактив. лизоцим десорб = 62 %.
Выводы
- Сравнительный анализ методов получения молочной сыворотки показал, что наиболее эффективной является обработка молока створаживающим агентом.
- Гельхроматографический анализ показал, что сыворотка на 80 % состоит из высокомолекулярных белков.
- По изотермам сорбции на различных ионогенных и неионогенных сорбентах был выбран оптимальный сорбент для последующих экспериментов в динамических условиях – макропористый сульфокатионит КУ-23.
- Разработали метод дробной элюции для отделения балластных белков от комплекса биологически активных белков, а также разделения лактоферрина/лактопероксидазы и лизоцима. В качестве первого элюента используется раствор аммиака рН = 9 и десорбируются низкомолекулярные примесные белки, в качестве второго элюента используется раствор аммиака рН = 10 с 5 % СаСl2 и десорбируется комплекс лактоферрина и лактопероксидазы. При таких условиях удалось получить комплекс лактоферрина и лактопероксидазы. Для разделения лактоферрина/лактопероксидазы и лизоцима в качестве первого элюента использовали 2М раствор сульфата аммония в аммиаке рН = 9, в качестве второго раствор аммиака рН = 11,5.

