Введение. Лимфоидные узелки разных органов у человека и животных довольно подробно описаны в литературе [5]. Гораздо менее изучены периваскулярные лимфоидные узелки (ПВЛУ), которые были впервые описаны Л.В. Чернышенко (19571959) около лимфатических капилляров (ЛК) и венул кожи, мышц, апоневрозов, брюшины [6]. По ее мнению, ПВЛУ являются источником обогащения периферической лимфы лимфоцитами, они проникают в просвет ЛК из ретикулярной ткани. Ее клетки превращаются в макрофаги и лимфоциты. ПВЛУ пронизаны капиллярными клубочками, располагаются по ходу мелких артерий и вен, связаны с ними посредством артериол и венул, они проходят через ворота ПВЛУ. Я обнаружил полиморфные ПВЛУ в процессе исследования архитектоники гемолимфомикроциркуляторного русла (ГЛМЦР) брыжейки тонкой кишки [3, 4]. Однако морфогенез ПВЛУ до сих пор не описан.
Материал и методы
С целью изучить строение и топографию ПВЛУ я провел исследование брыжейки тонкой кишки у 12 собак на ее серийных гистологических срезах, окрашенных азурIIэозином и пикрофуксином по ван Гизон, и на ее тотальных препаратах, окрашенных квасцовым гематоксилином или импрегнированных азотнокислым серебром. Размеры микрососудов были определены на тотальных препаратах с помощью окулярамикрометра.
Результаты
В составе не каждого микрорайона ГЛМЦР брыжейки определяются ПВЛУ. Их число, размеры, форма, строение и топография очень вариабельны. Разные лимфоидные образования могут быть в разном количестве рассеяны по всему микрорайону, не приближаясь к его контуру, или, напротив, сосредоточены вокруг коллатералей контурного пучка (рис. 13). Они обычно окружают собирательную венулу разного диаметра, первичную или вторичную, ее корни и притоки, включая посткапиллярные венулы. Собирательная венула может проходить сквозь ПВЛУ или предузелок, расщепляясь в виде «островка» в его толще, или выходить из него, в т.ч. рядом с терминальной артериолой, ЛК или лимфатическим посткапилляром. Ветви терминальной артериолы могут входить самостоятельно в ПВЛУ, на удалении от венулы, со стороны ее вхождения в ПВЛУ и т. д. Чем крупнее ПВЛУ, тем крупнее ее кровеносные микрососуды. Встречаются не только типичные ПВЛУ как плотные скопления лимфоцитов прежде всего вокруг венул. Вокруг посткапиллярной венулы нередко определяются в разном количестве рассеянные лимфоциты, сама венула при этом расширена, а ее эндотелий утолщен. Венулу могут окружать рыхлые скопления лимфоцитов разной плотности, неоформленные, без четких границ, в их составе порой обнаруживаются очаги сгущения лимфоидной ткани (предузелки), и оформленные (узелки). На территории одного микрорайона ГЛМЦР можно увидеть все перечисленные лимфоидные образования как разные этапы морфогенеза ПВЛУ. Наиболее мелкие из них находятся в центре микрорайона ГЛМЦР, наиболее крупные на его периферии. С увеличением размеров округлая форма ПВЛУ как основная встречается все реже: удлинение вдоль магистрализующейся венулы приводит к изменению исходной формы ПВЛУ на овальную и эллипсовидную. Она может быть отросчатой или совершенно неправильной, когда лимфоидная ткань переходит на крупные притоки вторичной собирательной венулы. ПВЛУ находится между терминальной артериолой (диаметр 2030 мкм) и собирательной венулой (диаметр 3050 мкм), вокруг их ветвей и корней, т.е. на территории типичного модуля ГЛМЦР открытого типа, который становится комплексным («иммунным») модулем. ПВЛУ, таким образом, служит продуктом кооперации лимфатической и лимфоидной систем на их периферии. Вторичные лимфоидные образования функционируют как противоточная система: по тканевым каналам, ЛК с тонкими эндотелиальными стенками без базальной мембраны или синусам лимфоузла поступают антигены, из посткапиллярных венул клетки крови. При длительной антигенной стимуляции вокруг венул формируются скопления лимфоцитов, они сгущаются с образованием ПВЛУ. Выбор тканевых каналов и ЛК в качестве путей транспорта к ним антигенов (крупнодисперсных частиц) определяется толщиной и строением их стенок. Путями притока макрофагов и лимфоцитов в ПВЛУ становятся посткапиллярные венулы. Стенка кровеносных капилляров, конечно, тоньше, но они имеют узкий просвет. В случае необходимости быстрого притока большого числа лимфоцитов они могут поступать в венулу по артериоловенулярному анастомозу, в обход капиллярной сети.
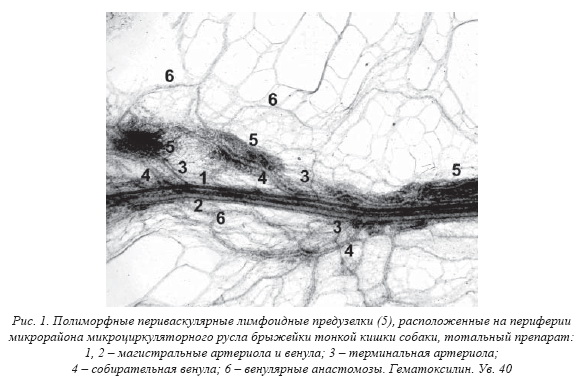
При изучении так
называемых «бессосудистых» (точнее малососудистых) участков ГЛМЦР часто
встречаются «обрубленные» артериолы концевого типа. Их могут сопровождать
собирательные венулы. Терминальная артериола нередко спиралевидно огибает
венулу. Венула сильно искривляется в виде дуги и распадается на
посткапиллярные венулы, часто петлевидные. Они вместе с ветвями терминальной
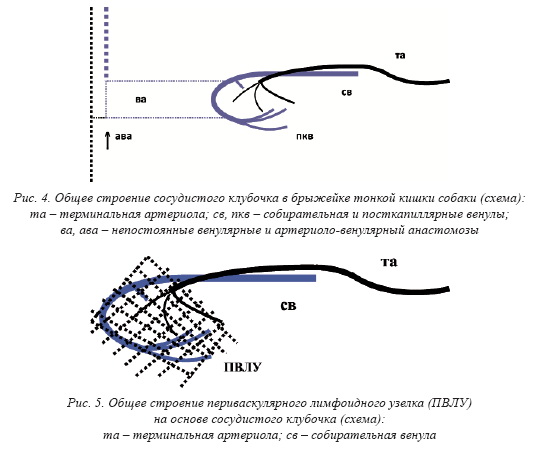
артериолы фомируют сосудистые клубочки (рис. 4). Последние, обычно их собирательная венула, могут формировать
анастомозы с другими венулами и артериолами. Сосудистые клубочки часто содержат
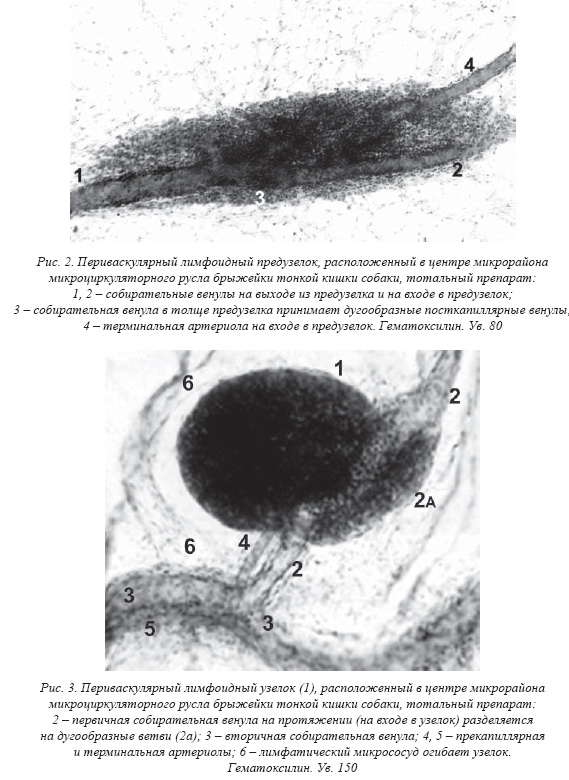
лимфоциты в разном количестве, вплоть до формирования ПВЛУ (рис. 5). Такие конструкции позволили мне предположить, что сильные искривления
венул способствуют торможению оттока крови и выходу ее клеток в окружающую
соединительную ткань с последующим ее преобразованием в лимфоидную. Сходным
образом может происходить морфогенез ПВЛУ и в типичных микрорайонах ГЛМЦР, в
т.ч. в контурных пучках их венулярные
коллатерали часто образуют значительные искривления, включая венулярные сплетения
различной конструкции, в т.ч. с лимфоцитами.
ПВЛУ в составе микрорайона и комплексных модулей МЦР тесно связаны с венулами. Посткапиллярные венулы являются источником лимфоцитов ПВЛУ, где они могут размножаться при антигенной стимуляции. Трансмуральная эмиграция лимфоцитов обусловливает утолщение эндотелия посткапиллярной венулы, а увеличение притока крови к формирующемуся ПВЛУ приводит к локальному росту и магистрализации МЦР, превращению посткапиллярной венулы в собирательную, росту ПВЛУ вокруг последней и ее притоков. Поэтому морфогенез ПВЛУ выглядит как результат повышения функциональной нагрузки на ГЛМЦР и его адекватной перестройки. Включением ПВЛУ в его состав обеспечивается, очевидно, дополнительный механизм адаптации ГЛМЦР в физиологических условиях и при воздействии экстремальных факторов, наряду с многочисленными анастомозами на всех уровнях структурной организации микроциркуляции. Ворота ПВЛУ как место прохождения ее артериолы и венулы [6] определяются не всегда, артериола и венула могут входить в ПВЛУ в разных местах, ПВЛУ может прилежать к ним различным образом. Морфогенез ПВЛУ напоминает фетальную закладку лимфоузлов [1, 2], где клубочек кровеносных микрососудов формируется в окружении сужаемого им лимфатического сосуда с эндотелиальной стенкой создаются условия для торможения:
1) прямого (и развития трансфузионного) лимфотока с осаждением антигенов (продуктов распада эмбриональных структур) в стромальном зачатке узла;
2) кровотока с миграцией макрофагов и лимфоцитов из крови в зачаток узла. Морфогенез ПВЛУ представляется результатом повышения функциональной нагрузки на ГЛМЦР сразу в двух направлениях:
1) локальная антигенная стимуляция. В ответ активируется эмиграция макрофагов и лимфоцитов из венул с постепенным скоплением вдоль венул, между петлями капиллярной сети и последующим «расползанием» на всю сеть, на посткапиллярные и собирательные венулы, сгущением и образованием ПВЛУ;
2) (локальное) увеличение гемодинамики, в т. ч. усиление притока крови в очаг антигенной стимуляции. В результате происходят магистрализация капиллярной сети и посткапиллярных венул, искривление венул, морфогенез сосудистых клубочков и венулярных сплетений, в т.ч. в составе околососудистого русла магистральных венул и артериол. Таким образом, перестройка ГЛМЦР и гистогенез лимфоидной ткани это процессы сопряженные. Однако возможен морфогенез ПВЛУ на основе существующих сосудистых клубочков и венулярных сплетений, которые постоянно, хотя и в разном виде встречаются в микрорайонах ГЛМЦР с разным строением.
Список литературы
1. Петренко В.М. Развитие лимфатической системы в пренатальном онтогенезе человека. СПб: Издво СПбГМА, 1998. 364 с.
2. Петренко В.М. Эволюция и онтогенез лимфатической системы. Второе издание. СПб: Издво ДЕАН, 2003. 336 с.
3. Петренко В.М. Ангиоархитектоника гемомикроциркуляторного русла в брыжейке тонкой кишки собаки // Фунд. иссля. 2009. № 8. С. 4346.
4. Петренко В.М. Топография лимфатических микрососудов // Междунар. журнал прикл. и фунд. исследй. 2010. № 1. С. 1720.
5. Сапин М.Р., Этинген Л.Е. Иммунная система человека. М.: издво «Медицина», 1996. 304 с.
6. Чернышенко Л.В., Семенова Т.В., Сырцов В.К. Неизвестные ранее иммунные органы путей микроциркуляции. ДонецкКиев: гортипя Донецк. облупря по печати, 1994. 140 с.

