Термические поражения занимают одно из центральных мест в общей структуре травматизма [3]. Активация свободно-радикальных процессов при ожогах приводит к развитию окислительного стресса, являющегося одним из универсальных механизмов повреждения тканей [6]. В связи с этим актуальным является исследование свободнорадикального окисления в различных органах и тканях при ожогах и поиск возможных путей их коррекции. Особый интерес вызывает использование оксид азота (NO) как универсального регулятора различных физиологических процессов в организме животных и человека [2]. Одним из перспективных источников NO, лишенных недостатков органических нитратов и потенциально приемлемых для биомедицинского применения, являются динитрозильные комплексы железа, в частности ДНКЖ, содержащие тиольные лиганды, например цистеин, глутатион [1]. ДНКЖ формируются в организме эндогенно, выступают в качестве регуляторов разнообразных физиологических процессов: подавляют тромбообразование, оказывают антиоксидантное действие, ускоряют заживление кожных ран, снижают некротическую зону при экспериментальном инфаркте миокарда и др. [10]. При этом ДНКЖ малотоксичны, обладают пролонгированным действием [8]. Однако остается неясной реакция организма на экзогенное введение ДНКЖ при комбинированной термической травме (КТТ).
Целью работы явилось изучение влияния ДНКЖ на процессы перекисного окисления липидов (ПОЛ) и состояние антиоксидантной системы в органах крыс с КТТ.
Материалы и методы исследования
Эксперимент проведен на белых крысах-самцах линии Wistar, полученных из филиала «Столбовая» ФГБУ «Научного центра биомедицинских технологий Федерального медико-биологического агентства» (Москва). Все животные содержались в стандартных условиях вивария в клетках при свободном доступе к пище и воде на рационе питания, согласно нормативам ГОСТа «Содержание экспериментальных животных в питомниках НИИ». Условия работы с животными соответствовали правилам Европейской Конвенции ET/S 129, 1986 и директивам 86/609 ESC. После 14–дневной адаптации к условиям местного вивария и карантина из 45 крыс массой 200–250 г. сформировали следующие группы: 1 – интактные здоровые животные (n = 15); 2 – контрольная (животные с КТТ, n = 15), которым ежедневно внутрибрюшинно вводили 1 мл физиологического раствора; 3 – животные с ожогом, ежедневно получавшие лечение в виде внутрибрюшинных инъекций 10 %-ого раствора ДНКЖ (1 мл; 0,3 ммоль/л) (n = 15). ДНКЖ с глутатионом получали по методике Ванина А.Ф. [1]. Концентрацию ДНКЖ определяли спектрофотометрическим методом на спектрофотометре Power Wave XS (Bio-Tek, USA) в диапазоне длин волн 410–700 нм. КТТ (контактный ожог на площади 20 % поверхности тела и термоингаляционное воздействие горячим воздухом и продуктами горения в течение 20–30 сек в условиях камеры ингаляции) наносили под наркозом (Золетил (60 мг/кг) + Ксила(6 мг/кг)). Животных выводили из эксперимента на 3 и 10 сутки после травмы путем декапитации с предварительной перерезкой сонной артерии под наркозом (Золетил + Ксила).
Для оценки ПОЛ использовали 10 %–ый гомогенат тканей органов (легкие, почки) на основе среды, содержащей 0,25М раствор сахарозы, 1мМ раствор ЭДТА, 0,01М трис–HCl – буфер (рН = 7,5). Активность ПОЛ изучали с помощью метода индуцированной биохемилюминесценции на биохемилюминометре БХЛ-06 (Н.Новгород). Оценивались следующие параметры хемилюминограммы: tg 2α – показатель, характеризующий скорость спада процессов свободнорадикального окисления в плазме и свидетельствующий об общей антиоксидантной активности (АОА); S – светосумма хемилюминесценции за 30 сек. – отражает потенциальную способность биологического объекта к ПОЛ. Содержание промежуточного продукта ПОЛ, малонового диальдегида (МДА) определяли по методу М. Mihara, М. Uchiyama [9]. Для оценки активности каталазы [4] и супероксиддисмутазы (СОД) [5] использовали спектрофотометрические методы. Концентрацию белка вычисляли по методу Лоури в модификации [7].
Результаты исследований обрабатывали с использованием программы Statistica 6.0. Значимость различий между показателями определялась с помощью t-критерия Стьюдента. Статистически значимыми считались различия при р < 0,05.
Результаты исследования и их обсуждение
Наиболее частым компонентом, встречающимся при ожоговой болезни, является недостаточность органов дыхания [3]. Проведенные исследования показали, что на 3 сутки после КТТ в гомогенате легких светосумма хемилюминесценции возросла на 68,5 % (p = 0,009) по сравнению со здоровыми животными, на 10 сутки показатель S увеличился на 11,5 % (p = 0,021) (рис. 1). Введение крысам с термической травмой ДНКЖ вызвало статистически значимое снижение процессов свободнорадикального окисления в легких на 45 % (p = 0,011) на 3 сутки после травмы по сравнению с контролем, способствуя нормализации данного показателя. Отмечена тенденция к снижению ПОЛ под влиянием ДНКЖ в легких на 10 сутки после повреждения на 12 % (p = 0,064) по сравнению с крысами контрольной группы (рис. 1).
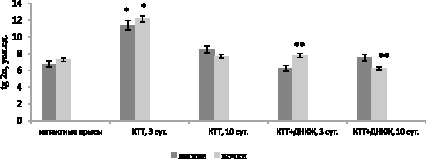
Рис. 1. Динамика изменения светосуммы хемилюминесценции в органах крыс при ожоге и на фоне введения динитрозильных комплексов железа. Примечание: * – различия статистически значимы по сравнению со здоровыми животными (p < 0,05); ** – различия статистически значимы по сравнению с контролем (p < 0,05)
Активация ПОЛ при КТТ сопровождалась незначительным увеличением МДА в легких на 3 сутки после травмы по сравнению с контрольной группой крыс (рис. 2). На 10 сутки после КТТ выявлено снижение данного показателя на 29,1 % (p = 0,007) по сравнению со здоровыми крысами, что, вероятно, можно объяснить повышением активности ферментов, участвующих в утилизации высокотоксичных альдегидов.
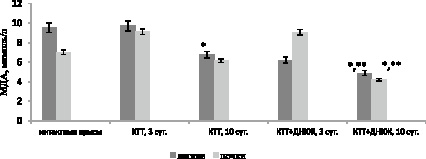
Рис. 2. Динамика изменения концентрации малонового диальдегида в органах крыс при ожоге и на фоне введения динитрозильных комплексов железа. Примечание: * – различия статистически значимы по сравнению со здоровыми животными (p < 0,05); ** – различия статистически значимы по сравнению с контролем (p < 0,05)
На фоне воздействия ДНКЖ в легких обнаружено снижение МДА на 3 и 10 сутки после травмы на 36 % (p = 0,008) и 28 % (p = 0,021) соответственно по сравнению с контрольной группой крыс.
Известно, что при ожоге нарушается прооксидантно-антиоксидантное равновесие, в результате чего интенсифицируются свободно-радикальные реакции и развивается окислительный стресс. Это приводит к гиперпродукции активных форм кислорода, мишенью которых являются различные клетки и клеточные структуры [6]. Показано, что ДНКЖ оказывают нормализующее влияние на ПОЛ в легких при термической травме.
По данным индуцированной биохемилюминесценции в легких не обнаружено статистически значимых различий в показателях АОА между крысами контрольной группы и здоровыми животными (рис. 3). Однако введение ДНКЖ на фоне КТТ вызвало повышение АОА на 3 сутки после поражения на 28 % (p = 0,076) по сравнению с контролем.
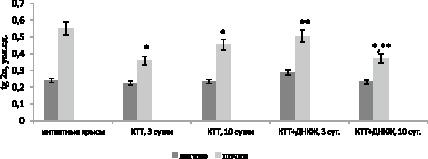
Рис. 3. Динамика изменения показателя tg2α в органах крыс при ожоге и на фоне введения динитрозильных комплексов железа. Примечание: * – различия статистически значимы по сравнению со здоровыми животными (p < 0,05); ** – различия статистически значимы по сравнению с контролем (p < 0,05)
Большое значение для поддержания в клетках прооксидантно-антиоксидантного баланса и внутриклеточного восстановительного потенциала имеют реакции, которые катализируют СОД, каталаза. В легких выявлено снижение удельной активности СОД в 1,2 раза (p = 0,034) на 3 сутки и в 1,8 раза (p = 0,004) на 10 сутки после КТТ по сравнению с показателем здоровых животных (табл.1). Активность каталазы в легких снизилась в 4,5 раза (p = 0,001) на 3 сутки и в 1,2 раза (p = 0,009) на 10 сутки после КТТ по сравнению с интактными крысами (табл. 2).
Таблица 1
Удельная активность супероксиддисмутазы (усл.ед./мг белка) в органах крыс с ожогом под влиянием динитрозильных комплексов железа
|
Органы |
интактные крысы (n = 15) |
КТТ, 3 сутки (n = 8) |
КТТ, 10 сутки (n = 7) |
КТТ + ДНКЖ, 3 сутки (n = 8) |
КТТ + ДНКЖ, 10 сутки (n = 7) |
|
Легкие |
1586,70 ± 64,14 |
1324,59 ± 53,62* |
897,01 ± 43,27* |
599,53 ± 31,97 */** |
998,23 ± 65,92* |
|
Почки |
652,9 ± 39,92 |
734,51 ± 37,27 |
697,49 ± 29,76 |
601,91 ± 26,81 ** |
583,64 ± 41,05 |
Примечание: * – различия статистически значимы по сравнению со здоровыми животными (p < 0,05); ** – различия статистически значимы по сравнению с контролем (p < 0,05).
Таблица 2
Удельная активность каталазы (усл.ед./мг белка) в органах крыс с ожогом под влиянием динитрозильных комплексов железа
|
Органы |
интактные крысы (n = 15) |
КТТ, 3 сутки (n = 8) |
КТТ, 10 сутки (n = 7) |
КТТ + ДНКЖ, 3 сутки (n = 8) |
КТТ + ДНКЖ, 10 сутки (n = 7) |
|
Легкие |
27,60 ± 2,42 |
6,35 ± 0,51 * |
22,56 ± 0,89 * |
17,08 ± 1,20 */** |
8,43 ± 0,27 */** |
|
Почки |
40,57 ± 6,21 |
11,18 ± 0,53 * |
15,74 ± 1,07 * |
9,34 ± 0,36 */** |
8,19 ± 0,41 */** |
Примечание: * – различия статистически значимы по сравнению со здоровыми животными (p < 0,05); ** – различия статистически значимы по сравнению с контролем (p < 0,05).
Полученные результаты показали, что при введении крысам с ожогом ДНКЖ активность СОД и каталазы в легких оставалась статистически значимо ниже показателей здоровых животных. Однако выявлено увеличение активности каталазы на 3 сутки после травмы при введении ДНКЖ в 2,8 раза (p = 0,003) по сравнению с контролем. Отмечена тенденция к повышению удельной активности СОД на 11 % (p = 0,087) на 10 сутки после КТТ в легких под влиянием ДНКЖ по сравнению с контрольной группой крыс, способствуя снижению высокореактивного супероксида, который влияет на образование S-нитрозогемоглобина и стимулирует высвобождение NO из S-нитрозоальбумина [8].
Ожоговая травма является тяжелой формой патологии, которая сопровождается формированием синдрома системного воспалительного ответа, пагубным образом влияющего на состояние внутренних органов и вносящего свой вклад в развитие полиорганной недостаточности [3]. Показано, что показатель светосуммы и уровень МДА в почках увеличились на 3 сутки после ожога на 67 % (р = 0,014) и 21 % (р = 0,034) соответственно по сравнению с интактными крысами (рис. 1, 2).
ДНКЖ способствовали снижению процессов липопероксидации в почках на 3 сутки после КТТ по сравнению с контрольными животными на 34 % (р = 0,027) (рис. 1). Уровень МДА и ПОЛ уменьшились на 10 сутки после травмы под влиянием ДНКЖ на 33 % (р = 0,021) и 15 % (р = 0,039) соответственно по сравнению с контролем.
В динамике АОА в гомогенате почек крыс наблюдалось ее снижение: на 3 сутки после КТТ – на 35 % (р = 0,021), на 10 сутки – на 17,7 % (р = 0,035) относительно здоровых животных, что свидетельствует об угнетении антиоксидантной системы защиты (рис. 3). При введении ДНКЖ на 3 сутки происходило повышение АОА на 41,3 % (р = 0,026) относительно контроля, однако на 10 сутки исследуемый показатель оказался ниже показателя здоровых и контрольных крыс на 32,5 % (р = 0,009) и 18,1 % (р = 0,021) соответственно.
В результате проведенных исследований выявлено снижение активности каталазы в почках на 3 сутки в 3,6 раза (р = 0,007), на 10 сутки после травмы в 2,5 раза (р = 0,009) по сравнению со здоровыми животными. Введение ДНКЖ способствовало статистически значимому падению активности каталазы при КТТ и по сравнению с интактными животными, и по сравнению с контролем (табл. 2). При этом в почках не обнаружено статистически значимых изменений активности СОД при КТТ (табл. 1).
Таким образом, проведенные исследования показали, что термическая травма вызывает интенсификацию свободнорадикального окисления на фоне снижения антиоксидантных резервов в легких и почках. В почках и легких крыс с КТТ выявлено усиление ПОЛ, накопление МДА, на фоне угнетения антиоксидантной системы: отмечено уменьшение каталитических свойств каталазы, выявлено снижение удельной активности СОД на 10 сутки после травмы в легких. Установлено, что ДНКЖ оказывают нормализующее влияние на процессы липопероксидации в легких крыс при КТТ. Показано снижение ПОЛ в почках при КТТ под влиянием ДНКЖ. Под воздействием депонированной формы наблюдалось повышение удельной активности СОД и каталазы на 10 сутки после травмы в легких крыс. Поскольку ДНКЖ являются донорами оксида азота можно предположить, что NO действует в исследуемых органах как антиоксидант, перехватывая алкоксильные и алкилпероксильные радикалы, в результате чего обрываются цепные реакции ПОЛ [10]. Кроме того, одним из механизмов антиоксидантного действия NO, возможно, является связывание свободных ионов железа в составе нитрозильных комплексов. При этом ингибируются реакции свободно-радикального окисления, катализируемые редокс-активными ионами железа [8]. Оксид азота может защищать биологические молекулы от окислительной модификации, нитрозилируя и восстанавливая оксоферрилформы гемопротеидов, к которым относится каталаза.

