Сальмонеллез телят наносит значительный экономический ущерб, так как является основной причиной гибели молодняка в послеотъемный период. Вакцинация телят позволит снизить заболеваемость сальмонеллезом. Разработка вакцины против сальмонеллеза телят на основе коллекционного аттенуированного штамма Salmonella dublin 15S является актуальной задачей.
Основным средством борьбы с инфекцией является специфическая профилактика противосальмонеллезными вакцинами. Наиболее эффективны живые вакцины, приготовленные из аттенуированных сальмонеллезных штаммов. Основоположником создания живых вакцин является Пастер. Известно, что в процессе хранения производственные штаммы сальмонелл могут утрачивать биологические свойства. Весьма актуальным остается вопрос сохранения стабильности биологических свойств аттенуированных вакцинных штаммов микроорганизмов [4]. При хранении сальмонеллезных штаммов решающее значение имеют состав и качество защитной среды, концентрация микробных клеток в ампуле, режим лиофилизации, наличие вакуума, продолжительность и условия хранения.
Вакцинный штамм Salmonella dublin 15 S получен из вирулентной культуры Salmonella dublin, выделенной из костного мозга павшего от сальмонеллеза теленка в одном их животноводческих хозяйств Алматинской области путем ступенчатого отбора колоний сальмонелл, выращенных на средах с добавлением возрастающих концентрации неомицина и стрептомицина. Аттенуированный штамм сальмонелл Salmonella dublin 15 S по вирулентности в 20 раз ниже природного прототипа, имеет две хромосомные метки, обеспечивающие устойчивость к неомицину и стрептомицину. Вакцинный штамм S. dublin 15 S растет на средах с добавлением неомицина и стрептомицина, тогда как вирулентные эпизоотические штаммы S. dublin не растут на средах с антибиотиками. Вакцинный штамм депонирован в Республиканской коллекции микроорганизмов (РГП на ПХВ «НРЦВ» КВКН МСХ РК г. Астана).
Штамм Salmonella dublin 15 S используется для изготовления сухой живой вакцины против сальмонеллеза телят. Живая вакцина против сальмонеллеза телят представляет лиофилизированную культуру, выращенную на плотной или жидкой питательной среде (агаре или бульоне Хоттингера, в реакторе). Аттенуированный штамм обладает низкой остаточной вирулентностью, безвредностью и высокой иммуногенной активностью. Вакцина создает напряженный иммунитет у телят, защищает их от сальмонеллезной инфекции в течение 12 месяцев. Качество вакцины определяется биологическими свойствами вакцинного штамма, используемого для изготовления вакцины. Аттенуированные штаммы микроорганизмов с заданными свойствами являются основой при производстве вакцин и определяют их иммуногенную активность. В связи с этим проблеме поддержания жизнеспособности микроорганизмов уделяется особое внимание. Одной из важнейших задач является сохранение не только жизнеспособности микроорганизма, но и его биологических свойств в стабильном первоначальном состоянии, недопущении изменчивости, реверсии, изменений в геноме аттенуированного штамма микроорганизма [5]. Проведение генетического анализа вакцинного штамма позволит накопить более детальную информацию о его генетической структуре, что послужит основой для получения высокоэффективной вакцины. Стабильность исходных генетических свойств вакцинного штамма определяет качество биопрепарата. Важность проведения исследований генома вакцинного штамма неоспорима и при дифференциации вакцинного штамма от патогенных эпизоотических культур сальмонелл, выделенных из эпизоотических очагов инфекций. Информация о вакцинном штамме сальмонелл, полученная генетическими методами, обеспечит изготовление на основе аттенуированного штамма эффективной иммуногенной вакцины для специфической профилактики сальмонеллеза телят. Аттенуированный вакцинный штамм не должен иметь способности к реверсии. Вакцинный штамм должен обладать типичными культуральными, биохимическими и антигенными свойствами. Вакцина, изготовленная на его основе, должна быть безвредной и формировать у телят длительный напряженный иммунитет.
Цель исследований – изучение биологических свойств и генетической структуры вакцинного штамма сальмонелл, используемого для изготовления вакцины против сальмонеллеза телят.
Материалы и методы исследований
При выполнении работы использовались бактериологические, серологические, биохимические, генетические методы исследований. Культурально- морфологические свойства сальмонелл изучают путем посева на МПБ, МПА, плотные дифференциально-диагностические среды. Проводят микроскопию мазков, приготовленных из суточных агаровых культур, окрашенных по Граму и простым способом. Биохимические свойства изучают при посеве сальмонелл на среды Гисса с углеводами. Подвижность определяют по росту на полужидком агаре [6]. Для выявления протеолитической способности испытуемые штаммы засевают на МПЖ [7]. Посев проводят уколом в застывший столбик МПЖ. После инкубирования при 37 °С в термостате для учета реакции пробирки охлаждают до 20 °С. В пробирках, где под действием ферментов сальмонелл проиcходит протеолиз желатина, среда разжижается. Для определения сероводорода используют полоску фильтровальной бумаги, смоченную раствором уксуснокислого свинца, индола – смоченную насыщенным раствором щавелевой кислоты. Культуры засевают в 2 % пептонную воду, пропитанные реактивами полоски фильтровальной бумаги помещают в пробирку, удерживая ватной пробкой. Через 1-3 дня при наличии сероводорода нижняя часть бумажки окрашивается в черный цвет, а при наличии индола – в розовый. Для определения каталазы на поверхность суточной агаровой культуры наносят 1 %-ный раствор перекиси водорода. При наличии каталазы отмечается выделение пузырьков отщепленного кислорода. Анализ полученных нуклеотидных последовательностей вакцинного штамма проводят в реакции секвенирования продуктов ПЦР с использованием пакета программ (SeqMan) и международных баз данных нуклеотидных последовательностей (Blast, Classifier, GeneBank и др.) [8]. Генетическую идентификацию штамма Salmonella dublin 15 S осуществляют методом определения прямой нуклеотидной последовательности фрагмента 16S rRNA гена с последующим определением нуклеотидной идентичности с последовательностями, депонированными в международной базе данных Gene Bank, а также построением филогенетического древа в сравнении с нуклеотидными последовательностями референтных штаммов.
ДНК выделяют колоночным методом с помощью набора «PureLink Genomic DNA Kits» (Invitrogen) согласно инструкции по применению [9]. Для выделения ДНК используют 2х109 взвесь клеток бактерий суточной агаровой культуры. С целью лизирования сальмонелл к осадку клеток добавляют 180 мкл Digestion Buffer. После чего добавляют 20 мкл протеиназы К. Затем инкубируют пробирку 30 минут при 55 °С при периодических встряхиваниях. Для удаления фрагментов клеточной стенки, остаточных белков и полисахаридов добавляют 500 мкл Wash Buffer 1. Заключительную очистку выполняют Wash Buffer 2. С этой целью добавляют 500 мкл указанного буфера в колонку, центрифугируют при 14000 об/мин в течение 3 минут, удаляют жидкость с пробирки для сбора, а очищенный образец ДНК элюируют с мембраны колонки в 200 мкл Elution Buffer и хранят при минус 20 °С. Измеряют концентрацию ДНК спектрофотометрическим методом с использованием Dynamica Halo DNAmaster при длине волны 260 нм.
Определение нуклеотидной последовательности. Очистку ПЦР продуктов от несвязавшихся праймеров проводят ферментативным методом, используя Exonuclease I (Fermentas) и щелочную фосфатазу (Shrimp Alkaline Phosphatase, Fermentas) [10, 11].
Реакцию секвенирования проводят с применением BigDye® Terminator v3.1 Cycle Sequencing Kit (Applide Biosystems) согласно инструкции производителя, с последующим разделением фрагментов на автоматическом генетическом анализаторе 3500 (Applide Biosystems).
Результаты исследования и их обсуждение
Штамм получен из вирулентной культуры, выделенной из костного мозга от павшего от сальмонеллеза теленка, под влиянием химического мутагена – антибиотиков с последующей селекцией штаммов-мутантов. Штамм Salmonella dublin 15 S утратил патогенные свойства, имеет умеренную остаточную вирулентность, обладает высокой иммуногенностью и безвредностью для лабораторных животных и телят. Вакцинный штамм обладает типичными для Salmonella dublin культуральными, биохимическими и антигенными свойствами. Существенным отличием штамма 15 S от вирулентного прототипа является ауксотрофность в отношении тиамина и никотиновой кислоты; вакцинный штамм образует аргинин – декарбоксилазу и слабо-лизин – декарбоксилазу.
Вакцинный аттенуированный штамм сохраняет слабую остаточную вирулентность и не реверсирует при пассировании на восприимчивых животных (белые мыши, куриные эмбрионы). Лиофильно высушенную культуру штамма реактивировали путем посева на МПБ с 1 % глюкозы. Затем из МПБ делали высевы на МПА и плотные дифференциально-диагностические питательные среды. Через 20 часов на МПБ отмечался рост в виде равномерного помутнения с небольшим осадком. На плотных средах формировались слабовыпуклые, мелкие прозрачные колонии с ровными краями и блестящей поверхностью в S-форме. На чашках Петри со средой Эндо блестящие гладкие блестящие колонии окрашивались в светло-розовый цвет, на висмут сульфитном агаре росли мелкие черные колонии с металлическим блеском, на среде Клиглера – ярко-желтые блестящие колонии. В мазках, приготовленных из суточных агаровых культур и окрашенных по Граму, наблюдались мелкие грамотрицательные палочки с закругленными концами располагались одиночно, попарно или группами.
Вакцинный штамм обладал культурально-морфологическими и биохимическими свойствами, типичными для сальмонелл: образовывал сероводород, не образовывал индола, не ферментировал лактозу, сахарозу. Бактерии вакцинного штамма обладали высокой ферментативной активностью. С образованием кислоты и газа ферментировали углеводы (глюкозу, мальтозу, маннит. раффинозу и т.д.). Анализ ферментативных свойств Salmonella dublin 15 S показал, что изучаемый штамм по своим биохимическим свойствам идентичен и типичен для рода Salmonella. Отмечалась подвижность культуры.
Штамм агглютинировался в РА на предметном стекле с монорецепторными сыворотками О-I, IХ, VII; H-с (g, p) (первая фаза). Вакцинный штамм относится к серологической группе D. Для контроля вакцинного штамма на отсутствие контаминации посторонней бактериальной и грибковой микрофлорой делали высевы на МПБ, МПА, МППБ под вазелиновым маслом (среда Китт-Тароцци), среду Сабуро. Штамм проверен на отсутствие диссоциации, находится в устойчивой S форме.
Вирулентность вакцинного штамма проверяли в опыте на 3 белых мышах массой 16-18 г. Опытным животным вводили подкожно по 0,2 мл суточной бульонной культуры вакцинного штамма S. dublin 15 S по оптическому стандарту ГИСК им. Л.А. Тарасевича. Учет результатов проводили через 10 суток. Белые мыши оставались живы в течение 10 суток (срок наблюдения), что свидетельствует о слабой остаточной вирулентности штамма и безвредности для белых мышей.
У исследуемого образца S. dublin 15 S при выделении ДНК высокой концентрации с хорошей чистотой (30 ng/ul), значение 260/280 равнялось 1,8.
Амплификация фрагмента 16S rRNA гена. Реакция ПЦР была выполнена универсальными праймерами 8F 5’ – AGAGTTTGATCCTGGCTCAG-3 и 806R- 5’ GGACTACCAGGGTATCTAAT в общем объеме 25 мкл. Мастер-микс содержал 150 нг ДНК, 2.5 х смеси, 10 пмоль каждого праймера. Программа ПЦР амплификации включала денатурацию 94 °С в течение 3 минут; 27 циклов: 94 °С – 30 секунд, 60 °С – 30 секунд, 72 °С – 30 секунд; заключительную элонгацию 7 минут при 72 °С. ПЦР программа была выполнена с применением амплификатора фирмы Eppendorf. У исследуемого образца был амплифицирован специфический фрагмент молекулярной массой около 800 п.н. [13].
Анализ нуклеотидных последовательностей. Нуклеотидная последовательность 16S rRNA гена идентифицируемого штамма была проанализирована в программном обеспечении SeqScape 2.6.0 (Applide Biosystems), после чего были удалены концевые фрагменты (нуклеотидные последовательности праймеров, фрагменты, имеющие низкий показатель качества).
С учетом полученных результатов, были проведены дальнейшие исследования по проверке чистоты представленного штамма, которые были осуществлены на основе анализа ферограммы нуклеотидной последовательности 16S rRNA гена. Было установлено, что у анализируемого штамма отсутствует смешение сигналов, что свидетельствует об отсутствии в предоставленной культуре посторонних видов бактерий. На рис. 1 представлена ферограмма фрагмента нуклеотидной последовательности анализируемого гена S. dublin 15 S.
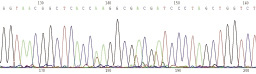
Рис. 1. Ферограмма фрагмента нуклеотидной последовательности гена 16S r RNA
Из ферограммы на рис. 1 видно, что нуклеотидная последовательность гена сальмонелл 16S rRNA не показывала смешения сигналов, что свидетельствует об отсутствии контаминации культуры вакцинного штамма сальмонелл посторонней микрофлоры. Проведенный анализ позволяет сделать выводы об отсутствии перекрестной контаминации культуры вакцинного штамма посторонними бактериями.
Выполнена генетическая идентификация вакцинного штамма S. dublin 15 S на основе анализа нуклеотидной последовательности 16S rRNA. Программным обеспечением SeqMan нуклеотидные последовательности были объединены в общую последовательность, что позволило получить нуклеотидную последовательность каждого штамма протяженностью более 650 п.н., которая была идентифицирована в GeneBank по алгоритму BLAST. Нуклеотидная последовательность и результаты идентификации вакцинного штамма представлены в таблице и на рис. 2.
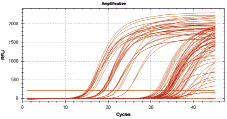
Рис. 2. Молекулярно-биологические характеристики гена 16S rDNA штамма Salmonella dublin 15 S
Из таблицы следует, что данные Международного банка GeneBank показывают высокую степень однородности нуклеотидной последовательности 16S rRNA изучаемого штамма с разновидностями рода Salmonella (99 %). Как показано в таблице 1, установлена высокая степень однородности нуклеотидной последовательности 16S rRNA гена у вакцинного штамма Salmonella dublin 15 S, которая указывает на его родовую принадлежность.
Результаты идентификации гена 16S rRNA S. dublin 15S
|
Наименование штамма |
Последовательность фрагмента 16S r RNA гена |
Идентификация нуклеотидных последовательностей в международной базе данных (http://www.ncbi.nlm.nih.gov/) алгоритм BLAST |
||
|
Инвентар-ный номер GeneBank (Accesion number) или коллекционный номер штамма |
Наименование штамма |
% совпадения |
||
|
14-Salmonella dublin 15 S |
GAGGGGGATACTACTGGAACGGTGGCTAATACCGCATAACGTCGCAAGACCAAAGAGGGGGACCTTCGGGCCTCTTGCCATCAGATGTGCCCAGATGGGATTAGCTTGTTGGTGAGGTAACGGCTCACCAAGGCGACGATCCCTAGCTGGTCTGAGAGGATGACCAGCCACACTGGAACTGAGACACGGTCCAGACTCCTACGGGAGGCAGCAGTGGGGAATATTGCACAATGGGCGCAAGCCTGATGCAGCCATGCCGCGTGTATGAAGAAGGCCTTCGGGTTGTAAAGTACTTTCAGCGGGGAGGAAGGTGTTGTGGTTAATAACCACAGCAATTGACGTTACCCGCAGAAGAAGCACCGGCTAACTCCGTGCCAGCAGCCGCGGTAATACGGAGGGTGCAAGCGTTAATCGGAATTACTGGGCGTAAAGCGCACGCAGGCGGTCTGTCAAGTCGGATGTGAAATCCCCGGGCTCAACTGGGAACTGCATTCGAAACTGGCAGGCTTGAGTCTTGTAGAGGGGGGTGGAATTCCAGGTGTAGCGGTGAAATGCGTAGAGATCTGGAGGAATACCGGTGGCGAAGGCGGCCCCCTGGACAAAGACTGACGCTCAGGTGCGAAAGCGTGGGGAGCAAACAGGATTAGATACCCTGGTAGTCCACGCCGTAACGATGTCTACTTGGAGGTTGTGCCCTTGAGGCGTgGCTTCCGGAGCTAACGCGTTAAGTAGACCGCCTGGGGAGTACGGCCGCAAGGTTAAAACTCAAATGAATTGACGGGGGCCCGCACAAGCGGTGGAGCATGTGGTTTAATTCGATGCAACGCGAAGAACCTTACCTGGTCTTGACATCCACGGAAGTTTTCAGAGATGAGAATGTGCCTTCGGGAACCGTGAGACAGGTGCTGCATGGCTGTCGTCAGCTCGTGTTGTGAAATGTTGGGTTAAGTCCCGCAACGAGCGCAACCCTTATCCTTTGTTGCCAGCGATTAGGTCGGGAACTCAAAGGAGACTGCCAGTGATAAACTGGAGGAAGGTGGGGATGACGTCAAGTCATCATGGCCCTTACGACCAGGGCTACACACGTGCTACAATGGCGCATACAAAGAGAAGCGAGCTCGCGAGAGCAAGCGGACCTCATAAAGTGCGTCG |
NR_074800.1 |
Salmonella enterica subsp. enterica serovar Choleraesuis str. SC-B67 strain |
99 % |
|
NR_074899.1 |
Salmonella enterica subsp. enterica serovar Paratyphi C strain RKS4594 |
99 % |
||
|
NR_074935.1 |
Salmonella enterica subsp. enterica serovar Paratyphi A str. AKU_12601 strain AKU12601 |
99 % |
||
Интерпретация результатов программным обеспечением MicroSeq подтвердило родовую принадлежность штамма к роду Salmonella.
Изучены молекулярно-биологические свойства гена 16S rDNA вакцинного штамма, результаты представлены на рис. 2.
Из рис. 2 видно, что результаты ПЦР в режиме реального времени указывают на видовую принадлежность Salmonella dublin.
На рис. 3 изображена электрофореграмма гена 16S r DNA штамма Salmonella dublin15 S.

Рис. 3. Электрофореграмма гена 16S r DNA штамма Salmonella dublin15 S
Из рис. 3 следует, что изучаемая культура относится к Salmonella dublin.
Результаты генотипирования Salmonella dublin 15 S совпадали с результатами, интерпретированными с помощью международной базы данных. Также была подтверждена родовая принадлежность штамма. Установлено, что вакцинный штамм не контаминирован посторонней микрофлорой.
Заключение
В результате проведенных исследований установлено, что вакцинный штамм Salmonella dublin 15 S сохранил культурально-морфологические, биохимические, серологические и генетические свойства после хранения (в условиях холодильника – + 4 °С) в соответствии с паспортными данными и может использоваться при изготовлении эффективной вакцины против сальмонеллеза телят. Высокая идентичность нуклеотидной последовательности 16S rRNA гена вакцинного штамма позволяет использовать его в качестве матрикса при изготовлении биопрепарата.

