В производстве энергонасыщенных веществ, процессах алкилирования, концентрирования азотной кислоты с помощью серной кислоты абсолютный расход серной кислоты сравнительно невелик, но большое количество ее выводят из цикла в виде отработанной серной кислоты (ОСК). Одним из путей утилизации такой ОСК является денитрация и концентрирование с целью повторного использования в основном производстве. Использование ОСК позволяет наряду с частичным обеспечением потребности промышленности в серной кислоте и сокращением единовременных и текущих затрат на развитие сернокислотного производства решать актуальные социально-экономические задачи предотвращения вредных выбросов в окружающую среду. Кроме того, перспективами развития химической промышленности намечен ускоренный рост производства серной кислоты высокого качества, удовлетворяющий мировым требованиям. Глубокая денитрация, обеспечивающая повышение сортности кислоты и требуемой степени очистки ОСК, возможно при добавке различных денитрирующих агентов, восстанавливающих соединения азота. Оксид азота (III) может восстанавливаться с выделением таких продуктов как элементного азота, оксидов азота (I) и (II), азотистой кислоты. При использовании углеродсодержащих добавок в газовую фазу могут выделиться оксиды углерода (II) и (IV). Термодинамический анализ взаимодействия оксида азота (III) (или азотистой кислоты) и исследования состава газовой фазы [3, 5] показали, что все испытанные денитрирующие агенты можно разбить на две группы: одни преимущественно восстанавливают соединения азота до элементного азота, а другие – преимущественно до оксида азота (II).
Цель исследования
Целью работы явилось исследование термодинамического анализа взаимодействия оксида азота (III) с денитрирующими агентами, дефиксирующими связанный азот при температурах 298 и 403 К и денитрации нитрозы, содержащей оксиды азота (III) с массовой долей серной кислоты 70 %, с испытанными денитрирующими агентами.
Материалы и методы исследования
Для исследования нитрозы готовили путем растворения кристаллов нитрозилсерной кислоты в серной кислоте с массовой долей исходной серной кислоты 70 %. Методика проведения экспериментов и обработки полученных данных описаны ранее [1, 2, 4, 6].
Результаты исследования и их обсуждение
Выполнен термодинамический анализ взаимодействия оксида азота (III) (азотистой кислоты) с восстановителями (табл. 1).
Таблица 1
Значение энергии Гиббса при взаимодействии оксида азота (III) (азотистой кислоты) с восстановителями
|
Восстановитель |
– ΔGот , кДж/моль N2O3 , (HNO2). |
|||||
|
N2, CO2 |
N2O, CO2 |
NO, CO2 |
N2, CO |
N2O, CO |
NO, CO |
|
|
Температура 298 К |
||||||
|
Гидроксиламин |
2174 (1080) |
610 (298) |
134 (61) |
– |
– |
– |
|
Муравьиная кислота |
949 (467) |
576 (281) |
249 (112) |
– |
– |
– |
|
Щавелевая кислота |
1141 (565) |
703 (345) |
313 (144) |
– |
– |
– |
|
Глюкоза |
861 (424) |
517 (251) |
207 (97) |
809 (398) |
482 (244) |
413 (88) |
|
Карбамид |
813 (400) |
321 (153) |
50 (26) |
763 (375) |
727 (115) |
43 (14) |
|
Сульфит аммония |
745 (366) |
286 (136) |
53 (20) |
– |
– |
– |
|
Сульфат аммония |
694 (312) |
235 (110) |
47 (9) |
– |
– |
– |
|
Температура 403 К |
||||||
|
Гидроксиламин |
2088 (1057) |
594 (309) |
158 (92) |
– |
– |
– |
|
Муравьиная кислота |
1168 (597) |
760 (393) |
706 (175) |
– |
– |
– |
|
Щавелевая кислота |
2923 (1474) |
1961 (961) |
919 (460) |
– |
– |
– |
|
Глюкоза |
632 (329) |
370 (198) |
132 (79) |
424 (225) |
231 (128) |
62 (44) |
|
Карбамид |
773 (391) |
301 (164) |
85 (55) |
713 (396) |
232 (128) |
50 (38) |
|
Сульфит аммония |
699 (362) |
273 (149) |
74 (50) |
– |
– |
– |
|
Сульфат аммония |
570 (298) |
208 (117) |
48 (201) |
– |
– |
– |
Изучена денитрация серной кислоты с массовой долей серной кислоты 70 %, содержащей 0,03 % N2O3, с добавками вышеприведенных восстановителей с одновременной продувкой кислоты воздухом. Нормы восстановителей принимали по стехиометрии из расчета восстановления N2O3 до NO. Наиболее высокой денитрирующей активностью среди изученных добавок обладает гидроксиламин. Так, при 373 К и времени продувки 10 минут достигнута степень денитрации более 99 % (остаточное содержание N2O3 менее 0,0003 %). Продувка воздухом без денитрирующих добавок при аналогичных условиях и времени 2 часа и температуре 443 К позволяет удалять не более 55 % N2O3 (рис. 1). Несколько меньшей активностью обладает карбамид и глюкоза (рис. 2 и 3).
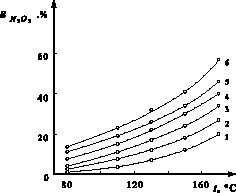
Рис. 1. Ход изменения степени отдувки оксида азота (III) (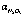 , %) воздухом от температуры (t) при продолжительности: 1 – 20; 2 – 40; 3 – 60; 4 – 80; 5 – 100; 6 – 120 минут
, %) воздухом от температуры (t) при продолжительности: 1 – 20; 2 – 40; 3 – 60; 4 – 80; 5 – 100; 6 – 120 минут
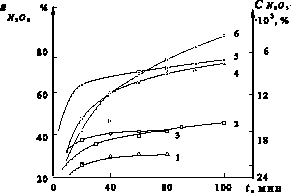
Рис. 2. Зависимость степени денитрации по оксиду азота (III) (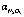 , %) и остаточной концентрации (
, %) и остаточной концентрации (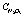 , % ) от времени при введении стехиометрической нормы восстановителя: 1 – щавелевая кислота; 2 – сульфат аммония; 3 – сульфит аммония; 4 – глюкоза; 5 – карбамид; 6 – муравьиная кислота
, % ) от времени при введении стехиометрической нормы восстановителя: 1 – щавелевая кислота; 2 – сульфат аммония; 3 – сульфит аммония; 4 – глюкоза; 5 – карбамид; 6 – муравьиная кислота
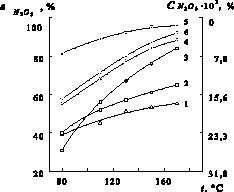
Рис. 3. Влияние температуры (t) на степень денитрации (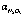 , %) и остаточную концентрацию (
, %) и остаточную концентрацию (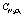 ) при 40 минутах с восстановителями: 1 – щавелевая кислота; 2 – сульфат аммония; 3 – сульфит аммония; 4 – глюкоза; 5 – карбамид; 6 – муравьиная кислота
) при 40 минутах с восстановителями: 1 – щавелевая кислота; 2 – сульфат аммония; 3 – сульфит аммония; 4 – глюкоза; 5 – карбамид; 6 – муравьиная кислота
Воздух, подаваемый на продувку кислоты, способствует как ускорению процесса денитрации, удаляя продукты реакции, так и замедляет процесс вследствие концентрирования серной кислоты. Несколько меньшей активностью обладают карбамид и глюкоза. Обработка кислоты этими восстановителями при 403 К и продолжительности продувки воздухом более 60 мин не позволила достичь степени денитрации выше 65 %. Влияние температуры на степень удаления оксида азота (III) карбамидом незначительно. Так, повышение температуры с 353 до 443 К при сорокаминутной продувке воздухом привело к возрастанию степени денитрации меньше, чем на 6 % (с 66,4 до 72,0 %). При этих же условиях при очистке глюкозой степень денитрации возрастает с 36 % до 70 %.
Остальные восстановители (сульфат и сульфит аммония, щавелевая кислота) денитрируют серную кислоту при 403 К и времени обработки 80 мин менее, чем на 40 %. Повышение температуры на 40 градусов только в случае использования сульфата аммония привело к увеличению степени денитрации до 63,7 % (остаточное содержание 0,011 % N2O3).
Одним из основных факторов, влияющих на степень очистки кислоты, является количество введенного восстановителя (рис. 4). Двукратная стехиометрическая норма CO(NH2)2 при 423 К и времени продувки 40 мин позволила практически полностью удалить оксид азота (III) из кислоты. Введение двойной нормы глюкозы при 443 К привело к достижению степени денитрации (при продувке кислоты в течение 40 мин) 97,4 % (остаточное содержание N2O3 – 0,0008 %).
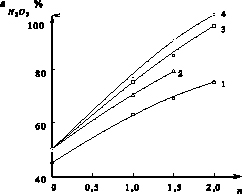
Рис. 4. Влияние расхода восстановителя (n) на степень денитрации оксида азота (III) (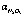 , %) при времени 40 минут: 1 – сульфат аммония, 443 К; 2 – муравьиная кислота, 443 К; 3 – глюкоза, 443 К; 4 – карбамид, 423 К
, %) при времени 40 минут: 1 – сульфат аммония, 443 К; 2 – муравьиная кислота, 443 К; 3 – глюкоза, 443 К; 4 – карбамид, 423 К
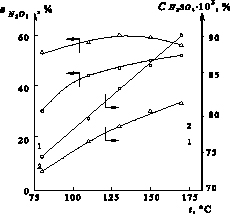
Рис. 5. Влияние температуры (t) на упаривание серной кислоты (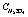 , %) и степень денитрации (
, %) и степень денитрации (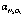 , %) при очистке стехиометрической нормой сульфата аммония и времени 2ч при свободном сечении тарелки: 1 – 5 %; 2 – 10 %
, %) при очистке стехиометрической нормой сульфата аммония и времени 2ч при свободном сечении тарелки: 1 – 5 %; 2 – 10 %
Использование для продувки нитрозной серной кислоты холодного воздуха (293 К) при температуре кислоты 403 К привело к повышению степени денитрации. Например, при продувке горячим воздухом (403 К) в течение 20 мин и восстановлении N2O3 стехиометрической нормой сульфата аммония степень денитрации равна 28,1 %, тогда как при продувке холодным воздухом – 68,0 %. При введении стехиометрической нормы карбамида в кислоту при 403 К и продувке кислоты холодным воздухом в течение 20 мин степень денитрации составила 79,4 % против 63,8 %, достигаемых при продувке горячим воздухом. Следовательно, преобладающее влияние на денитрацию нитрозной серной кислоты оказывает концентрирование серной кислоты, что также подтвердили опыты по денитрации серной кислоты сульфатом аммония на колонках с разным свободным сечением (рис. 5). Степень денитрации в колонке, свободное сечение которой равно 10 %, на 5-18 % выше, чем на колонке со свободным сечением тарелки 5 %, где серная кислота закрепляется более интенсивно.
Таким образом, снижение содержания оксида азота (III) в серной кислоте менее 0,0008 % может быть получено при использовании стехиометрической нормы сульфата гидроксиламина, проведении процесса при 373 К и продолжительности продувки воздухом 10 мин, либо введением двойной нормы карбамида и денитрации при 423 К и 20 мин, либо глюкозы при 443 К и 60 мин. Глубокую денитрацию кислоты, содержащей 0,03 % N2O3, восстановителями с одновременной продувкой воздухом целесообразно проводить в условиях, исключающих значительное концентрирование серной кислоты. Продувку кислоты можно осуществлять воздухом без предварительного подогрева.
При разработке технологической схемы с использованием денитрирующих агентов, дефиксирующих связанный азот, восстановители этой группы вводят в коллектор денитрированной кислоты, либо в днище колонны денитрации. При этом выделяющиеся газы не требуют аспирации, поскольку в них преимущественно содержится элементный азот.
Таким образом, выполненные исследования позволили оценить возможности денитрирующих агентов и сформулировать основные теоретические положения, необходимые для дальнейших исследований процессов глубокой денитрации ОСК и разработки технологических процессов с учетом экологических требований.
Выводы
1. Выполнен термодинамический анализ взаимодействия оксида азота (III) (азотистой кислоты) с гидроксиламином, муравьиной и щавелевой кислотами, глюкозой, карбамидом, сульфитом и сульфатом аммония.
2. Проведено экспериментальное исследование процесса денитрации серной кислоты с массовой долей исходной серной кислоты 70 %, содержащей 0,03 % N2O3.
3. Полученные данные будут использованы для расчета процесса денитрации и оборудования при разработке технологической схемы денитрации отработанной серной кислоты.

