Современная техника базируется на широком использовании разнообразной аппаратуры, которая в большинстве своем является физической по конструкции и химической по принципу действия. Применяемые в медицине и электрохимии хлорсеребряные электроды работают в условиях воздействия окружающей среды. Чтобы оценить возможность эксплуатации подобных изделий в реальных условиях, необходимо иметь сведения о химических свойствах материалов, из которых они изготовлены. Галогениды серебра обладают высокой диэлектрической проницаемостью. Электропроводность галогенидов сильно зависит от условий изготовления кристаллов, его биографии.
Материалы и методы исследования
Скорость разрушения серебра при электролизе переменным асимметричным током определяли гравиметрическим методом. Опыты проводили в водных растворах хлоридов, бромидов, приготовленных из солей марки «ХЧ». Скорость разрушения определяли по разности веса электрода до опыта и после опыта. Хлорид серебра, образующийся при электролизе, растворяли в тиосульфате натрия. Каждый опыт проводили не менее 3 раз. Электроды изготавливали из серебряной фольги (Аg 99,99 %) размером 10х5х0,2 мм. Противоэлектродами служили две никелевые пластины площадью 20 см2 каждая. Расстояние между исследуемым электродом и противоэлектродами составляло 15 мм.
Обработка электродов перед опытом заключалась в обезжиривании щелочью, промывке дистиллированной водой, спиртом и сушке до постоянного веса. Электроды помещали в тефлоновый держатель. Электролизер представлял собой стеклянный стакан диаметром 60 и высотой 80 мм, емкостью 250 мл. Крышка электролизера была изготовлена из тефлона, имела отверстия для электродов, мешалки, термометра.
В опытах по окислению использовали периодический переменный асимметричный ток промышленной частоты 50 Гц с равной длительностью анодного и катодного импульсов, имеющий в каждый полупериод форму полусинусоид с разной амплитудой. Такой ток получали при помощи двух диодов, включенных навстречу друг другу в параллельных цепях с независимо регулируемыми сопротивлениями.
Результаты исследования и их обсуждение
При электролизе переменным асимметричным током при условии, когда амплитуда анодного импульса (I+) больше амплитуды катодного (I–), в растворе хлорида лития на серебряном электроде происходит рост пористых прочных слоев хлорида серебра с выходом по току в расчёте на среднее значение 100 % [1–2].
В работе представлены экспериментальные данные влияния плотности тока и соотношения катодного и анодного импульсов при электролизе переменным асимметричным током на окисление серебра в растворах галогенидов с целью получения слоев галогенидов серебра, прочно удерживающихся на поверхности металла. Изучали влияние природы катиона в растворах хлоридов, времени электролиза, соотношения средней плотности тока в анодный и катодный полупериоды, температуры и рН раствора.
Скорость разрушения серебра при поляризации переменным асимметричным током в растворе хлорида лития остается постоянной во времени (рис. 1).
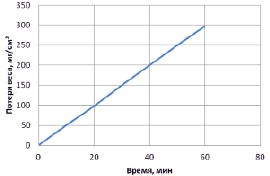
Рис. 1. Потеря веса серебряных электродов в зависимости от времени электролиза в 2н растворе хлорида лития. Анодная плотность тока 0,1 А/см2, катодная 0,02 А/см2 (средние значения)
В табл. 1 представлены экспериментальные данные влияния природы катиона на скорость окисления серебра в растворах хлоридов при соотношении плотностей тока в анодный и катодный полупериоды соответственно 0,1:0,02 А/см2 (средние значения).
Таблица 1
Скорость разрушения серебра в 2н растворах хлоридов и хлороводородной кислоты
|
Электролит |
LiCl |
KCl |
NaCl |
SrCl2 |
AlCl3 |
NH4Cl |
BaCl2 |
HCl |
|
Скорость разрушения, мг/(см2•час) |
302 |
303 |
303 |
300 |
306 |
306 |
304 |
305 |
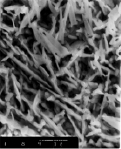
От природы катиона зависит прочность сцепления хлорида серебра с основой. Наиболее прочные слои удалось получить в растворе хлорида лития. Влияние катиона сказывается и на качестве осадков хлорида серебра. В растворе хлорида лития образуются прочные слои AgCl, кристаллы которого имеют сферическую форму и хорошую адгезию с подложкой металла, в растворах хлорида калия образуются игольчатые кристаллы (рис. 2).

а) б)
Рис. 2. Микроскопия поверхности хлорсеребряного электрода в стационарном режиме. Увеличение 3000 раз: а) в растворе LiCl, б) в растворе КСl
Представляет интерес исследовать соотношение катодного и анодного импульсов на скорость окисления серебра в растворах галогенидов (рис. 3).
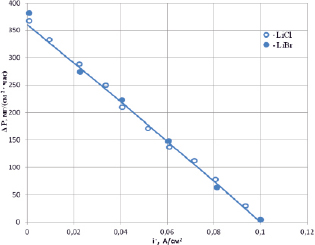
Рис. 3. Скорость разрушения серебра в 2М растворах хлорида и бромида лития в зависимости от величины катодного импульса. Анодная плотность тока 0,1 А/см2
Как видно из рис. 3, скорость окисления уменьшается линейно при увеличении величины катодного импульса. Она целиком определяется разностью между прошедшим анодным и катодным зарядами.
С изменением катодного импульса при окислении в хлориде лития изменяется цвет полученного хлорида серебра. При увеличении катодного импульса осадок изменяется от светло-коричневого до темно-бурого. В растворе бромида лития была отмечена хорошая устойчивость процесса окисления на всех режимах, однако образующийся бромид серебра имеет плохую адгезию с основой металла.
Галогенид-ионы являются активаторами при окислении металлов. В работах [3–8] отмечается, что хлорид-ионы оказывают существенное влияние на анодное поведение серебра. Присутствие анионов-активаторов в щелочном растворе облегчает анодное окисление Ag в активном состоянии за счет образования смешанных гидроксидно-анионных адсорбционных комплексов типа Ag(OH)Aadc или же вследствие полного разрушения гидроксидных комплексов. Доля растворимых продуктов окисления серебра увеличивается при этом до 30 % – в щелочно-хлоридном, и до 45 % – в щелочно-сульфатном растворах. Показано, что условия локальной активации Ag и возникновения питтингов состоят не только в создании определенного соотношения концентраций анионов-активаторов и гидроксид-ионов, определенного значения электродного потенциала, но также в наличии гидроксидной пассивности, образовании слоя оксида и подкислении раствора в порах питтинга. Локальная активация серебра наблюдается только в щелочно-сульфатных и щелочно-нитратных средах. Увеличение концентрации дефектов структуры поверхности Ag-электрода способствует более глубокой пассивации и увеличению потенциала локальной активации.
Представляет интерес изучить влияние концентрации и рН растворов хлоридов на скорость окисления серебра.
В табл. 2, 3, 4 представлены экспериментальные данные зависимости скорости коррозии серебра от концентрации, температуры и рН раствора хлорида лития.
Таблица 2
Скорость разрушения серебра в растворах хлорида лития в зависимости от концентрации хлорида лития. Температура 25 °С
|
Концентрация хлорида лития, моль/л |
0,5 |
2,0 |
4,0 |
6,0 |
8,0 |
10,0 |
12 |
|
Скорость разрушения, мг/(см2•час) |
307 |
304 |
301 |
296 |
305 |
317 |
320 |
Таблица 3
Скорость разрушения серебра в 2н растворах хлорида лития в зависимости от температуры
|
Температура электролита, °С |
20 |
30 |
35 |
40 |
45 |
50 |
|
Скорость разрушения, мг/(см2•час ) |
300 |
297 |
303 |
303 |
298 |
306 |
Таблица 4
Скорость разрушения серебра в растворах хлорида лития в зависимости от рН раствора
|
рН электролита |
1,1 |
3,85 |
7,25 |
12,0 |
|
Скорость разрушения, мг/(см2•час) |
317 |
317 |
306 |
310 |
Установлено, что скорость образования хлорида серебра не зависит от природы катиона, концентрации, температуры, рН электролита. Она целиком определяется разностью между прошедшими анодным и катодным зарядами. При концентрации хлорида лития 12 М скорость окисления повышается и выход по току составляет 100 %. Однако образующийся при этом осадок заметно растворяется в электролите. Оптимальными режимами окисления серебра являются: 1,5–2,0 моль/л раствор хлорида лития, температура 20–80 °С, соотношение анодного и катодного импульсов соответственно 0,1:0,08 А/см2 (средние значения). Скорость разрушения серебра остается постоянной во времени, с выходом по току близкой к 100 %.
Изменение поверхности при окисление серебра в процессе формирования пористого слоя хлорида серебра показано на рис. 4.
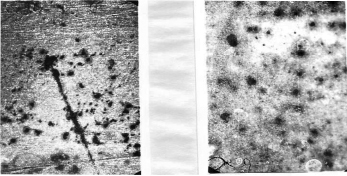
Рис. 4. Микроскопия серебряного электрода в первоначальный момент окисления. Увеличение в 200 раз
Первоначально хлорид серебра появляется по местам дефектов, царапин. Наблюдается так называемое питтинговое окисление. Затем этот процесс распространяется по всей поверхности электрода.
Определена пористость полученного хлорида серебра. Она составляет порядка 45–50 %.
Заключение
Скорость разрушения серебра при электролизе переменным асимметричным током в растворах галогенидов остается постоянной во времени. Она линейно зависит от величины плотности анодного тока. Скорость окисления линейно уменьшается при возрастании величины катодного импульса при постоянной величине анодного.

