Одним из наиболее распространенных загрязнителей, присутствующих в природной воде, особенно в воде подземных источников, является железо. Наличие железа в воде, в отличие от большинства других загрязнителей, легко определяется даже на бытовом уровне по окраске воды, появлению взвеси и осадка после отстаивания, образованию трудноудаляемых подтеков на сантехническом оборудовании, окрашиванию белья при стирке. Поскольку железо относится к токсичным тяжелым металлам, то согласно принятым санитарным нормам СанПиН 2.1.4.1074-01, его содержание в питьевой воде не должно превышать 0,3 мг/л. Требования многих производств (пищевые, энергетика, электроника) значительно жестче. Поэтому обезжелезивание природных подземных вод является важной и наиболее распространенной стадией в процессах водоподготовки.
Подход к очистке вод от железа определяется формами его нахождения, концентрацией, характеристикой очищаемой воды (реакция среды, жесткость, щелочность и др.), производительностью и требованиями производства. Методы обезжелезивания включают целый ряд физико-химических процессов и сводятся, прежде всего, к переводу соединений железа в нерастворимые или слаборастворимые формы с последующим извлечением их из воды. Существуют три группы методов удаления железа из воды: физические (макро-, микро-, ультра- и нанофильтрация, и обратный осмос); химические (окисление различными окисляющими агентами, в том числе в присутствии катализаторов); биологические (окисление двухвалентного железа микроорганизмами).
Наиболее распространенный способ извлечения растворенного железа (II) сочетает в себе химические и физические методы и заключается в их окислении и переводе в нерастворимую форму гидроокисей с последующей фильтрацией. Для окисления используют кислород воздуха, «активный» хлор, озон, перманганат калия. Окисление железа растворенным в воде кислородом воздуха протекает медленно. Высокую эффективность окисления железа в водных растворах обеспечивают соединения хлора. При их применении происходит разрушение гуматов и других комплексных органических соединений железа и переход их в форму неорганических солей, которые легко гидролизуются с выпадением в осадок. Доза хлора, в зависимости от содержания железа, может составлять 5–20 г на 1 м3 воды при времени контакта более 30 минут [1]. Основным недостатком применения хлорсодержащих реагентов в процессах водоподготовки является потенциальная возможность образования хлорорганических соединений, обладающих канцерогенными и мутагенными свойствами [2].
Окисление двухвалентного железа достигается также введением в исходную воду перед фильтрами раствора перманганата калия. При окислении железа доза перманганата калия принимается такой, чтобы после его введения окислительный потенциал среды составил: + 0,35В при рH 6; + 0,14В при рН 7 или + 0,05В при рН 8 [3].
Одним из перспективных методов окисления железа является озонирование, одновременно обеспечивающее обеззараживание, обесцвечивание, дезодорацию воды, улучшение ее органолептических свойств, окисление двухвалентного железа и марганца [1]. При озонировании воды происходит практически полное окисление железа (II) при удельном расходе 0,12 мг/л на окисление 1 мг железа. Использование метода озонирования сдерживается сложностью и высокой стоимостью озонаторного оборудования, образованием побочных продуктов, значительным потреблением электроэнергии. Вместе с тем озонирование применяется для обезжелезивания и деманганации за рубежом, а иногда и на российских водопроводных станциях [4].
Технологии обезжелезивания подземных вод с использованием пероксида водорода представляют значительный интерес, особенно при недостаточной эффективности традиционных методов (при высокой концентрации железа, низкой щелочности и высокой жесткости обрабатываемой воды). Результаты лабораторных исследований и пилотных испытаний в условиях действующего водозабора подтвердили высокую эффективность применения пероксида водорода и были использованы при реконструкции ВОС г. Новый Уренгой [5].
Формирование пероксида водорода in situ в водных растворах возможна при кавитационном воздействии. Изучена возможность применения низкочастотного ультразвука для обезжелезивания воды на малогабаритных установках заводского изготовления. Эксперименты, проведенные на имитате и на природной воде, содержащей до 6 мг/л железа (II), имеющей общую жесткость до 12 мг-экв/л, щелочность до 6 мг-экв/л, рН 6,8–7,2, окисляемость до 3,2 мг/л О2 при частоте колебаний 40–60 Гц, при продолжительности процесса 0,5–1 минут, позволили сделать выводы о том, что скорость гомогенного окисления железа (II) в аэрированной воде, подвергнутой ультразвуковой обработке, возрастает в 2,5–3 раза, рН воды увеличивается, агрессивность ее снижается, и жесткость уменьшается на 10–15 % [6]. Наиболее детально изучена возможность использования низкочастотной акустической кавитации для деструкции фенольных соединений [7]. Главный вывод, сделанный авторами обзора: кавитация сама по себе не является экономичным методом обработки вод и, прежде всего, потому, что устройства, используемые для генерирования низкочастотного ультразвука, имеют высокое энергопотребление. Анализ немногочисленных исследований воздействия высокочастотного ультразвука мегагерцевого диапазона, генерируемого с использованием пьезоэлектрических преобразователей, свидетельствует о потенциальной возможности существенного снижения энергозатрат на осуществление процессов кондиционирования природных и сточных вод [8–10]. Исследования возможностей использования высокочастотного ультразвука в процессах обезжелезивания воды отсутствуют.
Цель данных исследований – изучить возможность использования высокочастотной акустической кавитации мегагерцевого диапазона в процессах обезжелезивания природных вод.
Материалы и методы исследования
Объектом исследований являлись модельные растворы сульфата железа, приготовленные на дистиллированной воде (2 мкСм/см), и имитаты, приготовленные на водопроводной воде (рН = 7,1; жесткость 2,5 мг-экв/л; щелочность 2,2 ммоль/л; удельная электрическая проводимость 236 мкСм/см) с концентрацией Fe(II) 2 мг/л. Содержание Feобщ и Fe(II) в растворах определяли фотометрическим методом с о-фенантролином [11]. Эксперименты проводили в термостатированном цилиндрическом стеклянном реакторе с перемешиванием (рис. 1). Объем обрабатываемого раствора 200 мл. Температура раствора 25 ± 1 °С. Основной элемент устройства, генерирующего высокочастотный ультразвук – погружной керамический пьезоэлемент с эффективной площадью излучения 3 см2. Частота ультразвука 1,7 МГц, фактическая интенсивность излучения, установленная экспериментально калориметрическим методом, 3,38 Вт/см2 [12], потребляемая мощность 25 Вт. Детальное описание экспериментальной установки представлено ранее в работах [13, 14]. Для измерения реакции среды использовали портативный прибор Multi 3410 с электродом SenTix®940 (WTW).
Синергический индекс рассчитывали по формуле
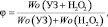
где Wо – начальная скорость реакции окисления: УЗ – сонохимической, H2O2 – пероксидом водорода, УЗ + H2O2 – комбинированной сонохимической с пероксидом водорода.
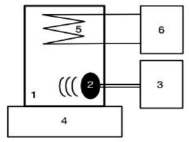
Рис. 1. Схема экспериментальной установки. 1 – стеклянный реактор, 2 – пьезоэлемент, 3 – ультразвуковой генератор, 4 – магнитная мешалка, 5 – охлаждающий контур из стекла, 6 – термостат
Результаты исследования и их обсуждение
Окисление железа (II) в дистиллированной воде происходит очень медленно (0,237 мкмоль/мин) даже при интенсивном перемешивании. Дополнительное воздействие высокочастотным ультразвуком увеличивает скорость окисления в 1,3 раза (до 0,317 мкмоль/мин). Интенсификация процесса окисления железа (II) при воздействии высокочастотного ультразвука, происходит за счет образования активных частиц с высокой окислительной способностью (ОН●, Н2О2 и др.), однако их количества недостаточно. Существующие методы интенсификации кавитационного воздействия основаны на дополнительном или комбинированном использовании других окислительных процессов, в частности, совместно с пероксидом водорода. Экспериментально установлено, что дополнительное высокочастотное ультразвуковое воздействие существенно интенсифицирует процесс окисления железа (II) пероксидом водорода (таблица) и приводит к возникновению синергического эффекта (синергический индекс достигает значения 2).
Влияние высокочастотного ультразвукового воздействия на процесс окисления железа (II) пероксидом водорода
|
Концентрация H2O2, мкМ |
Wo, мкмоль/мин |
СFe через 30 минут, мг/л |
j |
||
|
без УЗ |
с УЗ |
без УЗ |
с УЗ |
||
|
0 |
0,237 |
0,317 |
1,51 |
0,92 |
– |
|
14,7 |
1,21 |
3,11 |
1,20 |
0,31 |
2,0 |
|
44,1 |
2,67 |
5,14 |
0,24 |
0,10 |
1,7 |
Под действием акустических волн в жидкости происходит образование и рост парогазовых кавитационных пузырьков, которые осциллируют, пульсируют и «схлопываются». Молекулы воды и пероксида водорода в условиях коллапса диссоциируют с образованием радикалов:
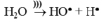
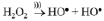
Как известно, гидроксильные радикалы, по сравнению с пероксидом водорода, обладают большей окислительной способностью (Е0(HO●) = 2,05В, Е0(H2O2) = 1,31В [15]), и, вероятно, именно они являются основными активными частицами, участвующими в окислении железа (II).
Для выявления роли гидроксильных радикалов в процессе сонохимического окисления железа (II) проведены эксперименты с добавлением радикальной «ловушки» – метилового спирта. Константа взаимодействия ОН-радикалов с метанолом и ионами железа (II) сравнимы (≈108 л·/моль·c), поэтому при значительном избытке спирта по отношению к ионам железа и окислителю они в первую очередь будут реагировать со спиртом. Экспериментально установлено, что введение метанола при сонохимическом окислении железа (II) пероксидом водорода приводит к замедлению процесса, что свидетельствует о существенной роли гидроксильных радикалов в процессах его сонохимического окисления пероксидом водорода (рис. 2).
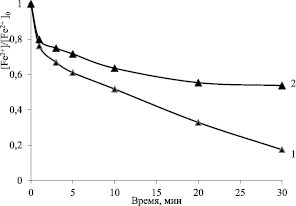
Рис. 2. Кинетика сонохимического окисления железа (II) пероксидом водорода с добавкой метанола (2) и без (1). [Н2О2] = 14,7 мкМ, [CH3OH] = 7,4 мМ
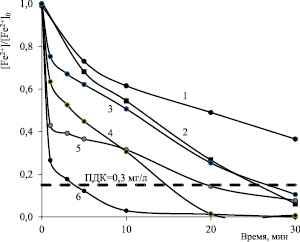
Рис. 3. Кинетика окисления железа (II) пероксидом водорода в водопроводной воде. 1, 3, 5 – без ультразвукового воздействия. 2,4,6 – при активировании ультразвуком. 1, 2 – без Н2О2; 3,4 – [Н2О2] = 7,35 мкМ; 5,6 – [Н2О2] = 14,7 мкМ
Закономерности, установленные на растворах, приготовленных на дистиллированной воде, хорошо согласуются с результатами, полученными на реальной водной матрице – водопроводной воде (рис. 3). При концентрации окислителя 14,7 мкМ дополнительное ультразвуковое воздействие позволяет сократить время, необходимое для окисления железа (II) до установленных норм (≤ 0,3 мг/л, СанПиН 2.1.4.1074-01) с 30 до 5 минут.
В целом, процесс окисления железа в водопроводной воде протекает быстрее. Присутствующие в ней гидрокарбонаты и растворенный кислород способствуют его гидролизу:
Fe2 + + 2HCO3- + 2H2O > Fe(OH)2 + 2H2CO3,
4Fe(OH)2 + О2 + 2H2O > Fe(OH)3v,
4Fe(HCO3)2 + О2 + 2H2O > 4Fe(OH)3v + 8CO2^.
При этом образуется ряд промежуточных соединений, и в воде одновременно присутствует как недиссоциированные молекулы, так и ионы Fe(HCO3)2, Fe(OH)2, Fe2 + , Fe(OH) + .
Заключение
Таким образом, результаты проведенных исследований свидетельствуют о перспективности применения высокочастотного ультразвука для интенсификации процессов обезжелезивания подземных вод, в частности в сочетании с обработкой пероксидом водорода. Ультразвуковое воздействие позволяет существенно сократить время, необходимое для получения питьевой воды необходимого качества. Однако, учитывая многообразие факторов, от которых зависит степень обезжелезивания, в первую очередь, влияние минерального состава обрабатываемой воды, выбор рационального метода удаления железа и подбор дозы окислителя следует осуществлять с помощью предварительной процедуры – пробного обезжелезивания.
Исследование выполнено при финансовой поддержке РФФИ и Правительства Республики Бурятия в рамках научного проекта № 16-45-030849 р_а.

