Молекулярное кариотипирование, рекомендованное к проведению в случаях нарушения, врожденных пороков и микроаномалий развития, может выявлять генетическую причину заболеваний психики примерно в 50 % случаев [5, 6, 12]. Данные об изменениях генома, полученные с помощью array CGH или SNP array, анализируются для определения частоты встречаемости перестроек в различных выборках, вовлеченности генов в геномные сети, межбелковых взаимодействий, экспрессии генов и других параметров [4, 10, 11]. Интерпретация результатов данного метода, позволяющая получить наиболее полную картину последствий нарушений генома у пациента, осуществляется при помощи биоинформатического подхода. Необходимость определения патогенных и непатогенных вариаций среди большого числа CNV, а также оценки возможных последствий нарушения работы локализованных в них генов, делает биоинформатическую технологию незаменимым методом интерпретации вариаций генома [9, 14, 19, 20]. Описание индивидуумов с нарушениями генома при помощи клинических методов диагностики и психологических методов позволяет составить представление о поврежденных и сохранных функциях пациента [2, 3, 13, 20]. Применение психологических методик играет значимую роль в случае наличия нарушений психики, в частности, умственной отсталости и расстройств аутистического спектра, у индивидуума с нарушением генома. Оценка степени выраженности нарушения интеллекта и поведения необходима при описании изменений молекулярных процессов. Обобщая данные, полученные при помощи молекулярно-генетических и психологических методик, можно определить терапевтическую стратегию и разработать план психологической коррекции с учетом особенностей отдельного пациента. Индивидуальный подход и комплексный анализ обеспечивают реализацию персонифицированного подхода, который в настоящее время признается передовым в медицинской практике [1, 9].
Цель исследования
Целью исследования являлось выявление генетических и психологических нарушений у ребенка с выраженной задержкой психоречевого развития, аутистическими проявлениями и микроаномалиями развития.
Материалы и методы исследования
Материалом исследования являлись клетки крови ребенка 6 лет 10 месяцев. При цитогенетическом исследовании применяли методы дифференциального окрашивания хромосом по длине (G- и C- окрашивание). Молекулярное кариотипирование проводилось с использованием чипа фирмы Perkin Elmer (Cоnstitutiоnal Сhip® 4.0), с разрешением сканирования генома до 0,5 млн пн. Начальное определение статуса CNV (непатогенные, вероятно непатогенные, вероятно патогенные, патогенные вариации генома) проводилось согласно рекомендациям Американского Колледжа Медицинской Генетики [15]. Биоинформатический анализ проводился по описанной ранее оригинальной технологии [4, 11], суть которой заключалась в использовании методов отбора генов, основывающихся на геномных/эпигеномных базах данных, и стратегий ранжирования различных функциональных особенностей генов, данные о которых были получены из электронных ресурсов. Отбор генов проводился согласно функции, экспрессии, интерактому, данным о непатогенных вариациях и протеомных сетях (последствия мутации на уровне белка, межбелковые взаимодействия). Совмещая информацию, полученную из баз данных, с фенотипическими проявлениями пациентов, получали возможность идентифицировать гены – кандидаты [21]. Психологические параметры (степень выраженности аутистических проявлений и психологический возраст ребенка) оценивались с помощью оценочной шкалы раннего детского аутизма (Childhood Autism Rating Scale, CARS) и психолого-образовательного теста (Psychoeducational profile, PEP).
Результаты исследования и их обсуждение
Мальчик 6 лет 10 месяцев (82 месяца) был направлен на генетическое консультирование с выраженной задержкой психоречевого развития и аутистическими проявлениями. У ребенка также отмечались оттопыренные ушные раковины, двигательные нарушения по спастическому типу в нижних конечностях, высокое физическое развитие, эктодермальная дисплазия, шалевидная мошонка, уменьшение гениталий, неправильный прикус и нарушение развития зубов. Ребенок родился на 36 неделе беременности от первых физиологических родов, массой тела 3200 г и длиной 52 см, от здоровых родителей 30 лет, не состоящих в кровнородственном браке.
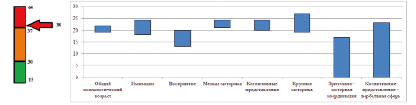
При цитогенетическом исследовании хромосомных аномалий обнаружено не было. Молекулярное кариотипирование выявило вероятно патогенные CNV в виде дупликации участка Xq13.1(68,969,384-69,105,568, размер: 136184 пн), делеции 10q26.13(127,147,986-127,307,264, размер: 159278 пн) и дупликации 17q21.31(41,559,185-41,734,030 размер: 174845 пн). Для определения молекулярных механизмов нарушения психики у ребенка был проведен биоинформатический анализ. В участке Xq13.1 находится ген EDA, нарушение функционирования которого связано с эктодермальной дисплазией и агенезией зубов [8]. Ген EDA вовлечен в различные геномные сети: взаимодействие цитокинов, связывание белков, иммунная система, сигнальные пути цитокинов в иммунной системе, дифференциация эктодермы, связывание рецепторов. Белок, кодируемый данным геном, принадлежит к семейству фактора некроза опухолей и участвует в процессах внутриутробного развития органов эктодермального происхождения [17]. Ранее были описаны вероятно патогенные и непатогенные делеции и инверсии, затрагивающие данный участок [16, 18], однако похожих дупликаций выявлено не было. В некоторых исследованиях, рассматривающих клинические проявления при делеции c вовлечением данного гена, отмечаются задержка психомоторного и психоречевого развития, но не аутистические проявления [20]. Ген EDA взаимодействует с генами EDA2R и EDAR, которые служат промежуточным звеном для активации транскрипционного фактора NF-κB (nuclear factor kappa-light-chain-enhancer of activated B cells) и c-Jun N-терминальной киназы (JNK). В процессе передачи сигнала по пути SAPK (stress-activated protein kinase, протеин-киназа, активируемая стрессом)/JNK регулируется активность многих факторов транскрипции. NF-κB – это белковый комплекс, контролирующий транскрипцию, выработку цитокинов и жизнеспособность клетки. В связи с вовлеченностью гена EDA в геномные сети, имеющие отношение к цитокинам, стоит отметить, что цитокины являются межклеточными регуляторами и мобилизаторами клеток, участвующих в воспалительных процессах, а также процессах клеточного роста, дифференциации, гибели клеток, ангиогенеза и процессов развития и репарации, приводящих к восстановлению гомеостаза [17]. Обращая внимание на наличие у пациента эктодермальной дисплазии и нарушения развития зубов, можно предположить, что дупликация этого гена с высокой вероятностью имеет соответствующие фенотипические проявления. Нарушение функционирования головного мозга, как органа, развивающегося из эктодермы, вероятно, может быть следствием дупликации гена EDA, однако необходимо также иметь в виду гены, локализованные в участках других вероятно патогенных CNV. В участке делеции 10q26.13 гены, индексированные в OMIM, не выявлены. Дупликация 17q21.31 затрагивает гены DHX8, ETV4, MEOX1. Ген DHX8 предположительно вовлечен в эмбриогенез, рост и деление клетки; ген ETV4 активирует промоторы различных матриксных металлопротеиназ, а MEOX1 играет роль в регуляции развития первичных сегментов тела (сомитов) (таблица). Описаны дупликации в данном участке в контрольной группе [7]. Таким образом, результаты биоинформатического анализа позволяют предположить, что клинические проявления и нарушения психики у ребёнка обусловлены дупликацией гена EDA. Нарушения психики в виде особенностей когнитивного развития, снижения психологического возраста и тяжести аутистических проявлений ребенка были оценены с помощью психологических методик. Результат оценки мальчика по шкале раннего детского аутизма (CARS) был равен 38 баллам, что соответствует тяжелой степени аутизма. На обследовании ребенок демонстрировал стереотипные движения в виде раскачиваний, потирания и закрывания ушей. Внимание на предмете удерживал практически исключительно совместно со взрослым. На обращенную речь реагировал избирательно, откликался на имя и выполнял простые просьбы. Экспрессивная речь отсутствовала. Желания выражал изменением поведения, плачем. Психолого-образовательный тест PEP позволил определить общий психологический возраст ребенка, который находился в промежутке от 19 до 22 месяцев, и развитие пациента в различных функциональных сферах, соответствовавшее следующему возрасту: имитация 18–24 месяца, восприятие 13–20 месяцев, мелкая моторика – 21–24 месяца, когнитивные представления– 20–24 месяца, крупная моторика 19–27 месяцев, зрительно – моторная координация 0–17 месяцев, когнитивные представления – вербальная сфера 0–23 месяца (рисунок). Таким образом, данные обследования мальчика 6 лет 10 месяцев с применением психологических методик позволили определить снижение психологического возраста ребёнка, тяжесть аутистических проявлений. Молекулярное кариотипирование и биоинформатический анализ позволили выявить предполагаемую генетическую причину нарушений.
А Б
Результаты обследования ребенка с помощью шкалы CARS (A) психолого-педагогического теста PEP (Б). Возраст ребенка указан в месяцах, биологический возраст на момент исследования составлял 82 месяца
Описание выявленных CNV и локализованных в них генов
|
Аномалия генома |
Ген |
Геномные сети, выявленные при помощи трех баз данных |
Ассоциированное заболевание (по OMIM*) |
Функция гена |
||
|
KEGG* |
Reactome* |
Gene Ontology* |
||||
|
Дупликация Xq13.1 размер: 136184 пн |
EDA |
Цитокинцитокин взаимодействия (hsa04060) |
Иммунная система (R-HSA-168256) |
Cвязывание различных рецепторов и белков, в том числе фактора некроза опухоли (GO:0005102, GO:0005164, GO:0005515) |
Агенезия зубов (313500), эктодермальная дисплазия (305100) |
Кодируемый белок принадлежит к семейству фактора некроза опухолей и может быть вовлечен в передачу сигналов от клетки к клетке в процессе развития органов эктодермального происхождения. |
|
Делеция 10q26.13 размер: 159278 пн |
Гены, индексированные в OMIM, не выявлены. |
|||||
|
Дупликация 17q21.31 размер: 174845 пн |
DHX8 |
Сплайсосома (hsa03040) |
– |
Связывание АТФ, различных белков, РНК (GO:0005524, GO:0005515, GO:0003723), регуляция активности АТФ-зависимой РНК хеликазы (GO:0004004) и сплайсинга мРНК (GO:0000398) |
– |
Относится к генам, регулирующим деление клетки. Вероятно, функционирует как АТФ-зависимая РНК-хеликаза, регулирующая высвобождение мРНК из сплайсосом после сплайсинга, до экспорта из ядра. Этот белок (вероятно) принимает участие в репликации вируса иммунодефицита человека типа 1. |
|
ETV4 |
Нарушение регуляции транскрипции при онкологических заболеваниях (hsa05202) |
Сигнальный путь MAPK6/MAPK4 (R-HSA-5687128) |
Специфичное связывание и активация транскрипции ДНК проксимального участка основного промотора РНК полимеразы II (GO:0000978, GO:0001077); связывание различных белков (GO:0005515); регуляция процессов, происходящих в ядре клетки (GO:0005634), нуклеоплазме (GO:0005654), ядрышке (GO:0005730); регуляция транскрипции с промотора РНК полимеразы II (GO:0006366) и аксонального наведения в моторных нейронах (GO:0008045) |
– |
Является регулятором транскрипции и участвует в различных процессах, включая рост нейронов, развитие молочных желез. Наблюдается повышенная экспрессия данного гена в опухолях различных типов. |
|
|
MEOX1 |
– |
– |
Специфичное связывание ДНК (GO:0001046) и проксимального участка основного промотора РНК полимеразы II (GO:0001077); регуляция развития первичных сегментов тела (сомитов) (GO:0001757); связывание хроматина (GO:0003682); специфичное связывание ДНК с фактором транскрипции (GO:0003700) и связывание различных белков (GO:0005515) |
Синдром Клиппеля-Фейля (214300) |
Кодируемый белок участвует в молекулярной сети, играющей роль в регуляции развития первичных сегментов тела (сомитов). |
|
Примечание. * KEGG: Kyoto Encyclopedia of Genes and Genomes (http://www.genome.jp/kegg/); Reactome (http://www.reactome.org/pages/about/); Gene ontology: Gene ontology Consortium (http://www.geneontology.org/); OMIM: Online Mendelian Inheritance in Man (https://www.omim.org/).
Заключение
Биоинформатический анализ результатов молекулярного кариотипирования описываемого пациента с выраженной задержкой психоречевого развития, аутистическими проявлениями, эктодермальной дисплазией, нарушением развития зубов и другими микроаномалиями развития показал, что вышеперечисленные нарушения вероятнее всего ассоциированы с дупликацией гена EDA, который ранее был связан с эктодермальной дисплазией и агенезией зубов. Психологические методики позволили определить степень аутистических проявлений как тяжелую, а психологический возраст ребёнка составил 19–22 месяца (реальный возраст ребёнка соответствовал 82 месяцам). Дупликации, затрагивающие ген EDA, никогда ранее не были описаны у пациентов с аутистическими проявлениями и умственной отсталостью/задержкой развития. Настоящая работа показывает, что комплекс современных молекулярно-цитогенетических, биоинформатических и психологических методов способствует выявлению генетических причин психических заболеваний и адекватной оценке нарушений психики при геномных перестройках, что в свою очередь является основой для разработки терапевтических стратегий.
Исследование осуществлено при частичной финансовой поддержке Российского Фонда Фундаментальных Исследований (грант № 17-04-01366 А).

