В связи с повсеместным ростом резистентности микробных возбудителей к антибактериальным препаратам во всех областях медицины возрастает актуальность поиска путей повышения эффективности лечения пациентов с инфекциями, обусловленными устойчивыми штаммами патогенов. Создание новых антибактериальных препаратов, с одной стороны, имеет долговременный характер и требует значительных финансовых затрат, с другой – к сожалению, не всегда является эффективным способом борьбы с резистентными возбудителями, пластичность которых, а также их способность к выживанию практически безграничны. Это определяет необходимость искать новые подходы к решению данной проблемы, одним из которых является поиск эффективных комбинаций уже известных лекарственных средств разных классов, обладающих синергидным действием. Такие комбинации обеспечивают бактерицидное действие и эффективное подавление гнойной инфекции, вызываемой, «трудными микроорганизмами», в частности метициллинорезистентными стафилококками. Из известных в настоящее время более 30 видов стафилококков основное клиническое значение имеют Staphylococcus aureus и Staphylococcus epidermidis.
Наиболее трудными для лечения являются инфекции, вызванные метициллинорезистентными штаммами S. aureus (MRSA) и S. epidermidis (MRSE), в частности инфекции области хирургического вмешательства после больших ортопедических операций. Распространенность штаммов MRSA в России высока. Несмотря на то, что по данным многоцентрового исследования в структуре бактериальных возбудителей нозокомиальных инфекций за 2011–2012 гг. доля S. aureus составила 16,7 %, что сопоставимо с данными 2006–2008 гг. (19,5 %), существенно увеличилась значимость метициллинорезистентных штаммов данного возбудителя. Доля MRSA составляла 33,4 % в 2001–2002 гг. и 55,4 % в 2006–2008 гг., возросла до 66,9 % к 2011–2012 гг. [5]. Выделение метициллинорезистентных штаммов S. aureus и S. epidermidis из гнойного очага при перипротезной инфекции является неблагоприятным прогностическим признаком для эффективности антибактериальной терапии и лечения в целом. В РФ до настоящего времени препаратом выбора при MRSA- и MRSE-ассоциированных инфекциях остаётся гликопептидный антибиотик ванкомицин. Однако в настоящее время в научной медицинской литературе многие авторы отмечают снижение эффективности ванкомицина при антибактериальной терапии инфекций, вызванных метициллинорезистентными стафилококками, in vitro демонстрирующими чувствительность к ванкомицину [9]. Это определяет необходимость применения эффективных комбинаций уже известных лекарственных средств разных классов, обладающих синергидным действием в отношении лекарственноустойчивых микробных возбудителей. К примеру, сохранившие активность рифампицин и фузидиевую кислоту для достижения хорошего антистафилококкового эффекта необходимо сочетать c β-лактамами или фторхинолонами [8]. Многие зарубежные исследователи предлагают широко использовать комбинированную антибактериальную терапию при лечении инфекции протезированного сустава стафилококковой этиологии для усиления бактерицидного эффекта, воздействия на микробные биопленки и на клетки бактерий, расположенные внутриклеточно [8].
Целью настоящего исследования было оценить in vitro активность комбинации гентамицина и диоксидина, обладающих принципиально различным механизмом антимикробного действия, в отношении штаммов метициллинорезистентных стафилококков.
Материалы и методы исследования
Для выяснения характера взаимодействия гентамицина и диоксидина в комбинации применяли последовательно два метода: «шахматной доски» и конструирования кривых гибели/роста тест-культуры при воздействии антимикробных агентов
Для метода «шахматной доски» в качестве тест-культур использовали 2 референс-штамма S. aureus АТСС 25923 и S. aureus АТСС 6538, а также 2 клинических изолята стафилококков, резистентных к гентамицину: штаммы MRSA 8074 и 8785, выделенные стандартными методами от пациентов с документированной инфекцией области хирургического вмешательства после эндопротезирования тазобедренного сустава. Все исследования проводили с троекратным повторением на стандартных 96-луночных микропланшетах. Для оценки взаимодействия антибиотиков рассчитывали фракционный индекс ингибиции (FIX – the fractional inhibitory index) по формуле
FIX = FIC (одного антибиотика) + + FIC (второго антибиотика),
где FIC (fractional inhibitory concentrations) – фракционная ингибирующая концентрация исследуемого антибиотика, определяемая как отношение величины минимальной подавляющей концентрации (МПК) этого антибиотика в комбинации с МПК второго антибиотика. Характера взаимодействия препаратов определяли по величине коэффициента FIX согласно шкале: < 0,5 синергизм 0,5–4 индифферентность > 4 антагонизм.
Технически метод осуществляли следующим образом: в каждую лунку 96-луночного планшета вносили по 50 мкл питательного бульона Мюллера-Хинтон (МХБ). Антимикробные препараты титровали серийно двукратно: гентамицин с концентрации 2400 до 0 мкг/мл (ряды A-H), диоксидин – с 2500 до 0 мкг/мл (колонки 1–12) (рис. 1).
Инокулюм каждой тест-культуры (0,5 McFarland) готовили в стерильном изотоническом растворе. В каждую лунку вносили по 100 мкл инокулюма и инкубировали планшет 18 ч при 37 °C. За МПК (в мкг/мл) принимали наименьшую концентрацию антимикробного средства, при которой не наблюдалось видимого роста микроорганизма. Далее для тестируемых штаммов S. aureus рассчитывали коэффициенты FIX. На основе значений фракционных коэффициентов FIC строили изоболограмму и оценивали ее характер.
Метод кинетических кривых гибели/роста бактерий заключался в построении зависимости гибели тестируемых штаммов стафилококков под действием гентамицина и диоксидина индивидуально и в комбинации. Готовили инокулюм (0,5 McFarland) с последующим разведением до концентрации 105 КОЕ/мл в 10 мл среды МХБ, содержащей соответствующую концентрацию антимикробных средств: 1×МПК и 1/4×МПК. В данном эксперименте использовали значения МПК каждого препарата, установленные методом «шахматной доски» для эффективного подавления культуры возбудителя комбинацией гентамицина и диоксидина. Антимикробные комбинации изучаемых препаратов составляли из концентраций, соответствующих 1×МПК+1×МПК и 1×МПК+1/4×МПК каждого агента. Динамику роста тест-культур в МХБ без антибиотика использовали для определения контрольных значений КОЕ/мл. Пробирки инкубировали при 37 °C. Отбор проб осуществляли на 0 ч, 2 ч и 6 ч, стандартным способом производили количественные высевы на чашки агаром Мюллера-Хинтон (МХА) с последующей инкубацией 18–24 ч. Подсчитывали число КОЕ на чашках. Данные выражали в виде Lg от числа выживших колониеобразующих единиц (LgКОЕ/мл). Результаты подсчета КОЕ в точках 0 ч и 24 ч использовали для оценки взаимодействия препаратов. Синергизм определяли как снижение величины КОЕ в 100 или более раз (на 2 Lg) через 24 ч в комбинации, при сравнении с индивидуальным наиболее активным антимикробным препаратом и как 100-кратное снижение КОЕ в сравнении с начальным инокулюмом. Потенцирование (аддитивность), или индифферентность, определяли как менее чем 10-кратное изменение в числе КОЕ на 24 ч при действии комбинации по сравнению с КОЕ при индивидуальном действии наиболее активного антимикробного препарата. Антагонизм определяли при возрастании числа КОЕ в 100 и более раз через 24 ч при действии комбинации в сравнении с наиболее активным индивидуальным препаратом.
Количественные результаты представлены в виде медиан, в качестве меры рассеивания использовали межквартильный интервал 25–75 % (МКИ 25–75 %).
Результаты исследования и их обсуждение
Установленные по результатам 3-х экспериментов медианы МПК (табл. 1) показали крайне невысокую активность диоксидина при воздействии как на штаммы устойчивые к метициллину (156 мкг/мл), так и чувствительные (39 мкг/мл). Кроме того, МПК гентамицина в отношении тестируемых изолятов MRSA также в 4 раза превысила МПК для чувствительных к метициллину референс-штаммов. Однако применение антимикробных препаратов в комбинации потребовало существенно меньших их концентраций для эффективного подавления возбудителей.
Медианы коэффициентов FIC и FIX взаимодействия гентамицина и диоксидина свидетельствуют (табл. 2) об эффективном действии изучаемой комбинации в отношении всех тестируемых культур стафилококков. Величина итоговых коэффициентов FIX во всех случаях не превысила 0,5 и составила для всех штаммов 0,09–0,26, что характерно для синергидного действия препаратов. Установлено, что, несмотря на выявленное синергидное действие в отношении метициллинорезистентных изолятов стафилококков устойчивых к гентамицину, коэффициент FIX для них был выше, чем для референс-штаммов, чувствительных к метициллину и гентамицину.
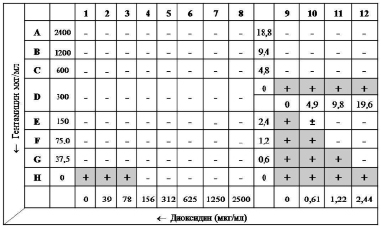
Рис. 1. Схема 96-луночного микропланшета для оценки эффекта комбинации двух антимикробных препаратов методом «шахматной доски» в отношении культуры клинического штамма MRSA 8074, резистентного к гентамицину. Примечание: «+» – рост тест-культуры в лунке; «-» – отсутствие видимого роста в лунке
Таблица 1
МПК исследуемых препаратов при индивидуальном и комбинированном воздействии на тестируемые штаммы (метод «шахматной доски»)
|
Штаммы |
Гентамицин Ме (МИК 25–75 %) |
Диоксидин Ме (МИК 25–75 %) |
||
|
МПК |
МПК в комбинации |
МПК |
МПК в комбинации |
|
|
MRSA 8074 |
4,8 |
1,2 |
156 |
2,44 |
|
MRSA 8785 |
4,8 |
1,2 |
156 |
1,22 |
|
S. aureus АТСС 25923 |
0,029 (0,022–0,029) |
0,0009 (0,0007–0,0009) |
39 |
2,44 |
|
S. aureus АТСС 6538 |
0,015 |
0,0009 (0,0009–0,0023) |
39 |
2,44 (1,525–2,44) |
Таблица 2
Результаты исследования взаимодействия гентамицина и диоксидина (метод «шахматной доски»)
|
Тест-штаммы |
FIC гентамицин Me (МКИ 25–75 %) |
FIC диоксидин Me (МКИ 25–75 %) |
FIX Me (МКИ 25–75 %) |
|
MRSA 8074 |
0,25 (0,25–0,25) |
0,007 (0,007–0,0115) |
0,26 (0,26–0,265) |
|
MRSA 8785 |
0,61 (0,61–0,915) |
0,008 (0,007–0,0117) |
0,26 (0,26–0,262) |
|
S. aureus АТСС 25923 |
0,031 (0,031–0,032) |
0,063 (0,048–0,063) |
0,094 (0,094–0,095) |
|
S. aureus АТСС 6538 |
0,06 (0,053–0,094) |
0,063 (0,051–0,063) |
0,122 (0,122–0,133) |
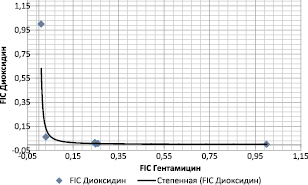
Рис. 2. Изоболограмма для тестируемых штаммов S. aureus, построенная по результатам оценки действия комбинации антимикробных препаратов гентамицина и диоксидина методом «шахматной доски»
Построенная на основе результатов проведенных экспериментов изоболограмма (рис. 2) характеризовалась вогнутой формой, что также соответствует синергидному взаимодействию гентамицина и диоксидина в отношении тестируемых штаммов стафилококков.
Метод кинетических кривых гибели/роста бактерий подтвердил синергидный характер взаимодействия гентамицина и диоксидина в отношении всех изученных штаммов S. aureus. Далее в качестве примера приведены результаты оценки антимикробного действия исследуемых лекарственных средств в отношении клинического штамма MRSA8785. Не установлено подавления роста бактерий при индивидуальном воздействии на тест-штамм (рис. 3).
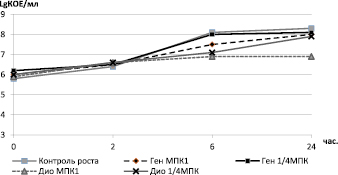
Рис. 3. Кинетические кривые гибели/роста штамма MRSА 8785 под индивидуальным воздействием различных концентраций гентамицина или диоксидина. Примечание здесь и рис. 3: Ген МПК1 и ¼ МПК – гентамицин в концентрации 1,2 и 0,3 мкг/мл, Дио МПК1 и ¼ МПК – диоксидин в концентрации 2,44 и 0,61 мкг/мл
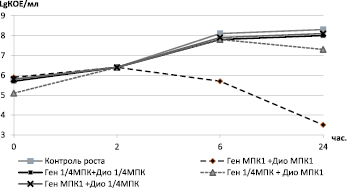
Рис. 4. Кинетические кривые гибели/роста штамма MRSА 8785 под воздействием комбинаций гентамицина и диоксидина в различных концентрациях
При этом наиболее активным антимикробным компонентом был диоксидин в концентрации 2,44 мкг/мл, под воздействием которого к 24 часам от начала эксперимента концентрация инокулюма была 6,9 LgКОЕ/мл в сравнении с 8,3 в контроле и 8,0 при воздействии МПК гентамицина. В то же время комбинация гентамицина и диоксидина в субингибирующих концентрациях (1,2 мкг/мл и 2,44 мкг/мл соответственно) привела к снижению величины КОЕ/мл на 2,5 lg при сравнении с диоксидином в концентрации 2,44 мкг/мл и более чем 100-кратному снижению КОЕ/мл в сравнении с начальным инокулюмом (рис. 4).
В последние годы не только отдельные группы исследователей, но и многие рекомендации профессиональных ассоциаций по лечению различных инфекций призывают применять комбинации антибактериальных препаратов для преодоления резистентности у возбудителей. Синергизм – это усиление бактерицидного действия антибиотиков при их совместном применении. Гентамицин, препарат группы аминогликозидов, в отношении стафилококков обладает бактерицидным действием, однако метициллинорезистентные штаммы часто характеризуются ассоциативной устойчивостью к данному антибиотику [5], что имело место и в нашем исследовании, когда оба клинических изолята MRSA демонстрировали устойчивость к гентамицину. Механизм действия данного антибиотика связан с ингибированием рибосомальных субъединиц 30S. Несмотря на то, что еще в 2003 г. комбинация гентамицина и ванкомицина показала высокую эффективность в лечении эндокардитов, вызванных S. aureus [10], данную комбинацию нельзя рекомендовать к широкому применению, так как у нее существуют нежелательные эффекты, а именно – нарастание нефро- и ототоксичности. В инструкции по медицинскому применению гентамицина имеются четкие указания о том, что следует избегать одновременного и/или последовательного системного или местного применения других нейро- и/или нефротоксических средств, таких как цисплатин, цефалоридин, аминогликозидные антибиотики, полимиксин В, колистин, ванкомицин.
Неэффективность или потенциальная опасность доступных антимикробных препаратов при лечении тяжелых форм гнойной инфекции заставляет обращаться к альтернативным препаратам, к числу которых относится диоксидин. В основе механизма действия препарата лежит повреждение биосинтеза ДНК микробной клетки с глубокими нарушениями структуры нуклеоида уже при действии субингибирующих концентраций, при этом его активность существенно повышается в условиях анаэробиоза со снижением величины МПК в 8–128 раз [6]. Повышение активности в анаэробных условиях характерно для всех производных ди-N-окиси хиноксалина с антимикробной активностью и не описано для других классов антимикробных веществ. В этом принципиальное отличие механизма действия диоксидина от механизма действия других антимикробных препаратов. В условиях анаэробиоза, в том числе и в очаге инфекции, диоксидин (и другие ди-N-окиси) активирует свободнорадикальные процессы, индуцируя образование так называемых активных форм. Диоксидин не кумулирует в почках при повторных введениях, что делает его комбинацию с гентамицином более безопасной, чем ванкомицин и гентамицин.
В последние годы возросло количество публикаций об изучении активности комбинации диоксидина и изониазида в отношении микобактерий туберкулеза, которые характеризуются высокой резистентностью к широкому перечню антимикробных препаратов [1], а также применению диоксидина в клинической медицине для профилактики вентилятор-ассоциированных пневмоний, в комплексном лечении хирургических инфекций, оторингологии [2, 3, 7]. Кроме того, опубликованные результаты экспериментальных исследований свидетельствуют о том, что комбинация диоксидина с норфлоксацином характеризуется медленным развитием резистентности не только у стафилококков, но и грамотрицательных возбудителей. При этом приобретенная микроорганизмами устойчивость к данным препаратам нестабильна и восстановление чувствительности происходит относительно быстро [4]. Эти данные позволяют предположить, что комбинация диоксидина с гентамицином, обладающая синергидным действием, также не будет способствовать быстрому развитию приобретенной резистентности у штаммов-возбудителей.
Таким образом, усиление действия гентамицина с помощью разрешенного для системного использования химиопрепарата диоксидин обеспечивает потенцирование бактерицидного эффекта в отношении метициллинорезистентных штаммов стафилококков. Данная комбинация, по-видимому, способна эффективно подавлять гнойную инфекцию, не вызывая усиления нефротоксичности, так как диоксидин не вызывает изменения со стороны гломерулярного и тубулярного аппарата почек, что позволяет рассматривать возможность применения предложенной комбинации для лечения инфекций, вызванных полирезистентной стафилококковой флорой.

