Ядро бензимидазола содержится во многих биологически активных соединениях [1, 2], в том числе витамине В12. В настоящее время известно 89 производных бензимидазола, используемых в качестве лекарственных средств [3]. Благодаря способности специфически связываться с определенными последовательностями нуклеотидов находят применение в медицине при лечении онкологических и инфекционных заболеваний [4]. Диамины фенилбензимидазольного ряда используются в качестве мономеров для получения полимеров с ценными термомеханическими свойствами [5]. Процессы поликонденсации протекают с участием протонированных форм этих соединений. Проявление физиологической активности также связано с присущими имидазольному кольцу протоноакцепторными свойствами. Поэтому данные о кислотно-основных свойствах соединений фенилбензимидазольного ряда необходимы для понимания закономерностей процессов, протекающих с их участием. Ранее нами были определены константы ионизации моно- и диаминофенилбензимидазолов и изучены спектры поглощения и флуоресценции нейтральных молекул и их протонированных форм [6]. В последнее время в качестве перспективных препаратов рассматриваются бисбензимидазолы [4]. В этой работе представлены данные о спектрально-люминесцентных свойствах ряда бисбензимидазолов с различными заместителями. Настоящая работа посвящена определению констант ионизации диаминов бисбензимидазолов и исследованию их электронных спектров поглощения в водных растворах.
Материалы и методы исследования
Объектами исследования были 1,4-ди-(6-диаминобензимидазолил-2) бензол (ДАБИБ) и ди-(4´-амино-2-фенилбензимидазолил-5) метан (ДАФБИМ). Константы ионизации исследованных соединений определяли спектрофотометрическим методом в буферных растворах с постоянной ионной силой µ = 0,01. Буферные растворы готовили в соответствии с [7]. В случае низких значений рКа
(< 2,5) определение проводили при µ = 0,1. Заданную кислотность создавали 0,5 М соляной кислотой, для поддержания постоянной ионной силы использовали хлорид калия. рН измеряли с помощью рН-метра марки рН-340, предварительно откалиброванного по трем стандартным растворам. Для измерения рН использовали ионселективный стеклянный электрод ЭСЛ-63-06. В качестве электрода сравнения служил вспомогательный хлорсеребряный электрод ЭВЛ-1М3.1. Погрешность определения рН составляла ± 0,02 ед. рН. Спектры поглощения измеряли на спектрофотометрах «Perkin-Elmer-554» и «PU-8800 Unicam» в кварцевых кюветах с толщиной поглощающего слоя 1 см относительно растворов, содержащих все компоненты, кроме исследуемого вещества. Растворы соляной кислоты готовили из стандарт-титров, все использованные соли имели квалификацию х.ч.
Результаты исследования и их обсуждение
Бисбензимидазолы имеют интенсивные полосы поглощения в ближней УФ- или видимой области спектра. Спектры поглощения этих соединений зависят от кислотности среды, что свидетельствует о присоединении протона и образовании протонированных форм этих соединений. Протоноакцепторными центрами этих молекул являются пиридиновый атом гетероцикла и аминогруппы фенильного кольца и бензимидазольного цикла. Ранее было показано, что первым центром протонирования в молекулах аминопроизводных фенилбензимидазола является пиридиновый атом азота гетероцикла [8]. На рис. 1 представлены спектры поглощения ДАФБИМ при различных рН растворов.
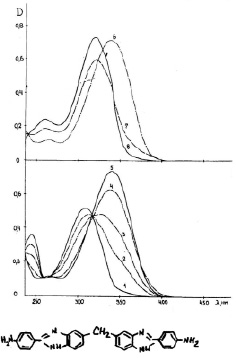
Рис. 1. Спектры поглощения водных растворов ДАФБИМ при различных рН растворов:
1 – 0,1; 2 – 1,1; 3 – 1,5; 4 – 2,1; 5 – 3,3; 6 – 4,4; 7 – 6,7; 8 – 10,7. С = 1,19х10-5 М; Т = 20 °С
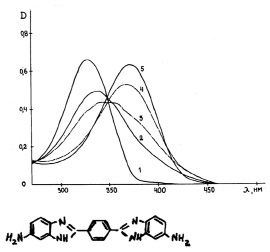
Рис. 2. Спектры поглощения водных растворов ДАБИБ при различных рН растворов:
1 – 1,1; 2 – 2,8; 3 – 4,0; 4 – 5,8; 5 – 9,0. С = 1,40х10-5 М; Т = 20 °С
Наблюдаемые спектральные эффекты при увеличении кислотности среды совпадают с обнаруженными ранее закономерностями для моно- и диаминопроизводных фенилбензимидазола. Спектр поглощения раствора с рН ≥ 10,7 (кривая 8) принадлежит нейтральной форме. По мере уменьшения рН наблюдается батохромный сдвиг полосы поглощения, связанный с протонированием атомов азота бензимидазольных циклов. В кислой среде (кривые 5–1) имеет место протонирование аминогрупп и наблюдается обратный эффект – гипсохромное смещение полос поглощения, обусловленное связыванием неподеленных пар электронов аминогрупп и выключение их из цепи сопряжения.
Принципиально иная картина изменения спектров поглощения при образовании катионных форм имеет место для молекулы ДАБИБ (рис. 2). В этом случае имеет место монотонное гипсохромное смещение по мере присоединения протонов ко всем центрам протонирования (табл. 1).
Таблица 1
Максимумы полос поглощения молекулярных и катионных форм бисбензимидазолов
|
Соединение |
λмакс. (ε·10-3) |
||||
|
В |
ВН+ |
ВН22+ |
ВН33+ |
ВН44+ |
|
|
ДАФБИМ |
319 (60,3) |
340 |
345 |
330 |
310 (47,3) |
|
ДАБИБ |
371 (44,9) |
364 |
357 |
338 |
329 (47,1) |
Константы ионизации исследуемых соединений определяли спектрофотометрическим методом. Для предварительной оценки рКа и нахождения областей доминирующего существования равновесных частиц строили зависимость оптической плотности от рН раствора. Из полученных зависимостей следует, что стандартная методика определения рКа не пригодна (рис. 3). Для осложненных случаев смешанные константы ионизации ступенчатых равновесий могут быть рассчитаны совокупно с коэффициентами молярного погашения равновесных частиц [6]. Для определения констант ионизации исследуемых соединений необходимо решение систем линейных уравнений различного вида, полученных из уравнений закона сохранения массы, закона действующих масс и закона Бугера – Ламберта – Бера.
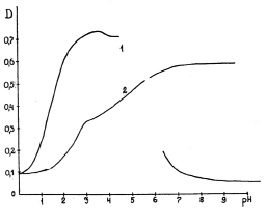
Рис. 3. Зависимости оптической плотности от рН растворов:
1 – ДАФБИМ (λ = 340 нм), 2 – ДАБИБ (λ = 370 нм)
Для расчета Ка выбирали оптимальные длины волн и значения рН, когда в растворе присутствуют только 2 равновесные частицы. Определение числа компонентов в растворе проводили по методу Уоллеса –Каца [9]. Значения диагональных элементов считали нулевыми при условии D < 2s, где D – оптическая плотность, s – стандартное отклонение единичного измерения. Значения Ка получали путем решения уравнений вида
AhiKj-1∙εBHj – DihiKj-1 = Di – AεBHj-1, (1)
Ahi-1Kj∙εBHj-1 – Dihi-1Kj = Di – AεBHj. (2)
В случае многоступенчатой ионизации и близких констант использовали уравнения, учитывающие 2 ступени ионизации и присутствие 3 равновесных частиц:
Kj-1-1∙hi∙DBHj-1 + (DBHj∙hi2∙ Kj-1-1 – Dihi2 Kj-1-1)Kj-1 = Di + Dihi Kj-1-1 – DBHj-2, (3)
Kj-1-1∙hi∙DBHj-1 + (DBHj∙hi2∙ Kj-1 – Dihi – Dihi2 Kj-1)Kj-1-1 = Di– DBHj-2, ,(4)
где j – количество протонов, присоединенных к основанию, Kj – j-ступенчатая константа ионизации сопряженной кислоты BHjj+, hi – активность водородных ионов i-раствора, Di – оптическая плотность i-раствора, А – исходная концентрация исследуемого соединения, εBHj
и εBHj-1 – коэффициенты молярного погашения (j – 1) – протонированного основания и его сопряженной кислоты; DBHj, DBHj-1 и DBHj-2 – оптические плотности растворов, содержащих только индивидуальные формы исследуемых соединений.
Вид системы уравнений для расчета рКа выбирали с учетом определения числа равновесных частиц, присутствующих в растворе путем анализа матрицы оптических плотностей. Системы уравнений составляли таким образом, чтобы ∆D ≥ 0,5; ∆pH ≥ 0,3.
Термодинамические величины рКаТ вычисляли по уравнению Дебая – Хюккеля:
рКат = рКа – n∙0,505μ1/2 при μ = 0,01,
рКат = рКа – n∙0,505μ1/2(1 + 1,6 μ1/2)-1 при μ = 0,1,
где μ – ионная сила раствора, n = j2 – (j – 1)2.
Определение рКа соединений бисбензимидазольного ряда представляет определенные трудности в силу особенностей спектров поглощения молекулярных, моно- и дипротонированных форм (рис. 1, 2), а также близких значений рКа гетероциклов. По этой причине константы ионизации имидазольного цикла были оценены приблизительно, а константы ионизации аминогрупп были получены с точностью 0,04–0,14, в то время как полученные таким же методом ранее константы ионизации моно- и диамина фенилбензимидазола были рассчитаны с точностью 0,02–0,03 ед.
Из спектров поглощения и зависимости D от рН можно примерно оценить интервал протонирования атома азота имидазольных циклов в бисбензимидазолах. Разрыв на зависимости оптической плотности от рН характеризует область низкой растворимости, в которой измерения спектров поглощения не проводилось из-за выпадения в осадок исследуемого соединения. То есть в интервале от 4,4 до 6,7 единиц рН наблюдается образование малорастворимой формы соединения – дикатиона ДАФБИМ, в которой оба атома азота бензимидазольных циклов находятся в протонированной форме.
Среди ароматических азотсодержащих гетероциклических соединений имидазол является одним из самых сильных оснований. В гистидиновой единице полипептидной цепи имидазольная группа – самое сильное основание, а катион имидазолиния – самая сильная кислота, обнаруженные в заметной концентрации при физиологических значениях рН. Аннелирование имидазола приводит к сильному снижению его основности. Так, рКа бензимидазола (БИ) составляет только 5,53 [10], в то время как значение рКа имидазола равно 6,95 [10]. 2-фенилбензимидазол (ФБИ) является гораздо более слабым основанием, чем незамещенный имидазол. Введение аминогрупп в молекулу ФБИ приводит к повышению его основности, что следует связать с увеличением электронной плотности на третичном атоме азота БИ-цикла [6]. Повышение основности БИ-цикла имеет место и при 5-аминозамещении в молекуле БИ [10]. В табл. 2 представлены значения рКа аминопроизводных бензимидазольного ряда. Как видно из представленных данных влияние аминогруппы бензимидазольного цикла и фенильного кольца на основность имидазольного цикла в молекуле ДАФБИ примерно аддитивно [132]. Аминогруппа фенильного кольца несколько больше повышает основность имидазольного цикла, чем аминогруппа бензимидазольного фрагмента. Аминогруппа бензимидазольного цикла заметно сильнее по своей протоноакцепторной способности, чем аминогруппа фенильного кольца (табл. 1). Близкие значения рКа аминогруппы бензимидазольного цикла в 5-аминобензимидазоле, ФАБИ и ДАФБИ свидетельствуют о незначительном влиянии фенильного фрагмента на основность аминогруппы бензимидазольного цикла. В свою очередь, влияние бензимидазольного фрагмента на основность аминогруппы фенильного кольца велико. Если рКа анилина равно 4,58 [1], то в АФБИ эта величина составляет 1,36. С другой стороны, наличие аминогруппы в фенильном кольце не оказывает существенного влияния на основность аминогруппы бензимидазольного цикла, что может быть объяснено ослаблением электронного эффекта заместителя гетероциклической группировкой. Небольшое уменьшение рКа аминоруппы фенильного кольца ДАФБИ по сравнению с рКа аминоруппы фенильного кольца АФБИ связано с наличием в дикатионе ДАФБИ электроноакцепторной +NH3 – группы.
Более сложная картина изменения кислотно-основных свойств имеет место у диаминов бисбензимидазолов. Так, в ДАФБИМ наблюдается сильное повышение основности первого атома бензимидазольного цикла (самое высокое значение первой константы ионизации среди всех исследованных соединений). Присоединение второго протона затруднено вследствие наличия положительного заряда у монокатиона ДАФБИМ. Разность рКа1 и рКа2 составляет около двух порядков. В молекуле ДАБИБ рКа1 и рКа2 ДАБИБ близки между собой (табл. 2), что, вероятно, связано с делокализацией протона по единой π-системе молекулы. В пользу данного предположения свидетельствуют и изменения электронных спектров поглощения при протонировании молекулы ДАБИБ.
Таблица 2
Константы ионизации некоторых азолов и их аминопроизводных
|
Соединение |
рКа имидазольного цикла |
рКа аминогруппы |
рКа аминогруппы фенильного кольца |
|
имидазол |
6,95 [1]; 7,05 [10] |
– |
– |
|
2-фенилимидазол |
6,48 [10] |
– |
– |
|
бензимидазол |
5,53 [10] |
– |
– |
|
2-фенилбензимидазол |
5,23 [11] |
– |
– |
|
5-аминобензимидазол |
6,11 [10] |
3,07 [10] |
– |
|
ФАБИ |
5,84 [6] |
3,00 [6] |
– |
|
АФБИ |
5,94 [6]; 5,05 [12] |
– |
1,36 [6]; 1,40 [13] |
|
ДАФБИ |
6,43 [6]; |
3,12[6]; 3,02 [13] |
1,02 [6]; |
|
ДАБИБ |
≥ 5,7 < 6 |
рКа3 3,99 рКа4 1,84 |
– |
|
ДАФБИМ |
~ 5,8 ~ 7,5 |
– |
рКа3 2,03 рКа4 0,88 |
Примечание. Погрешность определения рКа ДАБИБ и ДАФБИМ 0,04 – 0,14.
Однако на расщепление значений рКа аминогрупп метиленовый мостик и фенильное кольцо оказывают противоположное влияние. Так, в молекуле ДАФБИМ рКа аминогрупп имеют более близкие значения, чем в молекуле ДАБИБ.

