В условиях старения населения восстановление поврежденных суставов представляется одной из важнейших задач практической медицины. Российский научно-исследовательский институт травматологии и ортопедии им. Р.Р. Вредена (Санкт-Петербург) является одним из лидеров российской науки в области фундаментальных и экспериментальных исследований, посвященных проблемам восстановления опорно-двигательного аппарата. Доклинические исследования регенерационного потенциала поверхности суставного хряща необходимы для разработки методов воздействия на направленность хондрорегенераторного процесса, поскольку лечение дефектов гиалинового хряща суставов нижних конечностей представляет собой сложную ортопедическую проблему [2].
Цель исследования – изучить хондрорегенерационный процесс в экспериментальном локальном дефекте суставной поверхности хряща и оценить его степень в зависимости от диаметра формируемого дефекта.
Материалы и методы исследования
Исследование выполнено на 36 беспородных половозрелых самках крысах весом 200–210 г в возрасте 6 месяцев (инбредная линия Wistar). Процедуры проводили в соответствии с этическими нормами, изложенными в «Правилах проведения работ с использованием экспериментальных животных» и Директиве 2010/63/EU Европейского Парламента и Совета Европейского Союза по охране животных, используемых в научных целях. Всем опытным животным, полученным из ФГУ «Питомник лабораторных животных Рапполово», формировали локальный поверхностный дефект нагружаемой зоны суставного хряща коленного сустава различных диаметров: 300, 600, 1000 мкм [1]. Наружным парапателлярным доступом вскрывали суставную сумку, отодвигали надколенник, обнажали мыщелки бедра. Стоматологическим бором (частота вращения 40 об/с) в сочетании с разработанным устройством для формирования стандартизированных дефектов суставной поверхности (заявка № 2017116594) в положении сгибания коленного сустава формировали дефект хрящевой поверхности в нагружаемой зоне. Затем коленный сустав разгибали и фиксировали надколенник рассасывающей нитью 3/0, суставную сумку и окружающие ткани послойно ушивали. Швы на кожу накладывали по Хостеду. Крыс содержали в клетках по 5 особей в условиях искусственного освещения (по 12 часов светлого и темного времени), при температуре 18–26 °C и относительной влажности 30–70 %. Распределение животных по группам исследования представлено в таблице. Контролем служила хрящевая поверхность интактного коленного сустава контрлатеральной конечности.
Распределение животных по группам исследования
|
Группа |
Диаметр дефекта, мкм |
Количество животных, шт |
Световая микроскопия |
Сканирующая электронная |
||
|
30 сут. |
90 сут. |
30 сут. |
90 сут. |
|||
|
1 |
300 |
12 |
3 |
3 |
3 |
3 |
|
2 |
600 |
12 |
3 |
3 |
3 |
3 |
|
3 |
1000 |
12 |
3 |
3 |
3 |
3 |
|
36 |
18 |
18 |
||||
Животных выводили из опыта на 30-е и 90-е сутки путем передозировки раствора тиопентала натрия. Для гистологического исследования экспериментальный материал фиксировали в 10 % формалине (рН 7,4), декальцинировали в «Трилон Б» и заливали в парафин по стандартной методике (Р. Лили, 1969). Для обзорной микроскопии парафиновые срезы толщиной 7 мкм окрашивали гематоксилином и эозином. Для выявления кислых мукополисахаридов как показателя активности метаболизма хрящевой ткани использовали гистохимическую окраску альциановым синим, морфометрически оценивали динамику изменения диаметра дефекта. Исследование методом сканирующей электронной микроскопии проводили на комплексе Jeol JSM 6390LA (Япония) совместно с ФГБУН «Ботанический институт им. В.Л. Комарова». Методика позволила получить информацию о составе, строении и некоторых других свойствах приповерхностных слоёв хряща коленного сустава.
Результаты исследования и их обсуждение
По данным СЭМ на 30-е сутки после формирования дефекта диаметром 300 мкм повреждение четко не визуализировалось (рис. 1, А). Область дефекта была покрыта волокнистым хрящом (рис. 1, В), под которым обнаруживался слой гиалинового хряща небольшой толщины с преобладанием клеток базальной зоны. Зональность хряща определялась, целостность базальной линии была не нарушена, субхондральная кость не повреждена, очаги сосудистых образований не обнаружены. Не было отмечено дегенеративных процессов и гибели клеток.
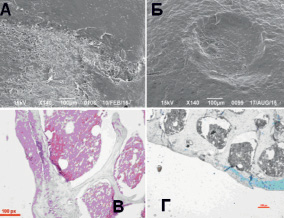
Рис. 1. Микрофотографии области повреждения суставной поверхности на 30-е (А, В) и 90-е (Б, Г) сутки после формирования дефекта диаметром 300 мкм. А, Б – СЭМ препараты, контрольный штрих указан, В – световая микроскопия, увеличение х400, окраска гемотоксилин и эозин., Г – световая микроскопия, увеличение х200, окраска альциановый синий
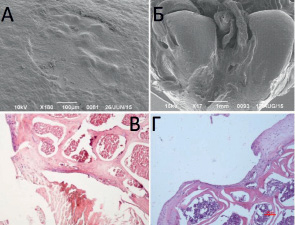
Рис. 2. Микрофотографии области повреждения суставной поверхности на 30-е (А, В) и 90-е (Б, Г) сутки после формирования дефекта 600 мкм. А, Б – СЭМ препараты, контрольный штрих указан. В, Г – световая микроскопия, В – увеличение 200х, Г – увеличение 100х, окраска гематоксилин и эозин
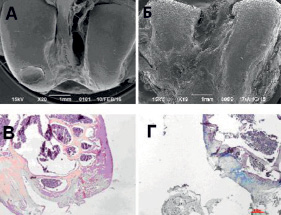
Рис. 3. Микрофотографии области повреждения суставной поверхности на 30-е (А, В) и 90-е (Б, Г) сутки после формирования дефекта 1000 мкм. А, Б – СЭМ препараты, контрольный штрих указан. В, Г – световая микроскопия, увеличение х40, окраска гемотоксилин и эозин (В), альциановый синий (Г)
Гистологически на 90-е сутки в группе 1 слой гиалинового хряща не обнаруживался, на дне дефекта был небольшой слой вновь образованного волокнистого хряща (рис. 1, Г). Зональность хряща была нарушена, целостность базальная линии частично нарушена, повреждение субхондральной кости и формирования сосудов не выявлено, отмечены признаки формирования гиалиноподобной ткани по поверхности повреждения. Методом СЭМ визуализировался дефект диаметром около 420 мкм с ровными краями, покрытый тканью, структурно напоминающей неповреждённую хрящевую поверхность (рис. 1, Б).
В группе животных 2 (с диаметром дефекта 600 мкм) на 30-е сутки не определялись краевые трещины с фрагментацией хряща вокруг дефекта (рис. 2, А). Область повреждения была правильной округлой формы с частично нечеткими границами. В области дефекта обнаруживались новообразованные включения неправильной формы. Дно дефекта было покрыто как пористой тканью, так и тканью, структурно напоминающей неповреждённую суставную поверхность (рис. 2, В).
К 90-м суткам дефект увеличился в размерах до 1300 мкм (рис. 2, Б), неровные края были изрезаны множественными краевыми трещинами. Гистологические изменения были схожи с реакцией тканей на дефекты большего диаметра, однако по краям дефекта обнаружено незначительное образование гиалиноподобной ткани (рис 2, Г).
При исследовании препаратов группы 3 (с дефектом диаметром 1000 мкм) методом СЭМ на 30-е сутки в центральной части мыщелка прооперированного сустава по латеральной его поверхности с переходом на нагрузочную зону чётко визуализировалось повреждение с ровными краями правильной округлой формы (рис. 3, А), размером в среднем 1450 мкм. В препаратах определялись множественные краевые трещины с фрагментацией интактного хряща вокруг дефекта, что свидетельствует о продолжающемся процессе хондромаляции. Дно дефекта было покрыто тканью пористой структуры с выступающими на поверхности клетками и отмечена активно прогрессирующая деградация внеклеточного матрикса.
Морфологически при дефекте диаметром 1000 мкм через 30 суток зональность хряща слабо определялась, дном повреждения являлся базальный – обызвествлённый слой хряща (рис. 3, В), а целостность базальной линии не была нарушена. Субхондральная кость не повреждена, присутствовали очаги формирования сосудов и наблюдались деструктивные изменения, связанные с разволокнением внеклеточного матрикса и увеличением объёмной плотности хондроцитов.
Через 90 суток по результатам СЭМ дефект визуализировался и увеличился в размере в группе 1000 мкм – до 2250 мкм, имел неровные края, множественные краевые трещины и был покрыт разрушающейся пористой тканью, с выходом клеток из внеклеточного матрикса (рис. 3, Б). Морфологически слой гиалинового хряща не обнаруживался, дефект был покрыт разрушающимся волокнистым хрящом небольшой толщины (рис. 3, Г). Зональность хряща не обнаруживалась, целостность базальной линии была нарушена, имелись повреждения субхондральной кости и образование сосудов. В центре повреждения визуализировались очаги деструкции вновь образованного волокнистого хряща и отмечалась гибель клеток.
Полученные результаты свидетельствуют, что собственная регенеративная способность гиалинового хряща чрезвычайно мала, и даже незначительный дефект 300 мкм не способен к полному восстановлению и может быть назван критическим дефектом. В более ранние сроки (30-е сутки) не выявлено зависимости увеличения размера дефекта от его исходного диаметра, однако к 90-м суткам в группе 3 с дефектом 1000 мкм прогрессирование деструктивных изменений было более выражено, чем в группах с дефектами 600 и 300 мкм, что подтверждается ранее опубликованными литературными данными [3]. Таким образом, скорость разрушения поверхностного слоя хряща зависит от размера первоначального дефекта.
Возможно, регенерация гиалинового хряща может происходить только на ограниченном пространстве тесного взаимодействия неповреждённых и повреждённых участков гиалинового хряща, что согласуется с данными научной литературы [1]. В подтверждение данного факта, на отдельных поверхностных участках созданного повреждения нами отмечалась незначительная пролиферация вновь образованной гиалиноподобной хрящевой ткани в верхнем слое неповрежденного суставного хряща с направлением к центру созданного дефекта, что согласуется с данными полученными Т.А. Ступиной с соавторами при формировании щелевидного костно-хрящевого дефекта [2]. Данный факт может свидетельствовать о том, что клеточный состав различающихся по глубине расположения зон гиалинового хряща характеризуется неодинаковой способностью к пролиферации и формированию регенерата.
При больших размерах дефекта на разных сроках наблюдения было обнаружено продолжающееся разрушение гиалинового хряща. Установленная активная клеточная пролиферация в области созданных дефектов свидетельствует о достаточном уровне питания клеток, однако при этом в большей части дефекта формируется волокнистая соединительная ткань. По мнению S. Marlovits с соавторами [5], это может свидетельствовать о регулируемой направленности клеточной дифференцировки. С течением временем новообразованный регенерат деградировал до субхондральной кости, что подтверждает ранее опубликованные данные [4].
Заключение
Настоящее исследование посвящено изучению хондрорегенерационного процесса на 30 и 90-е сутки в экспериментальном локальном дефекте суставной поверхности хряща различных диаметров: 300, 600, 1000 мкм. На отдельных поверхностных участках минимального созданного повреждения на ранних сроках нами отмечалась незначительная пролиферация вновь образованной гиалиноподобной хрящевой ткани в верхнем слое неповрежденного суставного хряща с направлением к центру дефекта. К 90-м суткам регистрировали разволокнение гиалинового хряща. Таким образом, полученные результаты свидетельствуют, что собственная регенеративная способность гиалинового хряща чрезвычайно мала, и дефект диаметром 300 мкм можно рассматривать как критический.

