Статины – ингибиторы ГМГ-Ко А-редуктазы признаны наиболее эффективной группой гиполипидемических средств. Однако их применение ассоциируется с развитием специфического побочного эффекта статиновой миопатии. Мышечные боли возникают внезапно, даже при длительном применении одного и того же препарата. Имеющиеся в литературе разрозненные сведения о механизмах статиновой миопатии не позволяют выстроить патогенетическую последовательность метаболических событий. Известно, что ГМГ-Ко А-редуктаза участвует в биосинтезе убихинона и нарушения на этом участке дыхательной цепи рассматриваются как один из основных механизмов деструктивных процессов [1, 2].
Целью работы явился анализ морфо-молекулярных изменений в мышцах экспериментальных животных при длительном введении симвастатина (зокора).
Материалы и методы исследования
Исследование проводилось на беспородных крысах-самцах в возрасте 12–14 месяцев (300–350 г). Содержание животных соответствовало санитарным правилам СП 2.2.1.3218–14 “Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)” от 29.08.2014. Животных в течение 3 месяцев содержали на рационе, обогащённом животными жирами (топлёное сливочное масло) и легко усваиваемыми углеводами (тростниковый сахар, манная крупа). В процессе эксперимента животные были разделены на две группы: группа сравнения – 35 животных, получавших рацион без добавления лекарственных веществ; экспериментальная группа – 35 животных, получавших в течение 2 месяцев симвастатин (Zocor, 20 мг) по 0,001 г/ 100 г массы один раз в сутки в виде водной суспензии через пищеводный зонд. В качестве контрольной группы использовали интактных животных, которых содержали на общем рационе вивария (35 животных). Животных выводили из эксперимента декапитацией.
Для исследования отбирали фрагменты скелетных мышц из задней лапы животного. Активность аденозинтрифосфатного ферментного комплекса (Mg2+ и Са2+ – зависимой Na+/К+ – АТФ-азы) в гомогенатах определяли по методу, основанному на расщеплении под влиянием фермента органических фосфорсодержащих соединений с образованием неорганического фосфата, который регистрировали по реакции с молибдатом аммония в присутствии аскорбиновой кислоты [3].
Митохондрии выделяли дифференциальным центрифугированием после гомогенизации в солевом растворе (0,15 М KCl и 10 мМ трис-HCl). Для удаления ядерной фракции гомогенаты центрифугировали 15 мин при 640 g. Фракцию митохондрий выделяли в течение 25 мин при 20 000 g с двукратным промыванием средой выделения. Активность субстратных дегидрогеназ цикла Кребса: пируватдегидрогеназы (ПДГ), α-кетоглутаратдегидрогеназы (α-КГ-Дг), сукцинатдегидрогеназы (СДГ) определяли спектрофотометрическим методом в модельной системе по реакции восстановления нитросинего тетразолия в присутствии специфического субстрата (пирувата Na, α-кетоглутарата, сукцината) [4]. Активность цитохромоксидазы (ЦХО) определяли по реакции с парадинитродифениламином [5].
Для проведения морфологического исследования фрагменты мышечной ткани фиксировали в 10 % нейтральном формалине в течение суток. Далее фрагменты мышечной ткани подвергали гистологической проводке по стандартному протоколу для операционного материала. Проведённые фрагменты заливали в стандартные заливочные кассеты для дальнейшей микротомии. Срезы расправляли в водяной бане и окрашивали по стандартной методике гематоксилином и эозином. После окраски срезы помещали под покровные стекла и осуществляли микроскопию с использованием микроскопа Nikon eclipse 50i с графической станцией Nikon digital sight DS-U3, окуляров CFI 10х/22, объективов Nikon Plan 10х/0,25, 20х/0,4, 40х/0,65.
Статистическую обработку экспериментальных данных проводили с использованием программных пакетов STATISTICA 6.0 и Microsoft Office Excel. Статистически достоверными считали отличия, соответствующие оценке ошибки вероятности р ≤ 0,05.
Результаты исследования и их обсуждение
В ранних исследованиях нами установлено, что содержание животных на рационе, обогащённом легкоусваиваемыми углеводами и животными жирами (группа сравнения), приводило к нарушению интеграции основных метаболических путей энергетического обмена, которое характеризовалось накоплением недоокисленных продуктов – пирувата и лактата, повышением активности ПДГ на 119 % (p<0,001), α-КГ-ДГ на 94,12 % (p<0,001), тогда как активность ЦХО и СДГ не отличалась от показателей контрольной группы (табл. 1) [6, 7].
После введения симвастатина в течение 2 месяцев в мышцах животных наблюдали снижение активности ПДГ на 27,9 % (p1<0,05) и α-КГ-ДГ на 54,6 % (p1<0,001) относительно группы сравнения. Относительно контрольной группы активность ПДГ оставалась увеличенной на 57,71 (p1<0,001), α-КГ-ДГ достоверно не отличалась. В то же время, в мышцах животных экспериментальной группы выявлено резкое снижение активности СДГ на 67,62 % (p1<0,001), ЦХО на 69,44 % (p1<0,001). При сравнении результатов с показателями контрольной группы активность СДГ и ЦХО была снижена на 63 % (p<0,001) и 71,8 % (p<0,001) соответственно (табл. 1).
В литературе имеются единичные и фрагментарные сведения об изменениях энергетического обмена и вкладе морфо-функциональных изменений в митохондриях мышц при длительном приёме статинов. Анализируя полученные данные, можно полагать, что длительное введение симвастатина способствует усугублению нарушения энергетического обмена в мышцах, обусловленных гиперхолестеринемией, что может быть связано с дефицитом убихинона.
Таблица 1
Концентрация метаболитов гликолиза и активность ферментов энергетического обмена в мышечной ткани животных исследуемых групп (M±m)
|
Показатель |
Контрольная группа n=35 |
Группа сравнения n=35 |
Экспериментальная группа n=35 |
|
СДГ [мкмоль/мл белка] |
2,14 ± 0,235 |
2,44 ± 0,261 p>0,05 |
0,79 ± 0,066 p1<0,001 p<0,001 |
|
ЦХО [мкмоль/мл белка] |
0,0039 ± 0,00056 |
0,0036 ± 0,00028 p>0,05 |
0,0011 ± 0,00011 p1<0,001 p<0,001 |
|
α-КГ-Дг [мкмоль/мл белка] |
0,884 ± 0,094 |
1,716 ± 0,085 p<0,001 |
0,779 ± 0,089 p1<0,001 p>0,05 |
|
ПДГ [мкмоль/мл белка] |
0,811 ± 0,096 |
1,774 ± 0,223 p<0,01 |
1,279 ± 0,137 p1<0,05 p<0,001 |
Примечание. р – достоверно относительно контрольной группы; р1 – достоверно относительно группы сравнения.
При этом в мышцах животных с экспериментальной гиперхолестеринемией выявлено повышение общей АТФ-азной активности на 28 % (p<0,05), АТФ-азы Са2+ на 98 % (p<0,001) и АТФ-азы Mg2+ на 113,5 % (p<0,001) относительно контрольной группы. Динамику АТФ-азной активности в условиях гиперхолестеринемии можно рассматривать как адаптивно-компенсаторный механизм, направленный на сохранение внутриклеточного ионного гомеостаза (табл. 2).
Таблица 2
АТФ-азная активность в мышцах животных исследуемых групп (M±m)
|
Показатель |
Контрольная группа n=35 |
Группа сравнения n=35 |
Экспериментальная группа n=35 |
|
АТФ-аза общ. [мкмоль/мл белка] |
0,0176 ± 0,0018 |
0,0225 ±0,0020 p<0,05 |
0,0072 ± 0,0006 p1<0,001 p<0,001 |
|
АТФ-аза Са2+ [мкмоль/мл белка] |
0,0436 ± 0,0023 |
0,0865 ± 0,0041 p<0,001 |
0,0307 ± 0,0018 p1<0,001 p<0,001 |
|
АТФ-аза Mg2+ [мкмоль/мл белка] |
0,0577 ± 0,002 |
0,1232 ± 0,005 p<0,001 |
0,0676 ± 0,002 p1<0,001 p<0,001 |
Примечание. р – достоверно относительно контрольной группы; р1 – достоверно относительно группы сравнения.
Введение симвастатина способствовало снижению в мышечной ткани общей АТФ-азной активности на 68,00 % (p1<0,001), АТФ-азы Са2+ на 64,51 % (p1<0,001) и АТФ-азы Mg2+ на 45,13 % (p1<0,001) относительно группы сравнения (табл. 2). Следует отметить, что при сравнении с показателями контрольной группы общая АТФ-азная активность была снижена на 59,1 % (p<0,001), активность АТФ-азы Са2+ на 29,59 % (p<0,001), активность АТФ-азы Mg2+ была увеличена на 17,16 % (p<0,001). Принимая во внимание данные об изменении ферментов энергетического обмена, можно полагать, что снижение АТФ-азной активности обусловлено дефицитом макроэргических фосфатов. Нарушение активного транспорта ионов способствует формированию ионного дисбаланса, следствием чего является нарушение возбудимости миоцитов, искажение регуляторной роли ионов Са2+ и Mg2+ и постепенная структурно-функциональная деградация мышечного волокна [10] .
В связи с этим возникает вопрос: насколько выявленные биохимические сдвиги коррелируют с состоянием структурных компонентов. При исследовании образцов ткани животных экспериментальной группы было выявлено нарушение характера расположения мышечных клеток. Так, обнаруживались участки с однонаправленным расположением миоцитов, которые чередовались с участками с разнонаправленным расположением клеток. При более сильном увеличении (в 880 раз) отмечалось наличие участков резко гипотрофированных миоцитов с узкими веретеновидными ядрами, часть ядер имели внутриядерные включения и выраженное снижение оптической плотности ядра, сменяющихся участками с относительно неизменными миоцитами (рис. 1а). В миоцитах отмечалось наличие участков с относительно сохранными саркомерами, которые чередовались с резко просветлёнными за счёт снижения миофибрилл и миоглобина в клетке, визуально отмечалось отсутствие поперечной исчерченности (рис. 2а). Полученные данные свидетельствуют о наличии метаболической миопатии.
а б
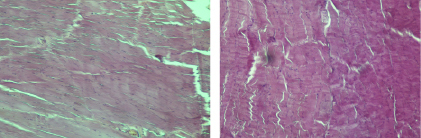
Рис. 1. а – фрагмент мышцы животного экспериментальной группы: при увеличении в 880 раз видны участки с гипотрофированными миоцитами; б – фрагмент мышцы здорового животного
а б
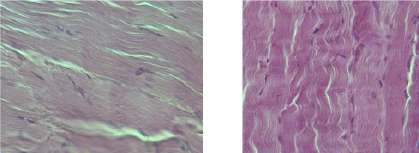
Рис. 2. а – фрагмент мышцы животного экспериментальной группы: отмечается чередование неизменённых участков с участками с резко просветлёнными саркомерами, отсутствие поперечной исчерченности; б – фрагмент мышцы здорового животного
В то же время, интересно отметить, что изменения биохимических параметров опережают структурные сдвиги, которые постепенно накапливаются в мышечной ткани.
Заключение
Полученные нами данные позволяют уточнить ход аварийных перестроек при длительном введении высокой дозы симвастатина. Как следует из полученного фактического материала, в основе деградации мышечной ткани лежит дезинтеграция как энергопродуцирующих, так и энергозависимых механизмов. Из чего следует, что дефицит энергии в мышечной ткани формирует «порочный круг» [10], в котором нарушение гомеостаза важнейших катионов приводит к изменению разности потенциалов по обе стороны мембраны, накоплению ионов Са2+, активации фосфолипаз и нарушению целостности мембран, что способствует усугублению ионного дисбаланса. Учитывая полученные результаты, можно полагать, что одним из направлений оптимизации терапии может стать разработка способов метаболической коррекции молекулярных нарушений в мышцах при агрессивной терапии статинам. Введение в схемы терапии субстратных антигипоксантов с метаболическим типом действия, например цитофлавина, за счёт высоких энерготропных свойств сукцината позволит восполнять выявленное угнетение участка дыхательной цепи на уровне СДГ-ЦХО.

