Микроспоридии – одноклеточные эукариоты, являющиеся облигатными внутриклеточными паразитами многоклеточных животных. Различные виды микроспоридий обнаружены у широкого спектра хозяев, от беспозвоночных до людей, и могут вызывать серьезные патологии вплоть до летального исхода. Так, описаны эпизоотические вспышки микроспоридиозов, имевшие серьезные экономические последствия для аквакультуры рыб и беспозвоночных. Кроме того, некоторые из них считаются потенциальной угрозой для свободноживущих популяций рыб, например, в Красном море [9, 10, и др.].
Несмотря на сравнительно высокий уровень изученности животных озера Байкал, данные о видовом составе паразитических простейших пищеварительной системы рыб до сих пор являются неполными [1, 4, 6]. Использование молекулярно-генетических методов, включающих секвенирование генов рибосомного оперона посредством выделения ДНК и амплификации, позволяет не только существенно расширить наши знания о паразитофауне рыб, но и скорректировать уже имеющиеся данные. Так, молекулярно-генетический анализ ассоциированной микрофлоры кишечника черного байкальского хариуса Thymallus baicalensis Dybowski, 1874 позволил выявить генотип Spironucleus barkhanus (Diplomonadida: Hexamitidae) [2], ранее описанный как Hexamita sp. [4].
Желтокрылка Cottocomephorus grewingkii (Dybowski, 1874) (Cottidаe) является одним из наиболее многочисленных представителей ихтиоценоза мелководной зоны Байкала. В пределах вида выделяют три разновременно нерестующих стада: мартовское, майское и августовское [5, 7]. В зависимости от сроков нереста и температурного режима у разновременно нерестующих стад желтокрылки инкубационный период развития кладок составляет от 20 до 80–90 суток [7]. С момента нереста до выхода из кладки личинок её оберегает самец: обмахивает кладку плавниками, улучшая аэрацию потоком воды, удаляет из неё погибшие икринки и охраняет кладку от хищников. В течение всего этого периода рыбы не питаются, что позволяет определять состав собственной микрофлоры их пищеварительной системы.
Целью исследования явился анализ эукариотической микрофлоры кишечника самцов желтокрылки в нерестовый период методом молекулярно-генетической детекции фрагментов генов малой субъединицы рРНК.
Материалы и методы исследования
Объектом исследования стали самцы желтокрылки в период инкубации икры. Рыб собирали на кладках с помощью легкого водолазного снаряжения в Лиственничном заливе оз. Байкал 28–31 мая (6 экз.) и 18 августа (6 экз.) 2012 г. Фрагменты кишечника свежевыловленных рыб отбирали в асептических условиях. Выделение ДНК проводили с использованием коммерческих наборов «ДНК-сорб-B» (АмплиСенс, Москва) в соответствии с рекомендациями фирмы-производителя. Полученные образцы нуклеиновых кислот анализировали методом ПЦР с использованием набора «Taq DNA Polymerase» (QIAGEN, Германия) и универсальных эукариотических праймеров DpFun 5’- GCCAGCAGCCGCGGTAATTCC и DpRUn 5’- GAGCGACGGGCGGTGTGTAC [8] в режиме 94 °C/20 сек.; 68 °C/20 сек.; 72 °C/30 сек. (35 циклов). Продукты амплификации анализировали в 2 % агарозном геле. Ампликоны длиной менее 1090 п.н. вырезали и клонировали в плазмидном векторе CloneJET™ PCR Cloning Kit (FERMENTAS, Литва). Плазмидную ДНК из выросших колоний секвенировали с использованием предлагаемых в наборе праймеров. Сравнительный анализ нуклеотидных последовательностей c международной базой генетических данных GenBank проводили с помощью программы BLAST (URL: http://blast.ncbi.nlm.nih.gov). Нуклеотидные последовательности выравнивали с помощью программы Clustal W 2.0.10. Редактирование выровненных последовательностей проводили с использованием пакета программы BioEdit. Филогенетический анализ проводили с помощью пакета программ Mega v.6.06.
Результаты исследования и их обсуждение
К настоящему времени в составе эукариотической микрофлоры, ассоциированной с пищеварительной системой керчаковых рыб оз. Байкал, зарегистрированы представители Diplomonadida, Coccidia и Microsporidia [1]. Использованные в работе праймеры позволяют амплифицировать фрагменты гена малой субъединицы рРНК всех эукариотических организмов. При этом разница в длине полученных ампликонов обеспечивает разделение фрагментов ДНК организма хозяина и кормовых объектов (около 1100 п.н.), дипломонад (около 880 п.н.) и микроспоридий (около 800 п.н.) в процессе электрофореза. В трех из проанализированных в работе образцов выявлены последовательности микроспоридий, других протистов не обнаружено. Ближайшими родственниками обнаруженных микроспоридий являются представители семейства Enterocytozoonidae: Enterocytozoon hepatopenaei из гигантской тигровой креветки Penaeus monodon Fabricius, 1798 и из белоногой креветки Penaeus vannamei Boone, 1931 с гомологией 91 %, и Enterospora nucleophila, культивированной из интестинального эпителия дорады Sparus aurata Linnaeus, 1758, с гомологией 88 % (рисунок). При этом в общую кладку с последовательностями Enterocytozoonidae из кишечника желтокрылки попали последовательности Enterocytozoon bieneusi, паразита, вызывающего системные микроспоридиозы у людей с угнетенным иммунитетом. Последовательности других представителей Enterocytozoonidae, инфицирующих рыб (Nucleospora и Paranucleospora) кластеризуются отдельно с поддержкой 100 % (рисунок).
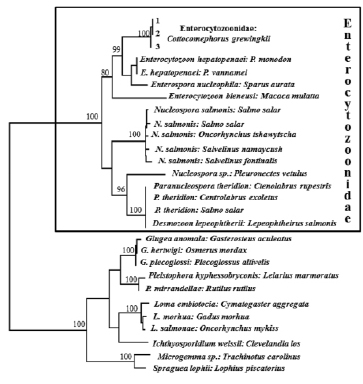
Филогенетическое древо на основании последовательностей фрагмента гена малой субъединицы рРНК длиной 780 п.н. (neighbor-joining), демонстрирующее положение микроспоридии из желтокрылки среди микроспоридий – паразитов рыб
Необходимо отметить, что ранее у рыб оз. Байкал с использованием классических паразитологических методов были отмечены только микроспоридии семейства Glugeidae: Glugea anomala (Moniez, 1887) у горбатой широколобки Cyphocottus megalops (Gratzianov, 1902) (син. Asprocottus megalops (Gratzianov, 1902)) и Glugea fennica Lom et Weiser, 1969 у налима Lota lota (Linnaeus, 1758) [1, 4].
Кроме того, у амурской широколобки Mesocottus haitej (Dybowski, 1869) и амурского подкаменщика Cottus szanaga Dybowski, 1869 описана Glugea mesocotti sp. n. [3]. G. anomala локализована в клетках подкожной и мышечной соединительной ткани, а также мезентерия [4]. В то время как ксеномы G. mesocotti sp. n. локализованы на поверхности тела рыб, на плавниках, в ротовой полости, в почках, стенке кишечника, реже в гонадах и других внутренних органах [3]. Микроспоридий семейства Enterocytozoonidae детектировали в эпителии кишечника, жабр, кожи, во внутренних органах, включая центральную нервную систему; описано размножение E. nucleophila в макрофагах и энтероцитах [10].
Представители Enterocytozoonidae биологически пластичны, способны как к цитоплазматическому, так и к внутриядерному размножению, причем иногда в конкретном организме хозяина показаны оба пути размножения паразита (например, для E. nucleophila). Кроме того, спектр хозяев Enterocytozoonidae чрезвычайно широк: от водных беспозвоночных и позвоночных животных до наземных позвоночных, включая человека (Enterocytozoon bieneusi). Для представителей Enterocytozoonidae (Paranucleospora theridion) описан трофический механизм смены хозяина между паразитическими раками Lepeophtheirus salmonis и рыбами, принадлежащими разным семействам (Centrolabrus exoletus (Linnaeus, 1758), Ctenolabrus rupestris (Linnaeus, 1758), Salmo salar Linnaeus, 1758). Принимая во внимание этот факт, сделано предположение, что способность к смене хозяина в трофической цепи (между беспозвоночными и позвоночными животными) является общей для представителей Enterocytozoonidae [10].
С учетом полученных данных и вероятности передачи микроспоридий в трофических цепях необходимо применение комплекса морфологических, ультраструктурных и молекулярно-генетических методов для дальнейших исследований представителей класса Microsporidea в других видах рыб и беспозвоночных животных озера Байкал и его бассейна.
Работа выполнена в рамках программы РАН: Проект 1.29.7. «Исследование микробиоты эндемичных керчаковых рыб (Сottoidei) озера Байкал».

