Вклад автотранспорта в суммарный выброс загрязняющих веществ в атмосферу крупных городов мира составляет более 80 %. Являясь прекрасным антидетонатором, этанол может заменить существующие высокооктановые добавки, обладающие высокой токсичностью, такие как толуол и нитробензол [1–3]. Сегодня около 2/3 всего мирового производства этилового спирта используется в качестве добавки к топливу для двигателей внутреннего сгорания и лишь около 15 % – для производства спиртных напитков.
Существует мнение, что производство этилового спирта оправдано даже в тех случаях, когда себестоимость сырья и/или выпускающего его завода высока. По прогнозам специалистов биоэтанол будет иметь преимущество перед биодизелем, так как себестоимость его производства снижается быстрее, чем биодизеля. Поскольку этанол производится из возобновляемого сельскохозяйственного сырья, он является единственным топливом, которое способствует замедлению глобального потепления. К сегодняшнему дню для продукции биоэтанола используются многочисленные источники биомассы, которые в целом могут быть классифицированы как сахара, крахмалсодержащее сырье и лигноцеллюлозная биомасса [4, 5].
Для повышения выхода конечного продукта и сокращения расходов при производстве этилового спирта большое значение наряду с бродильной активностью культур продуцентов имеют их осмотолерантность, термо- и кислотоустойчивость [6–9]. Для придания культурам требуемых характеристик используются различные подходы. S.-J. Dong с соавторами [10] показано, что клетки Saccharomyces сerevisiae перестраивают цитоплазматическую мембрану в процессе ферментации. Длительное и повторное воздействие стрессовых факторов ведет к значительным структурным перестройкам в клетках, имеющим адаптивное значение. Более изменчивая цитоплазматическая мембрана вносит вклад в более высокую устойчивость к воздействующим на нее повреждающим факторам.
Целью настоящей работы была автоселекция производственного штамма спиртовых дрожжей в полунепрерывных условиях для повышения его термо-, кислото- и осмоустойчивости.
Материалы и методы исследования
В работе использован производственный штамм спиртовых дрожжей Saccharomyces cerevisiae с повышенной бродильной активностью.
Автоселекция проведена в условиях полунепрерывного культивирования на пшеничном сусле с концентрацией сухих веществ 16,4 %. Контрольные высевы для учета количества колониеобразующих единиц (КОЕ) производили на среду Ридер (г/л: глюкоза – 10; (NH4)2SO4 – 2,1; KH2PO4 – 1,0; MgSO4 – 0,2; K2SO4 – 0,2; дрожжевой автолизат – 0,5; агар-агар – 20,0).
Для повышения осмоустойчивости использовали хлорид натрия в концентрации 8–12 %. В колбу со 100 мл сусла с добавлением NaCl вносили 5 % чистой культуры дрожжей (108 КОЕ/мл). Инкубирование проводили при температуре 30 °С. Через каждые 12 ч производили замену 80 % культуральной жидкости на чистую среду с добавлением нужного количества хлорида натрия. Через семь сливов-доливов среды в пределах одной концентрации хлорида натрия производили пересев на среду с повышенной на 1 % концентрацией соли. Для этого предварительно культуру высевали на агаризованную питательную среду Ридер. Для дальнейшего посева отбирали самые крупные колонии дрожжей, так как они отличаются наиболее высокой активностью накопления биомассы. Контролем служила исходная неадаптированная культура дрожжей, однократно культивированная на сусле с данным содержанием соли.
Пробы для контроля роста дрожжей отбирали сразу после засева и по истечении 12 ч при каждом пассаже культуры. Количество колониеобразующих единиц определяли путем высева на плотную питательную среду Ридер методом предельных разведений.
Автоселекцию штамма спиртовых дрожжей к повышенным температурам культивирования проводили на пшеничном сусле с изменением температуры от 31 °С до 40 °С. В опыте использовали адаптированную к высокому содержанию NaCl культуру. Для первого посева в колбу со 100 мл сусла вносили 5 % культуры дрожжей (108 КОЕ/мл). Замену 80 % среды осуществляли через каждые 12 часов семикратно для каждого значения температуры. Периодичность изменения температуры составляла 1 °С. Пробы для контроля роста культуры отбирали сразу после засева и по истечении 12 ч при каждом пассаже. Отбор дрожжей для каждого последующего посева с увеличением температуры культивирования проводился после высева на агаризованную питательную среду Ридер из образцов проб методом десятикратных разведений. Контролем служила исходная культура дрожжей, однократно культивированная при данной температуре.
Для автоселекции штамма спиртовых дрожжей к низким показателям кислотности среды использовали отселекционированную осмо- и термоустойчивую культуру. Культивирование вели при следующих значениях рН среды: 5,0; 4,0; 3,0; 2,5. Инкубировали при температуре 30 °С. Контролем служила исходная культура дрожжей. Эксперимент проводили по описанной выше схеме опыта.
Высевы на плотную питательную среду производили в трех повторностях. Статистическая обработка результатов исследований проведена по стандартной методике с использованием критерия Стьюдента. Для подсчета количества колоний на питательной среде уровень значимости р = 0,05.
Бродильную активность исходной и селекционной культур определяли в трубках Дунбара с отфильтрованным пшеничным суслом. Культивировали при 30 °С в течение 1 суток.
Степень использования углеводов среды исследовали на среде Ридер с 15 и 25 % глюкозы. Культивировали при 30 °С в течение 3 суток. Остаточное содержание сахара в среде определяли сахаромером.
Результаты исследования и их обсуждение
С увеличением концентрации хлорида натрия в среде от 8 до 12 % прирост биомассы спиртовых дрожжей значительно уменьшается (рис. 1).
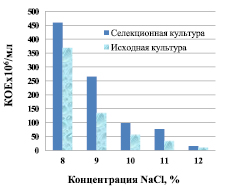
Рис. 1. Рост спиртовых дрожжей с 8–12 % хлорида натрия в среде культивирования
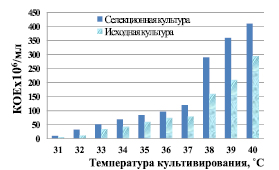
Рис. 2. Рост спиртовых дрожжей с 8–12 % хлорида натрия в среде культивирования
Так, при культивировании спиртовых дрожжей на среде, содержащей 8 % NaCl, накопление биомассы было выше на 2 порядка, чем в среде с 12 % NaCl. Количество колониеобразующих единиц составляло соответственно (4,6 ± 0,4)*108 и (9,0 ± 0,1)*106 КОЕ/мл у адаптируемой культуры и (3,7 ± 0,2)*108 и (6,7 ± 0,2)*106 КОЕ/мл у исходной.
Как видно из полученных данных, в среде с 8 % NaCl количество КОЕ селекционной культуры дрожжей выше на 24 % в сравнении с исходным штаммом. После авотоселекции в условиях полунепрерывного культивирования активность ее роста культуры на среде с 9–11 % хлорида натрия на 40–50 % выше, чем у исходного штамма.
Полученная в результате автоселекции с повышенным содержанием хлорида натрия культура использована для дальнейшей селекции с увеличением температуры культивирования.
В результате анализа данных динамики роста культуры установлено, что с увеличением температуры культивирования среды прирост биомассы увеличивается (рис. 2).
Показано, что штамм, подвергнутый автоселекции, обладает более высокой активностью роста при повышенных температурах в сравнении с исходной культурой. Наиболее велико различие в накоплении биомассы между исходной и селекционной культурами при температурах 38 ° и 39 °С.
С увеличением температуры культивирования колонии при высеве на агаризованную среду Ридер колонии дрожжей становились крупнее, исходные форма и размеры клеток при этом сохранялись.
Полученная осмо- и термоустойчивая культура дрожжей была использована для дальнейшей селекции в условиях полунепрерывного культивирования с повышением кислотности среды.
Наибольший прирост биомассы дрожжей отмечали при значении рН 5,0. С уменьшением кислотности до рН 2,5 прирост биомассы снизился на два порядка (рис. 3).
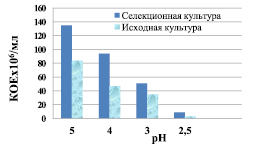
Рис. 3. Динамика роста спиртовых дрожжей в среде культивирования с рН 5,0–2,5
Выживаемость селекционной культуры при понижении рН среды значительно выше, чем у исходной культуры.
В ходе эксперимента отмечено, что при повышении кислотности среды клетки дрожжей мельчали и приобретали более округлую форму, также уменьшались размеры колоний при росте на агаризованной среде Ридер.
Таким образом, в ходе полунепрерывного культивирования получена культура спиртовых дрожжей с наиболее высокими показателями устойчивости к осмотическому, кислотному и температурному стрессам, чем исходная культура.
Отселекционированная и исходная культура проверены на уровень бродильной активности в трубках Дунбара. Бродильная активность обеих культур была высокой.
При сравнительном культивировании селекционной и исходной культур на средах Ридер с 15 и 25 % глюкозы отмечено наиболее полное потребление сахара среды отселекционированной культурой (таблица).
Сбраживание углеводов среды селекционной и исходной культурами дрожжей
|
Содержание глюкозы в среде, % |
Культура |
Остаточный сахар, % |
|
15 |
Селекционная |
3,0 |
|
15 |
Исходная |
5,0 |
|
25 |
Селекционная |
7,0 |
|
25 |
Исходная |
8,5 |
Так, если при культивировании на среде с 15 % глюкозы содержание остаточных сахаров в среде культивирования исходной культуры составляет 33 % от исходной дозы, то у селекционной культуры этот показатель снижается до 20 %. На среде с 25 % глюкозы остаточные сахара составили соответственно 34 % и 28 % от исходного содержания.
Заключение
Таким образом, в условиях полунепрерывного культивирования проведена автоселекция штамма спиртовых дрожжей с повышенной бродильной активностью. Получен вариант дрожжей, обладающий более высокими показателями осмотолерантности, устойчивости к низким значениям рН среды и высоким температурам культивирования. Снижение проницаемости цитоплазматической мембраны клеток в ходе автоселекции способствует наиболее стабильному росту культур в среде с повышенным содержанием стрессовых соединений. Сниженная клеточная проницаемость проявляется в сокращении поступления в клетки ограничивающих и угнетающих рост соединений из среды культивирования, что в итоге ограничивает торможение роста и жизнедеятельности дрожжевых клеток конечным продуктом брожения – этиловым спиртом и способствует более высокой его продукции. Повышенная осмоустойчивость также способствует более полному сбраживанию концентрированных сред при производстве этанола.
Полученная культура наряду с осмотолерантностью обладает также повышенной ацидотолерантностью и характеризуется активным ростом при высоких температурах культивирования.
Использование отобранного штамма будет способствовать снижению затрат на производство этилового спирта. Отселекционированный штамм будет использован для дальнейшей работы по интенсификации процесса получения этанола в производственных условиях.

