Электрокоагуляционные процессы наиболее полно освещены в работах В.Р. Духина, Э.К. Жалковского, В.А. Чантурии и др. [1, 7]. Авторы данных работ утверждают, что получение межфазных поверхностей в высокодисперсных гетерогенных системах связано с затратой свободной энергии поверхностного слоя. Поэтому свободная энергия образования поверхности раздела фаз всегда положительна – это является необходимым условием существования межфазных поверхностей в растворах.
Процесс электрокоагуляционного извлечения Mn (II) относится к категории процессов химического диспергирования ввиду того, что образование дисперсной фазы происходит в результате химической реакции окисления ионов Mn2+ «активным хлором» до нерастворимых форм Mn3+ и Mn4+ и последующего электрокоагуляционного осаждения коллоидных хлопьев марганца в виде дисперсной фазы. В этом случае подвод дополнительной энергии, необходимой для образования межфазных поверхностей в растворе, осуществляется за счет свободной энергии физико-химических процессов, протекающих в объеме реакционной системы [4, 5, 10].
Исходя из существующих представлений о механизме электрокоагуляции, а также на основании проведенных исследований можно предположить, что при электрокоагуляционном извлечении Mn (II) в объеме реакционной системы возможно протекание следующих физико-химических процессов [2, 7].
Процесс электрохимической коагуляции, характеризующийся взаимодействием частиц дисперсной фазы при изменении их заряда или толщины двойного электрического поля за счет изменения физико-химических свойств раствора в межэлектродном объеме или приэлектродных слоях электролизера. А именно: в результате протекания реакций окисления на аноде (анод инертный), приводящих к изменению окислительной активности электролизных растворов и реакций восстановления на катоде, приводящих к изменению рН обрабатываемых растворов:
на аноде выделяются:
– молекулярный кислород, в результате разложения гидроксид-ионов и молекул воды:
4ОН– – 4e > 2H2O + О2^
2 H2O – 4e > 4H+ + О2^
– молекулярный хлор при разряде хлорид-ионов, который затем в слабокислой и нейтральной среде гидролизуется, образуя хлорид-ионы и кислородсодержащие соединения хлора – «активный хлор»:
2Cl- – 2e > Cl2^
Cl2 + H2O > H+ + Cl- + HClO
На катоде в основном происходит образование молекулярного водорода и гидроксид-ионов в результате разряжения молекул воды и восстановления катионов водорода:
2H2O + 2e > H2 + 2OH-
2H+ + 2e > H2^
Процесс электролитической коагуляции, основные закономерности которого можно сформулировать следующим образом: присутствующие в растворе электролиты, имеющие заряд, противоположный по знаку заряду частиц дисперсной фазы, могут вызывать коагуляцию дисперсной системы. При этом следует отметить, что коагулирующая сила слабо зависит от природы коагулирующего иона, т.к. они не способны взаимодействовать с двойным электрическим слоем мицелл и разрушать стабилизирующую структуру частиц дисперсной фазы.
Процесс электростатической (поляризационной) коагуляции – диполь-дипольное взаимодействие коллоидных частиц за счет дальнодействующих сил притяжения, возникающих при наложении электрического поля. Поляризация и ориентация дисперсных частиц во внешнем электрическом поле определяются их электрическими свойствами и свойствами дисперсионной среды. Под действием поляризации может происходить поляризация самой частицы или ее двойного электрического слоя. В результате этого возникает индуцированный дипольный момент коллоидных частиц, который обусловливает их диполь-дипольное притяжение. Силовое воздействие электрического поля обеспечивает также миграцию заряженных частиц в жидкости. В первую очередь это транспорт ионов (электродиализ) и коллоидных частиц (электрофорез, электроосмос).
Процессы гидродинамической и концентрационной коагуляции заключаются в слипании взвешенных частиц за счет увеличения числа их столкновений при движении обрабатываемого раствора в электролизере и при повышении локальных концентраций дисперсной фазы в межэлектродном объеме электролизера.
Проведенные в работе экспериментальные исследования электрокоагуляционного процесса показали, что количественное извлечение Mn (II) в виде дисперсной фазы наблюдается во всем объеме электролита вследствие протекания суммы электродных процессов. Так, в процессе электролиза хлоридсодержащих растворов (при использовании нерастворимых анодов) в прианодном пространстве образуются преимущественно «активные формы хлора», которые, являясь сильными окислителями, окисляют ионы Mn2+ до нерастворимых форм Mn3+ и Mn4+. В прикатодном пространстве происходит подщелачивание обрабатываемых кислых растворов, в результате чего значения водородного показателя растворов смещаются в область рН, при которых возможно образование дисперсной фазы марганца. Полученные результаты исследований показали, что извлечение Mn (II) в виде дисперсной фазы (ε = 99,9 %) электрокоагуляционным способом возможно в диапазоне рН 4,5 – 8,5 [4, 5].
Учитывая возможные формы существования «активного хлора» в разных областях рН, а также исходя из особенностей химических превращений кислородосодержащих соединений в присутствии ионов переходных металлов, можно предположить, что процесс окисления ионов Mn2+ происходит под действием атомарного кислорода, образующегося в результате разложения хлорноватистой кислоты. Причем в реакции разложения HClO ионы Mn2+ будут выступать не только как восстановители, но и как катализаторы окислительно-восстановительного процесса [5].
Скорость реакций, протекающих с участием атомарного кислорода, зависит от кислотности среды, а именно: в щелочной среде скорость переноса кислорода в 50 раз меньше, чем в нейтральной и слабокислой средах. Кроме того, реакции, протекающие в растворах «активного хлора», относятся к типу реакций, катализируемых в слабокислой и нейтральной средах ионами Н+ и ОН–. Следовательно, процесс окисления ионов Mn2+ до нерастворимых форм с максимальной скоростью будет протекать в слабокислой и нейтральной средах, т.е. в интервале рН от 4,5 до 7,5.
При протекании процессов химического диспергирования одним из определяющих условий является достаточная концентрация окислителя в обрабатываемом растворе. Полученные в работе результаты исследований показали, что фактический расход окислителя – «активного хлора» – при электрокоагуляционном извлечении Mn (II) определяется следующим концентрационным соотношением: 1 мг (Mn2+) : 1,32 мг «активного хлора» (НСlO). При этом следует отметить, что в случае электрокоагуляционного извлечения Mn (II) окислительный процесс протекает при участии суммы окислителей, образующихся в процессе электролиза: НСlО, О•, СlО•, Сl•, ОН•, Н•, которые из-за своей термодинамической неустойчивости мгновенно вступают в реакцию с ионами Mn2+, что значительно увеличивает скорость протекания окислительного процесса.
Концентрация «активного хлора», образующегося в процессе электролиза, зависит от материала анода, исходной концентрации ионов Cl− в растворах, плотности тока на электродах, продолжительности электролиза и ионного состава растворов.
При электролизе растворов, содержащих ионы Cl–, на аноде возможно протекание реакций выделения хлора и кислорода. Для того чтобы в процессе электролиза преимущественно выделялся хлор, в работе использовался титановый анод с рутениевым покрытием, на котором Cl2 выделяется с минимальным, а О2 с максимальным перенапряжением.
Экспериментальные исследования влияния основных параметров процесса электролиза на выход «активного хлора» показали, что, исходя из экономической и экологической целесообразности, процесс электрообработки хлоридсодержащих растворов рекомендуется проводить при исходной концентрации ионов Cl− в системе не менее 600 мг/дм3. Кроме того установлено, что концентрация «активного хлора» в процессе электролиза возрастает с увеличением плотности тока, подаваемой на электроды, и времени электрообработки.
Также следует отметить, что выход по току «активного хлора» существенно зависит от исходной концентрации в обрабатываемых растворах ионов SO42– и СO32–. Данные ионы имеют примерно одинаковую с хлорид-ионами подвижность в растворах, поэтому могут одновременно разряжаться на анодах, тем самым снижая выход целевого продукта электродной реакции – «активного хлора». При этом карбонаты и гидрокарбонаты могут также окислять выделяющийся в процессе электролиза хлор. Данные утверждения подтверждаются и результатами проведенных экспериментальных исследований. Так, при исходной концентрации в обрабатываемых растворах ионов SO42– (до 2 г/дм3) и СO32– (до 0,5 г/дм3) при плотностях тока на анодах 100–300 А/м2 показатели ВТ «активного хлора» изменяются в диапазоне от 24,3 % до 37,5 % [5, 7].
Формирование твердой фазы в объеме электролита происходит при участии компонентов дисперсионной среды, которые под действием энергетического поля поверхности способны адсорбироваться на границе раздела фаз и образовывать стабилизирующие слои – мицеллы золей, структура которых обусловливает физико-химические свойства всей гетерогенной системы в целом [1, 3, 6].
Исследования фазового состава продуктов электрокоагуляционного процесса в присутствии фоновых электролитов (ионов SO42– и CO32– концентрацией 2 и 0,5 г/дм3 соответственно) показали, что основными фазами образующегося марганецсодержащего осадка являются соединения типа MnO(OH) и MnO(OH)2 (86 %), а также Mn(OH)SO4, Mn(OH)CO3, Mn(OH)SO4(H2O)2 (14 %) (рисунок, табл. 1).
Таблица 1
Фазовый состав дисперсной фазы марганца на фоне анионов SO42– и CO32–
|
Фазовый состав дисперсной фазы |
Соотношение фаз, % |
|
MnO(OH) |
62,3 |
|
MnO(OH)2 |
23,7 |
|
Mn(OH)SO4 |
7,64 |
|
Mn(OH)CO3 |
3,91 |
|
Mn(OH)SO4(H2O)2 |
1,20 |
|
Mn(OH)2CO3 |
0,56 |
|
Mn(OH)CO3(H2O)2 |
0,43 |
|
Mn2O3 + MnO2 |
0,12 |
|
MnSO4(H2O)2 |
0,11 |
|
MnCO3(H2O) |
0,03 |
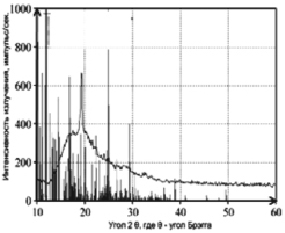
Рентгенограмма дисперсной фазы, образующейся при электрокоагуляционном извлечении Mn (II) из сульфат- и карбонатсодержащих растворов
Результаты проведенного рентгенофазного анализа (табл. 1), а также измеренные значения ξ-потенциала частиц дисперсной фазы марганца, образующихся в процессе электрокоагуляции (табл. 2), позволили схематично отобразить строение мицелл гидрозоля марганца:
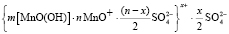
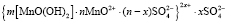
Таблица 2
Изменение величины ξ-потенциала частиц дисперсной фазы Mn (III, IV) при различных значениях рН растворов
|
рН раствора |
5,0 |
6,0 |
7,0 |
8,0 |
9,0 |
10,0 |
11,0 |
|
Величина ξ-потенциала, мВ |
+ 18 |
+14 |
+11 |
+3 |
–1 |
–12 |
–18 |
В работах С.С. Духина, Э.К. Жалковского и др. [2, 7–9] указывается на то, что самопроизвольное понижение устойчивости образующейся дисперсной системы возможно при межчастичных взаимодействиях, агрегации и сцеплении взвешенных частиц. Согласно правилу Гарди, порогу коагуляции соответствует некоторое критическое значение ξ-потенциала частиц дисперсной фазы, по абсолютной величине 20 мВ. При достижении значений менее 20 мВ силы межмолекулярного притяжения доминируют над силами электростатического отталкивания, что в итоге приводит к самопроизвольному разрушению дисперсной системы. Полученные в работе экспериментальные значения ξ-потенциала взвешенных частиц Mn (III, IV) указывают на то, что в обозначенном оптимальном диапазоне рН (4,5–7,5) возможно протекание процесса самопроизвольного разрушения дисперсной системы по механизму коагуляции, т.к. показатели электрокинетического потенциала взвешенных частиц марганца изменяются в интервале от +18 до +11.
Кроме того, воздействие однородного электрического поля на дисперсные системы приводит к поляризационному притяжению взвешенных частиц во внешнем электрическом поле, что способствует ускорению процессов формирования и осаждения коагулированной взвеси. Это явление связано с тем, что при прохождении дисперсных растворов между электродами под воздействием электрического поля возникает притяжение, которое проявляется на расстоянии, в 2–3 раза превышающем их размеры. В результате происходит частичная нейтрализация заряда дисперсных частиц, приводящая к образованию линейных цепочек-агрегатов, ориентированных вдоль поля. Из работ С.С. Духина и др.[2, 7, 9] известно, что энергия поляризационного взаимодействия существенно зависит от напряженности поля и размера частиц. Поэтому увеличение напряженности поля определяет резкое уменьшение барьера отталкивания частиц и ускорение коагуляционных процессов. Данный факт также подтверждается и при проведении экспериментальных исследований. Так, в ходе выполнения экспериментов было отмечено, что начало образования четкой верхней границы слоя осадка в случае реагентного осаждения Mn (II) электролизными растворами «активного хлора» наблюдается после 18 минут с момента начала хлопьеобразования, тогда как при электрокоагуляционном осаждении это отмечалось уже после 1,5 минут. Причем при увеличении плотности тока на электродах от 200 до 400 А/м2 время начала образования четкой границы разделения фаз сокращалось с 1,5 до 1 минуты [4, 5].
При изучении механизма формирования дисперсной фазы марганца в случае электрообработки кислых подотвальных вод учитывалась также и возможность изначального присутствия в растворах незначительного количества дисперсной фазы железа в виде Fe(ОН)3 – до 4 %.
Присутствие взвешенных частиц Fe (III) облегчает формирование и осаждение дисперсной фазы марганца, так как:
– наличие в реакционной системе компонентов дисперсной фазы позволяет формировать поверхностные структуры марганецсодержащих частиц уже в процессе их синтеза, что дает возможность получать дисперсные системы высокой степени дисперсности;
– поверхности гидроксидов железа характеризуются значительными сорбционными свойствами, вследствие чего хлопья Fe(ОН)3 будут улавливать коллоидные частицы марганца и агрегировать их;
– взвешенные частицы гидроксида железа характеризуются большой гидравлической крупностью, поэтому быстро оседают под действием силы тяжести, что также интенсифицирует процесс коагуляции.
Таким образом, проведенные исследования позволяют предположить, что процесс электрокоагуляционного извлечения Mn (II) протекает следующим образом: с повышением концентрации продуктов электрохимических реакций на электродах происходит образование мицелярной фазы Mn (III, IV). Дальнейшая электрообработка сформировавшейся коллоидной системы инициирует процесс самопроизвольного разрушения ее по механизму электрокоагуляции (преимущественно в результате диполь-дипольного взаимодействия коллоидных частиц), что приводит к ускорению процесса осаждения коагулированной взвеси.
Обобщая полученные результаты экспериментальных исследований, можно заключить, что при оптимальном подборе материала анода, варьируя основными параметрами электролиза: временем электрообработки и плотностью тока на электродах, можно полностью управлять процессом электрокоагуляционного извлечения Mn (II) из растворов в виде дисперсной фазы.

