Известно, что ионизированный кальций играет важную роль в жизнедеятельности организма. Кальций посредством кальцийзависимого белка кальмодулина регулирует разнообразные биологические процессы: секрецию инсулина, тиреоидных гормонов, гормонов надпочечников, кишечной секреции, лизосомных ферментов [3], участвует в высвобождении нейромедиаторов, клеточной пролиферации [7, 2], в синтезе простагландинов, распаде микротрубочек, лейкоцитарном фагоцитозе. Он занимает важнейшее место в функционировании центральных и периферических нейронов [3].
Ионы кальция также необходимы для нормального функционирования лимфоидной ткани. Выявлено, что гипокальциемия угнетает митотическую активность лимфоидной ткани, а гиперкальциемия, наоборот, стимулирует эту митотическую активность. В норме после нескольких циклов пролиферации лимфоцитов обычно происходит их дифференцировка, которая в целом рассматривается как процесс альтернативной пролиферации [4].
В тимусе выявлены и описаны нервные волокна, содержащие нейропептиды: вазоактивный интестинальный пептид, родственный кальцитонину [6], нейропептид Y, субстанция Р [9, 11]. В кортикомедуллярной зоне выявлены ВИП-содержащие и нейропептид SP-позитивные клетки [1]. В соединительной ткани капсулы и септ тимуса были идентифицированы SP-содержащие нервные волокна [8], которые находились в тесном контакте с тучными клетками [10]. Известны функциональные рецепторы SP на поверхности лимфоцитов, макрофагов, тучных клеток [9]. Макрофаги различных видов животных и человека имеют рецепторы для субстанции Р, которые секретируют ИЛ-1, -6, ФНОα и ПГЕ² [5].
В организме наблюдается взаимодействие эндокринной, нервной и иммунной систем. Примером такого взаимодействия нервной и иммунной систем служит влияние нейропептида – субстанции Р – на функцию макрофагов. Субстанция Р содержит 11 аминокислотных остатков, относится к семейству биоактивных пептидов или тахикининам и встречается повсеместно в центральной и периферической нервной системе [5].
Субстанция Р обладает весьма широким спектром биологической активности. Оказывает сосудорасширяющее действие, влияет на артериальное давление крови, способствует дегрануляции тучных клеток, активирует синтез и высвобождение медиаторов воспаления, увеличивает капиллярную проницаемость, является хемоаттрактантом для лейкоцитов, вызывает сокращение гладкой мускулатуры, оказывает секретогенное действие, стимулирует высвобождение пролактина [1].
В современной литературе нет данных о SP-позитивных структурах тимуса лабораторных крыс при поступлении в организм хлорида кальция с питьевой водой. Необходима морфологическая оценка нейропептидсодержащих клеток тимуса, для оценки адаптации тимуса на длительное введение кальция с питьевой водой.
Цель исследования – изучение морфологических и количественных изменений SP-позитивных структур тимуса лабораторных крыс при поступлении в организм хлорида кальция с питьевой водой.
Материалы и методы исследования
Объектом исследования явился тимус 80 белых нелинейных беспородных лабораторных крыс-самцов одного возраста и одинаковой массы (150–200 г), содержавшихся в обычных условиях при естественном освещении и сбалансированном рационе питания.
Все действия, предусматривавшие контакты с экспериментальными животными, осуществлялись согласно «Правилам проведения работ с использованием экспериментальных животных» и в соответствии с «Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях» от 18.13.1986 г.
Животные были разделены на 2 группы: первая группа – интактные (контрольные) – 40 особей, которые получали питьевую воду соответствующую требованиям ГОСТ Р 51309-99, ГОСТ Р 52109-2003, СанПиН 2.1.4. 1116-02; вторая, или опытная, состояла из 40 особей животных, которые употребляли питьевую воду соответствующую требованиям ГОСТ Р 51309-99, ГОСТ Р 52109-2003, СанПиН 2.1.4. 1116-02 с добавлением кальция 235 мг/л (вода+CaCl2). В среднем в течение суток опытные животные получали с питьевой водой 8,1–10,2 мг/кг кальция. Эксперимент длился два месяца. Выведение животных из эксперимента проводилось путем декапитации с соблюдением требований гуманности согласно правилам проведения работ с использованием экспериментальных животных «О порядке проведения эвтаназии животного» (Приказ МЗ РФ № 708н от 23.08.2010 г.).
Криостатные срезы тимуса толщиной 10 мкм обрабатывались непрямым иммуногистохимическим методом. Блок неспецифического связывания проводился преинкубацией срезов с 10 % козьей сывороткой и 0,05 % тритоном Х-100. В качестве первичных антител были использованы кроличьи поликлональные антитела против рецепторов вещества Р (rabbit polyclonal anti-Substance P receptor, 1:5000, Affnnity BioReagents, Inc, USA), вторичных антител – меченные биотилином кроличьи антитела (1:1000, goat anti-rabbit Ig G, Vector Laboratories). Для визуализации позитивного окрашивания срезы инкубировались с авидин-биотиновым комплексом (Vector Laboratories) и диамино-бензоидином. Последний дает коричневую окраску детектированным SP-позитивным структурам.
Морфометрический анализ включал определение размеров клеточных структур тимуса микроскопом МИКМЕД-5 (при увеличении объектива 40 и окуляра 10), находящихся в десяти полях зрения размером 0,04 мм2. Расчет площадей клеток производился с использованием программы «Sigma Scan Pro 5.0». О количественном распределении клеток судили по подсчету их в 10 полях зрения.
Статистический анализ полученных цифровых данных проводился с помощью программы Microsoft Office Excel с оценкой достоверности различия средних величин по t-критерию Стьюдента. Вычислялись: М – среднеарифметическая величина, σ – стандартная ошибка среднего значения, p – достоверность различия показателей подопытных групп по сравнению с контрольной группой: * – p ≤ 0,05; ** – p ≤ 0,01.
Результаты исследования и их обсуждение
У интактных животных с помощью иммуногистохимической реакции в дольках тимуса выявляются SP-позитивные структуры. SP-позитивные клетки темно-коричневой окраски четко определяются на светло-коричневом фоне лимфоидной ткани железы во всех морфофункциональных зонах. Размеры и количество SP-позитивных клеток тимуса лабораторных животных в морфо-функциональных зонах различны (рис. 1).
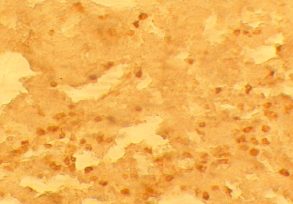
Рис. 1. SP-позитивные клетки на границе коркового и мозгового вещества тимуса животных контрольной группы. Микроскоп МИКМЕД-5. Об. 40. Ок. 10

Рис. 2. Долька тимуса животных опытной группы. Микроскоп МИКМЕД-5. Об. 40. Ок. 10. SP-позитивные тучные клетки
В субкапсулярной зоне долек железы выявляются крупные SP-позитивные клетки, по размерам и морфологическим признакам соответствуют тучным клеткам тимуса [2] (рис. 2). D. Lorton et. al., 1990 г. [9] впервые выявлены SP-рецепторы на поверхности лимфоцитов, макрофагов, тучных клеток.
Длительный прием соли кальция с водой приводит к увеличению количества SP-позитивных клеток в 1,4 раза в корковом веществе (в контроле – 57, в опыте – 80 клеток в десяти полях зрения) в 1,1 раза на границе коркового и мозгового вещества ( в контроле – 66, в опыте – 73 клеток в десяти полях зрения) и уменьшению в 1,1 раза – в мозговом веществе долек тимуса (в контроле – 65, в опыте – 56 клеток в десяти полях зрения).
Производились измерения двух диаметров всех SP-позитивных клеток, находящихся в десяти полях зрения размером 0,04 мм2. Затем методом сигмальных отклонений рассчитывались объем и площадь клеток, определялись пределы размеров малых, средних, крупных клеток. Расчет показал, что площадь малых клеток в корковом веществе тимуса животных контрольной группы составляет 23,7 до 57,5 мкм2, средних – 57,6–149,3 мкм2, больших – от 149,4 мкм2 и более. В мозговом веществе долек площадь малых клеток находилась в пределах 30,3–52,7 мкм2, средних – 52,8–139,5 мкм2, больших – от 139,6 мкм2, на границе коркового и мозгового вещества площадь малых клеток находилась в пределах от 36,7 до 54,7 мкм2, средних –54,8–134,0 мкм2, больших – от 134,1 мкм2. Так как, размер SP-позитивных клеток варьирует от 23,7 до 149,4 мкм2, можно предположить, что это могут быть как макрофаги, так и лимфоциты [9, 11].
При оценке морфологии SP-позитивных клеток тимуса животных опытной группы уменьшалось количество мелких и увеличивалось число средних клеток в мозговом, корковом веществе долек тимуса и на границе между корковым и мозговым веществом, 69,7 %, 76,3 % и 74,0 % соответственно при 66,2 %, 52,6 % и 57,6 % в контроле (табл. 1, 2, 3). Таким образом, длительное поступление солей кальция с питьевой водой приводит к уменьшению лимфоцитов SP рецепторами и увеличению SP-позитивных макрофагов во всех структурах долек тимуса.
Таблица 1
Распределение SP-позитивных клеток в корковом веществе долек тимуса с учетом их размеров (в мкм2) (контрольных и опытных животных)
|
Группа животных Размер клеток |
контрольная |
опытная |
|
маленькие: 23,7–57,5 |
15 (26,3 %) |
14 (17,5 %) |
|
средние: 57,6–149,3 |
30 (52,6 %) |
61 (76,3 %) |
|
большие: 149,4 и более |
12 (21,1 %) |
5 (6,2 %) |
|
Всего клеток: |
57 |
80 |
Таблица 2
Распределение SP-позитивных клеток в мозговом веществе долек тимуса с учетом их размеров (в мкм2) (контрольных и опытных животных)
|
Группа животных Размер клеток |
контрольная |
опытная |
|
маленькие: 30,3–52,7 |
14 (21,5 %) |
5 (8,9 %) |
|
средние: 52,8–139,5 |
43 (66,2 %) |
39 (69,7 %) |
|
большие: 139,6 и более |
8 (12,3 %) |
12 (21,4 %) |
|
Всего клеток: |
65 |
56 |
Таблица 3
Распределение SP-позитивных клеток на границе между корковым и мозговым веществом долек тимуса с учетом их размеров (в мкм2) (контрольных и опытных животных)
|
Группа животных Размер клеток |
контрольная |
опытная |
|
маленькие: 36,7–54,7 |
15 (22,7 %) |
10 (13,7 %) |
|
средние: 54,8–134,0 |
38 (57,6 %) |
54 (74,0 %) |
|
большие: 134,1 и более |
13 (19,7 %) |
9 (12,3 %) |
|
Всего клеток: |
66 |
73 |
Увеличение средних размеров клеток отразилось и на среднем диаметре SP-позитивных клеток. У животных опытной группы на границе коркового и мозгового вещества долек тимуса площадь клеток достоверно (p < 0,01) превышала таковую у контрольных животных. В корковом веществе долек тимуса, наблюдается обратная картина, площадь клеток достоверно (p < 0,01) уменьшается с 105,18 ± 9,23 мм2 до 88,09 ± 4,85 мм2 (табл. 4).
Таблица 4
Площади SP-позитивных клеток в дольках тимуса экспериментальных животных (М ± σ мкм2)
|
Морфофункциональная зона Группа животных |
Корковое вещество долек |
Мозговое вещество долек |
Граница коркового и мозгового вещества долек |
|
контрольная |
105,18 ± 9,23 |
101,43 ± 8,43 |
82,85 ± 4,31 |
|
опытная |
88,09 ± 4,85* |
115,61 ± 7,65 |
103,86 ± 5,89* |
Примечание. * – различия достоверны с контрольной группой (p < 0,01).
Анализ полученных данных показал, что поступление в организм лабораторных крыс с питьевой водой соединения кальция повышает экспрессию SP-рецепторов клетками тимуса. Об этом свидетельствует увеличение площади SP-позитивных клеток как в мозговом веществе, так и на границе коркового и мозгового вещества долек тимуса. В научной литературе имеются данные об участии SP в процессах пролиферации и дифференцировки развивающихся тимоцитов, тучных клеток и других иммунокомпетентных клеток тимуса [1]. Наши результаты исследования показали адаптационные изменения структур долек тимуса на поступление соли кальция и усиление пролиферации и дифференцировки тимоцитов.
Выводы
1. В корковом веществе долек тимуса опытной группы лабораторных крыс происходит значительное увеличение численного состава SP-позитивных клеток, вместе с тем наблюдается уменьшение их площади и объема.
2. На границе коркового и мозгового вещества долек тимуса лабораторных животных наблюдаются увеличение количества SP-позитивных клеток, укрупнение их размера и объема.

