Роговица – часть наружной капсулы глаза, она подвергается воздействию всех неблагоприятных факторов внешней среды [3]. Вероятность повреждения роговицы резко возрастает при воздействии излучений с длиной волны короче 400 и длиннее 1200 нм, т.е. в УФ и ИК частях спектра. Повреждение УФ-излучением в естественных условиях встречается у альпинистов, жителей высоких широт и горных областей при длительном пребывании или передвижении по местности, покрытой снегом. В этом случае увеличивается риск развития снежной офтальмии [1].
Глаз особенно уязвим для окислительного стресса, поскольку он не содержит защитных слоев кератина, которые присутствуют в коже. В частности, роговица и конъюнктива подвергаются более высоким уровням УФ и более высоких парциальных давлений кислорода, чем большинство других тканей. Ассортимент заболеваний, связанных с УФ-излучением, включает окулярную плоскоклеточную неоплазию, катаракту и птеригиум. Иногда на основе птеригиума может развиваться окулярная поверхностная плоскоклеточная неоплазия и инвазивная плоскоклеточная карцинома. Птеригиум считается потенциально предраковым состоянием, сходным с состоянием солнечного кератоза кожи, которое может прогрессировать до плоскоклеточной карциномы [10].
Действие УФ при длине волны равной 270 нм связано с поглощением нуклеиновых кислот. У эпителиальных клеток роговицы УФ-А ингибирует митоз, вызывает ядерную фрагментацию [6–8].
Согласно данным статистики, из всех больных, приходящих на амбулаторный прием, у каждого четвертого имеется заболевание роговицы. Социальное значение болезней роговицы объясняется не только высокой частотой развития, но и длительностью лечения, частыми рецидивами, а также снижением остроты зрения.
Несмотря на большое количество работ, посвященных влиянию УФ-радиации, до сих пор остаются не раскрытыми молекулярные механизмы и механизмы влияния на отдельные функции клетки. В своей работе мы рассмотрели влияние облучения в УФ и синей части спектра на жизнеспособность эпителиальных клеток роговицы.
Материалы и методы исследования
Исследование in vitro проводили с использованием клеточной линии SIRC – культуры эпителиальных клеток роговицы кролика (из российской коллекции клеточных культур позвоночных). Клетки культивировали в среде ДМЕМ/F12 (1:1) (ПанЭко, Россия) с добавлением 10 % эмбриональной телячьей сыворотки (Gibco) и 100 Ед/мл пенициллин/стрептомицина в атмосфере 5 % СO2. Наблюдение за морфологией, подсчет клеток и микрофотосъемка проведены с использованием инвертированного микроскопа LEITZ DMIL (Германия) и люминесцентного микроскопа «Axiovert» 200 (Германия).
Облучение клеток
Клеточная культура облучалась через сутки после посева. Предварительно перед облучением происходила замена среды на среду без сыворотки. Облучение клеток проводилось с помощью лабораторного осветителя ДРШ (Россия) (100 мВт/см2), излучение которого составляет в области 300–600 нм.
Спектральные характеристики светофильтров и световые потоки, получающиеся при их использовании, определяли с помощью автоматизированного спектрометрического комплекса на базе монохроматора МДР-41 (ЗАО «ОКБ СПЕКТР», Россия) в диапазоне от 200 нм до 1000 нм, а энергетические характеристики определяли с помощью пиранометра CMP-3 (Kipp & Zonen, Нидеpланды), обладающего постоянной спектральной чувствительностью в диапазоне от 310 нм до 2800 нм.
МТТ-тест
Определение жизнеспособности клеток проводили с использованием МТТ-теста, основанного на восстановлении бесцветной соли тетразолия (3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия бромид, МТТ) митохондриальными и цитоплазматическими дегидрогеназами метаболически активных клеток с образованием голубых кристаллов формазана, растворимого в диметилсульфоксиде (ДМСО). Количество образовавшегося формазана, определяемое колориметрическим методом после его растворения в ДМСО, характеризует интенсивность окислительно-восстановительных процессов в клеточных культурах.
Через сутки после облучения вносили по 10 мкл эффектора – раствора МТТ (5мг/мл в растворе DMEM/F12). После инкубирования в темноте в течение 3 часов при 37 С в увлажненной атмосфере 5 % СО2 жидкость удаляли, вносили по 100 мкл ДМСО. Развитие окраски регистрировали путем измерения оптической плотности при длине волны 540 нм в лунках 96-луночного планшета с помощью фотометра (BIO-RAD, США).
Наблюдение за конфлюентностью клеток
Ежедневно измерялась конфлюентность клеток – метод оценки клеточного роста (Система Сloneselect™ Imager, BioVitrum).
Измерение внутриклеточных активных форм кислорода (АФК)
После облучения клетки отмывали PBS, далее в каждую лунку вносили эффектор – раствор H2DCFDA (2’,7’-dichlorodihydro-fluorescein diacetate acetyl ester; Molecular Probes) (2 мкл H2DCFDA на 10 мл PBS). После инкубирования в течение 45 мин измерялась флуоресценция с помощью Tecan (Япония).
Анализ влияния на митохондриальный потенциал
Через сутки после облучения митохондриальный потенциал был проанализирован с помощью окраски JC1.
Анализ клеточной выживаемости
Клеточная жизнеспособность была проанализирована с помощью набора LIVE/DEAD Kit (Molecular Probes). Флуоресцения живых/мертвых клеток была зарегистрирована на люминесцентном микроскопе «Axiovert» 200 (Германия).
Результаты исследования и их обсуждение
Облучение культивируемых клеток роговицы влияет на жизнеспособность клеток по данным МТТ-теста (рис. 1). Как оказалось, даже кратковременное облучение приводит к снижению жизнеспособности клеток на 28 %. Почти наполовину (на 54 %) падают показатели жизнеспособности при наибольшей временной экспозиции.
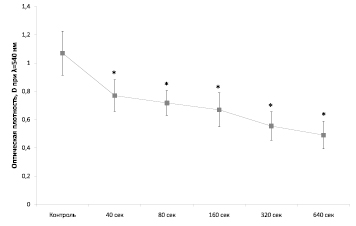
Рис. 1. Результаты выживаемости клеток SIRC по данным МТТ-теста в зависимости от продолжительности облучения. M ± sem, p ≤ 0,05 t-test
Известно, что эпителиальные клетки роговицы должны размножаться с достаточной скоростью, чтобы заменить умирающие или поврежденные клетки [5]. Облучение культивируемых эпителиальных клеток роговицы влияло на плотность клеточной культуры в течение всего периода наблюдений (рис. 2). Во всех временных экспозициях наблюдалось ингибирование роста клеток. Облучение даже незначительной дозой облучения заметно ингибировало деление клеток. При облучении свыше 160 с рост клеток так и не возобновился в течение всего наблюдаемого времени. В клетках роговицы имеется эффективный механизм репарации, световые повреждения редко долговременны, поэтому данное наблюдаемое ингибирование роста клеток скорее всего устранялось после периода наблюдений [2].
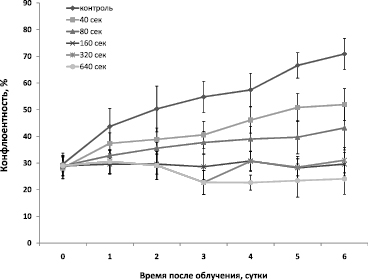
Рис. 2. Результаты конфлюентности клеток SIRC в зависимости от продолжения облучения. M ± sem, p ≤ 0,05 t-test
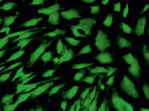
Внешний вид клеток, облученных солнечным светом в присутствии и в отсутствие фильтров, представлен на рис. 3. Флуоресцентный краситель SYTO 9 окрашивает все клетки в зеленый цвет, иодид пропидия окрашивает ядра погибших клеток в красный цвет, что позволяет подсчитать процент гибели клеток под воздействием облучения.
контроль

640 с
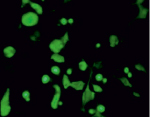
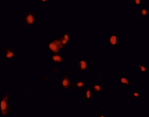
Рис. 3. Окрашивание СYTO эпителиальных клеток роговицы. Левая колонка – зеленым светятся живые клетки, правая колонка – красным светятся мертвые ядра
Облучение максимальной временной экспозицией приводит к повреждению клеток. Изменяется морфология клеток, клетки становятся более «ошаренными», большое количество клеток имеет перфорированные поврежденные мембраны (рис. 3, левая колонка), по сравнению с контролем.
Известно, что коротковолновый свет в диапазоне от 400 до 480 нм максимально поглощается хромофорами, расположенными в митохондриях [9]. Облучение клеток приводило к дисфункции митохондрий (рис. 4). Митохондриальный мембранный потенциал является важным показателем метаболической активности клеток. Отличительной особенностью ранних стадий запрограммированной клеточной смерти является нарушение активных митохондрий. Нарушение функций митохондрий включает в себя изменения мембранного потенциала и изменения окислительно-восстановительного потенциала митохондрий.
контроль
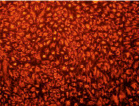
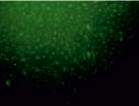
640 с
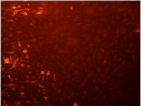
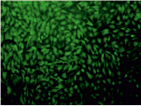
Рис. 4. Результаты окрашивания JC1 эпителиальных клеток роговицы. Левая колонка – области высокой митохондриальной поляризации отмечены красной флуоресценцией, обусловленной образованием J-агрегатов красителем. Правая колонка – деполяризованные области обозначены зеленой флуоресценцией мономеров JC-1. Представлены контроль и наибольшая временная экспозиция (640 с)
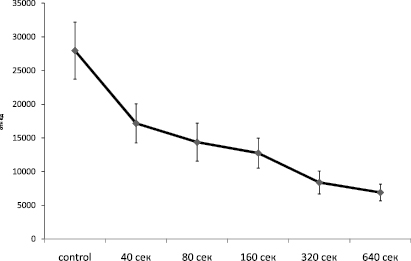
Рис. 5. Результаты облучения на генерацию АФК. M ± sem, p ≤ 0,05 t test
Источником АФК при нормальных условиях могут быть различные процессы, к которым можно отнести побочные продукты деятельности дыхательной цепи, НАДФН оксидазы, ксантин оксидазы и оксигеназы арахидоновой кислоты [4]. При облучении клеток добавляется еще один источник свободных радикалов – это радиолиз воды. Однако, по мнению многих исследователей, самым значительным из них является митохондриальная дыхательная цепь.
Как видно из рис. 5, генерация АФК с увеличением временной экспозиции падает. Несмотря на то, что образование АФК зависит от митохондриального мембранного потенциала и очевидно, что с его увеличением количество АФК генерируемых митохондрий должно увеличиваться. Однако мы получили обратные результаты, что подтверждает наши данные, что при облучении происходит гибель клеток (см. рис. 1).
Заключение
Таким образом, облучение в УФ и синей части спектра вызвало угнетение жизненно важных функций клеток эпителия роговицы. Насущной является задача изыскания средств защиты глаз от светового повреждения.
Исследование выполнено при финансовой поддержке РФФИ и Правительства Московской области в рамках научного проекта № 17-44-500740 и Гранта Президента МК-1880.2017.7.

