Лекарственные препараты (ЛП) по уровню разработки условно делятся на две категории: «одноисточниковые» (single-source) и «многоисточниковые» (multi-source). К первой относятся оригинальные ЛП, защищенные действующими патентами, ко второй – воспроизведенные (дженерики). Воспроизведенный ЛП (дженерик) – лекарственный препарат, содержащий такую же фармацевтическую субстанцию (ФС) или их комбинацию в такой же лекарственной форме (ЛФ), что и оригинальное лекарственное средство (ЛС), и поступивший в обращение после поступления в обращение оригинального ЛП [3, 4]. Отличия дженериков от оригинальных препаратов заключаются в составе и количестве вспомогательных веществ, а также в физических характеристиках действующих веществ, таких как дисперсность, строение кристаллической решётки, сольватация и др. Полиморфизм как действующих, так и вспомогательных веществ может стать причиной инактивации лекарственных средств, изменения их физических и химических свойств. Полиморфные формы одного и того же соединения различаются по показателям устойчивости, гигроскопичности и химической активности, что влияет на их фармакологическую активность [10].
При социально – значимых и широко распространенных заболеваниях чаще применяют именно дженерики. На современном фармацевтическом рынке огромную долю занимают препараты, предназначенные для профилактики и лечения заболеваний сердечно-сосудистой системы (ССС), в большинстве своём также представленные дженериками. Одним из наиболее распространённых лекарственных веществ, используемых в комплексной терапии и профилактике различных заболеваний ССС, является кислота ацетилсалициловая (Аспирин Кардио, Тромбо АСС, Кардиомагнил и др.). Кислота ацетилсалициловая также проявляет анальгезирующее, жаропонижающее, противовоспалительное, антиагрегационное свойства [5], благодаря которым является неотъемлемым препаратом каждой домашней аптечки.
Назначение препаратов кислоты ацетилсалициловой пациентам с заболеваниями ССС является обязательным и зачастую пожизненным, что при низком доходе большинства населения склоняет пациентов к приобретению именно дженериков с более низкой стоимостью. Однако низкая стоимость препарата не должна быть оправданием его низкого качества. Но помимо фармацевтического (в т.ч. химического) анализа, определяющего качественный и количественный состав препарата, необходимо проверять и биоэквивалентность дженериков, т.к. при тождественном оригинальному препарату химическом составе эффективность их может оказаться ниже. Фармакологическая активность лекарственного средства напрямую связана с технологическими параметрами производства и качеством вспомогательных веществ, которые не подвергаются контролю в фармацевтическом анализе. Поэтому обеспечение тщательного контроля качества дженериков, в том числе и биоэквивалентности различных препаратов, является важной задачей российского здравоохранения [3, 4, 7, 8], что особенно важно на фоне участившихся сообщений о случаях резистентности к кислоте ацетилсалициловой [6].
Одним из способов определения биоэквивалентности воспроизведенных препаратов является тест «Растворение» in vitro [7].
Цель данной статьи – предварительная оценка биоэквивалентности препаратов кислоты ацетилсалициловой с использованием теста «Растворение» с последующим спектрофотометрическим определением концентрации действующего вещества.
Материалы и методы исследования
Объекты исследования
Испытанию подверглись желудочнорастворимые таблетированные лекарственные формы кислоты ацетилсалициловой различных заводов-изготовителей РФ и стран СНГ. Оценку скорости и полноты высвобождения кислоты ацетилсалициловой осуществляли методом спектрофотометрии по ранее разработанной методике [2]. Все препараты соответствовали требованиям действующих нормативных документов и фармакопейных статей предприятий-изготовителей. Испытание проводилось на 10 образцах таблеток каждого препарата. Статистическую обработку полученных результатов проводили с помощью компьютерной программы Statistica 6.0 for Windows для доверительной вероятности 0,95.
Состав препаратов приведён в табл. 1.
Таблица 1
Состав препаратов кислоты ацетилсалициловой
|
№ образца |
Действующее вещество |
Вспомогательные вещества |
|
1 |
Кислота ацетилсалициловая 500 мг |
Крахмал картофельный, кислота стеариновая, кислота лимонная пищевая, тальк |
|
2 |
Крахмал картофельный, кислота лимонная пищевая, тальк, кислота стеариновая, кремния диоксид коллоидный безводный |
|
|
3 |
Крахмал картофельный, кислота лимонная пищевая, тальк |
|
|
4 |
Крахмал картофельный, кислота лимонная пищевая, тальк |
|
|
5 |
Крахмал картофельный, кислота лимонная пищевая, тальк |
|
|
6 |
Крахмал картофельный, кислота лимонная пищевая, тальк, кислота стеариновая, кремния диоксид коллоидный безводный |
Реактивы
Субстанция кислоты ацетилсалициловой (ООО «Омскреактив»), удовлетворяющая требованиям ФС.2.1.0006.15. Ацетилсалициловая кислота; натрия ацетат тригидрат (х.ч., ГОСТ 199-78, ООО «Омскреактив»); кислота ледяная уксусная (х.ч., ГОСТ 61-75, ООО «Омскреактив»); кислота хлористоводородная 0,1 М (х.ч., ГОСТ 3118-77 ООО «Омскреактив»); вода очищенная, соответствующая требованиям ФС.2.2.0020.15. Вода очищенная.
Приборы и оборудование
Исследование биоэквивалентности таблеток проводили на «Приборе для испытания таблеток и капсул на растворение» (ОО НПК «Текномеда»). Прибор состоит из стеклянного сосуда вместимостью 500 мл, мешалки и водяной бани, которая поддерживает постоянную температуру среды растворения 37,0 ± 0,5 °С.
Количественное определение кислоты ацетилсалициловой в растворе проводили на приборе СФ-2000 (Россия) в интервале длин волн от 200 до 700 нм в кюветах с толщиной слоя 1 см.
Для приготовления реактивов применяли весы аналитические OHAUS (ООО Старт) с точностью 0,0002 г.
Методика проведения испытания
Приготовление ацетатного буферного раствора: 2,99 г натрия ацетата тригидрата помещали в мерную колбу вместимостью 1000,0 мл, добавляли 500 мл воды очищенной, встряхивали до растворения, прибавляли 1,66 мл кислоты уксусной ледяной, доводили объём водой до метки. Полученный ацетатный буферный раствор имеет рН 4,5, хранится в холодильнике 1 мес.
Приготовление стандартного образца (СО) кислоты ацетилсалициловой: 0,0500 г субстанции кислоты ацетилсалициловой помещали в мерную колбу вместимостью 100,0 мл, растворяли в приготовленном ацетатном буферном растворе и доводили им же до метки; 5,0 мл полученного раствора помещали в мерную колбу вместимостью 25,0 мл и доводили до метки ацетатным буферным раствором.
Проведение теста «Растворение»: таблетку испытуемого препарата помещали в корзинку и опускали в колбу, наполненную ацетатным буферным раствором (рН 4,5), нагретым до 37,5 °С, включали вращение (100 об/мин). Пробы раствора брали через 5, 10, 20, 30, 40 и 45 минут с начала эксперимента, на 1/2 расстояния от дна сосуда до корзинки, на расстоянии не менее 1 см от стенок сосуда, объём среды растворения восполняли эквивалентно объёму пробы. Раствор пробы фильтровали через бумажный фильтр «белая лента». 5,0 мл фильтрата помещали в мерную колбу вместимостью 50,0 мл и доводили до метки ацетатным буферным раствором.
Условия проведения количественного определения методом спектрофотометрии: измерение проводили на длине волны 275 ± 2 нм, раствор сравнения – ацетатный буферный раствор.
Результаты исследования и их обсуждение
Расчёт концентрации кислоты ацетилсалициловой в пробах проводили в сравнении со стандартным раствором кислоты ацетилсалициловой (СО). Для построения кривой профиля растворения каждого образца получали 6 точек концентраций, соответствующих 6-ти временным точкам проведения теста «Растворение».
Профили растворения шести испытуемых препаратов (в % от принятой дозы 500 мг) изображены на рисунке. Разброс результатов определения в каждой серии таблеток составлял от 0,6 до 1,8 %.
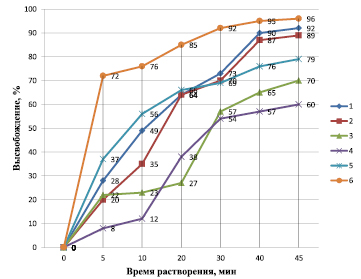
Профили растворения исследуемых препаратов
Как следует из полученных данных, препараты № 3 и № 4 не соответствуют требованиям [7] по параметру «Растворение», поскольку за 45 мин в среду растворения высвободилось менее 80 % кислоты ацетилсалициловой. Максимальную концентрацию действующего вещества через 5 мин наблюдали у препарата № 6, т.е. данный препарат является наиболее «быстродействующим» – уже через 5–10 мин после приёма препарата пациент может ощутить ожидаемый фармакологический эффект. Максимальное содержание кислоты ацетилсалициловой в растворе через 45 мин после начала эксперимента также зафиксировали у данного препарата.
В препаратах № 1 и 2 высвобождение кислоты ацетилсалициловой происходило медленнее, но через 45 мин эксперимента достигало 92 и 89 % соответственно.
Значимых различий в результатах теста «Растворение» для разных серий таблеток одного производителя выявлено не было.
Сопоставимость полученных профилей растворения ВОЗ рекомендует проводить по коэффициенту подобия (фактору подобия) f2, который оценивает подобие двух кривых профиля растворения в % [1]. Считается, что значимых различий между кривыми профилей растворения нет, если коэффициент подобия лежит в пределах от 51 до 100. Коэффициент подобия рассчитывают по формуле
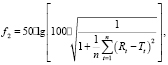
где n – число временных точек, Rt – высвобождение препарата сравнения во временной точке t, Tt – высвобождение из испытуемого препарата в точке t.
Для каждой пары исследуемых препаратов были рассчитаны коэффициенты подобия, которые представлены в табл. 2.
Таблица 2
Коэффициенты подобия для профилей растворения исследуемых препаратов
|
№ образца |
6 |
5 |
4 |
3 |
2 |
1 |
|
1 |
31 |
52 |
27 |
31 |
58 |
– |
|
2 |
26 |
45 |
31 |
34 |
– |
58 |
|
3 |
18 |
34 |
50 |
– |
34 |
31 |
|
4 |
15 |
28 |
– |
50 |
31 |
27 |
|
5 |
32 |
– |
28 |
34 |
45 |
52 |
|
6 |
– |
32 |
15 |
18 |
26 |
31 |
Из полученных данных следует, что значимых различий в профилях растворений нет для образцов 1/2 и 1/5, т.е. данные препараты имеют сходную зависимость высвобождения кислоты ацетилсалициловой во времени. Для остальных образцов различия в профилях растворения статистически значимы. Причиной таких различий может являться полиморфизм действующего вещества и состав вспомогательных компонентов в лекарственных формах.
Известно [9], что кислота ацетилсалициловая обладает полиморфизмом и встречается в разных кристаллических формах, это обусловлено различными параметрами синтеза субстанции (растворитель, скорость осаждения, перекристаллизации, изменения температуры и т.п.). Тип кристаллической решётки субстанции влияет на скорость растворения вещества в биосредах организма, т.е. влияет на биодоступность и биоэквивалентность.
Кроме того, выбранные для исследования препараты имеют некоторые отличия в составе вспомогательных веществ, что может служить причиной различий в профилях растворения представленных образцов. Таблетки с наибольшей скоростью и полнотой высвобождения действующего вещества содержат в своём составе кислоту стеариновую, которая, возможно, оказывает влияние на скорость растворения кислоты ацетилсалициловой.
Данная гипотеза может послужить темой дальнейших исследований.
Выводы
1. Показано, что для сравнения препаратов-дженериков, содержащих кислоту ацетилсалициловую, может быть использован тест «Растворение» in vitro с последующим спектрофотометрическим определением концентрации действующего вещества.
2. Получены профили растворения для каждого из шести испытуемых препаратов. Наибольшую скорость и полноту высвобождения зафиксировали у таблеток кислоты ацетилсалициловой под № 6. Два препарата не выдержали требований по тесту «Растворение» (№ 3 и 4).
3. Выдвинута гипотеза о возможном влиянии на биоэквивалентность полиморфных форм кислоты ацетилсалициловой и вспомогательных веществ, входящих в состав исследуемых препаратов.

