Создание условий для стабильного роста результатов экономической деятельности предприятия, равно как и региона, и страны, тесно связано с эффективностью внедрения различного рода инноваций. Многие исследователи посвятили свои труды решению этой задачи, однако достаточного теоретического и практического опыта в части создания инновационного потенциала предприятий по производству медицинских изделий (МИ) и приборов и внедрения результатов их деятельности не накоплено до сих пор.
В данной сфере, несмотря на обилие стандартов и нормативных документов по вопросам верификации результатов разработки МИ и государственного регулирования их обращения, нет единой концепции, которая позволила бы создать соответствующую медико-техническим задачам методологию действий инновационных коллективов в процессе научно-исследовательских и опытно-конструкторских работ (НИОКР) и внедрения полученных результатов.
Наиболее успешно разработка МИ выполняется при организации междисциплинарного взаимодействия различных заинтересованных сторон. Это могут быть узкие специалисты в области химии, физики, биологии, приборостроения, медицины и т.д. Важно, чтобы они были ориентированы на глубокое изучение потребностей современной медицинской практики и обеспечение соответствия этим потребностям параметров новых медицинских изделий, а в необходимых случаях были мотивированы на формирование новой медицинской технологии (МТ) диагностики или лечения. Принципиальным условием взаимодействия является структурирование процесса разработки МИ в соответствии с этапами инновационного цикла, которые, в свою очередь, должны иметь четко обозначенные цели – предполагаемые результаты. Кроме того, важно совместное интегрирование и повторный анализ результатов, полученных на различных стадиях, что позволит использовать только необходимые ресурсы, выстраивать компетентные диалоги участников каждого этапа работы.
В таблице приведено системное представление о процессе инновационной деятельности [1].
Основными характеристиками процесса создания и последующего применения МИ в МТ с точки зрения введенной нами методологии являются:
- системный анализ результативности действующих медицинских технологий;
- непрерывность сохранения преемственности методологии на всех этапах инновационного процесса, жизненного цикла МИ и МТ;
- обеспечение взаимодействия и обмена информацией между всеми участниками процесса обращения МИ и использования МТ: разработчиками, производителями, регулирующими органами, медицинскими организациями, пациентами;
- анализ и контроль безопасности и эффективности МИ на всех этапах «жизненного» цикла.
Обычно критерии, отражающие входные параметры для разработки и подготовки производства, определяющие организационную структуру инновационного предприятия, претерпевают существенные изменения и уточнения в процессе инновационной деятельности, проходя путь от достаточно общих утверждений до узких и специфичных требований.
Для разработчика и производителя МИ соблюдение изложенных правил методического подхода означает детерминированную этапность и системно выполняемую итеративность формирования и выполнения требований к техническим характеристикам МИ, процессам производства, дистрибуции, менеджмента качества и риска.
Цель исследования
Предлагаемая статья посвящена отдельным аспектам методологии системного и обоснованного решения задач, возникающих у инновационного предприятия при разработке и внедрении в медицинскую практику новых или модернизированных МИ.
Начало проекта – его первый этап, или «посевная стадия», имеет особое значение для инноваций в медицине. Входные данные для проведения разработки МИ могут быть получены множеством способов, в различных сферах деятельности применяют разные подходы, но чаще всего это прогнозные решения, продиктованные компетенциями авторов. С учетом этого методические подходы, на которых базируется творческий поиск проектной команды и принятие решений, а в дальнейшем будет развиваться весь инновационный проект, объединены некоторыми принципами [2]:
– принцип системности, обеспечения взаимной согласованности и непротиворечивости требований, устанавливаемых как инженерной, так и медицинской практикой;
– принцип повторяемости и стабильности, как основа качества при производстве, испытаниях и применении МИ;
– принцип непрерывности и вариантности, предполагающий непрерывный сбор информации в клиниках у конечных пользователей, а затем периодический анализ на различных этапах инновационного процесса;
– принцип специализации, требующий должной подготовки персонала на любой стадии: при разработке конструкций и технологий, в производстве и обеспечении качества, логистике и дистрибуции, применении и техническом обслуживании.
Вместе с этим важным элементом «посевной стадии», позволяющим создать адекватные медико-технические требования, является прогнозирование того, как конечный пользователь планирует использовать МИ в реальной среде применения.
Формальное исследование пользователя в реальных или моделируемых условиях должно быть неотъемлемой частью процесса разработки МИ именно на этом этапе. Проектирование с учетом эксплуатационной пригодности проводится по ГОСТ Р МЭК 62366 [3]. Его результаты направлены на достижение разумного уровня эксплуатационной пригодности, который, в свою очередь, предназначен для минимизации пользовательских ошибок и рисков, связанных с использованием.
Концептуальная схема инновационного процесса для предприятия по разработке и производству медицинских изделий
|
Этап инновационного процесса |
Содержание работы |
Результат работы |
|
Этап 1. «Посевная стадия» проекта |
Определение медицинской технологии. Разработка прототипа МИ. Эскизный проект НИОКР. Поиск бизнес-партнера |
Макетный образец, отражающий сущность технических решений. Медико-технические требования к МИ |
|
Этап 2. Технический «стартап» проекта |
Разработка рабочего проекта НИОКР. Подготовка производства опытной партии МИ. Испытания и регистрация МИ |
Проектная и конструкторская документация. Производство опытной партии МИ. Внедрение СМК и Риска |
|
Этап 3. «Стадия раннего роста и расширения» проекта |
Разработка технологии серийного производства. Создание бизнеса на базе государственно-частного партнерства |
Серийное производства МИ. Внедрение в медицинскую практику. Система логистики и дистрибуции |
|
Этап 4 и этап 5. Масштабирование проекта и устойчивое развитие |
Анализ рисков и пересмотр технических решений. Внедрение новых, модернизационных технических идей |
Модернизационные изменения МИ соответственно требованиям рынка. «Постпродакшн» |
Таким образом, формирование входных данных для разработки и обоснования закладываемых технических решений оформляется в виде «Медико-технических требований» и проходит по итеративному циклу, показанному на рисунке [3].
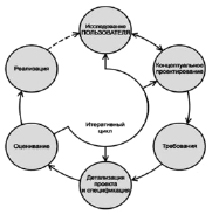
Итеративный цикл формирования входных данных для разработки
Полученные при этом требования и характеристики формируют как эксплуатационную пригодность, так и встроенную надежность МИ. Тем не менее стремление исчерпывающим образом удовлетворить пожелания всех сторон инновационного процесса в ряде случаев приводит к существенному увеличению затрат.
Предлагаемая нами методология итеративного цикла диктует необходимость повторения анализа, чтобы определить, снижается ли уровень риска и повышается ли привлекательность МИ в эксплуатации. В итоге становится возможным определение уровня необходимых и достаточных экономических затрат на управление рисками и преимуществами, возникающими при усложнении требований к МИ.
Наиболее эффективным и многократно опробованным нами методом итеративного анализа является создание «фокус-групп», способных неформально обсуждать источники рисков, особенности МТ с применением МИ и принимать значимые решения в процессе проектирования.
Второй этап – технический «стартап» проекта, предполагает завершение НИОКР и начало выпуска продукции по рабочей конструкторской и технологической документации.
Организация и проведение НИР и ОКР по созданию или модернизации МИ на этапе рабочего проекта и разработки технологии изготовления может также иллюстрироваться показанным выше циклом, включая итеративное оценивание полученных результатов непосредственно перед реализацией того или иного решения в производстве. На данной стадии проекта, предприятие-производитель еще не имеет отлаженных процессов, обеспечивающих эффективность и качество производства. В связи с этим перечень задач должен включать: завершение анализа и составление отчета о выявленных в процессе разработки рисках использования МИ, проведение всех видов испытаний и завершение государственной регистрации.
Для решения этих задач на предприятии необходимо создать «творческие группы», включающие конструктора, технолога, специалиста в области метрологии и испытаний, службы управления качеством, других необходимых специалистов, и обеспечить их взаимодействие с «фокус-группами», которые работали на предыдущем этапе. Зачастую базовые специалисты «творческих групп» уже работают с ними при решении задач предыдущей стадии. Усилиями «творческой группы» документируются результаты разработки и испытаний, формируется полный технический файл, содержание которого регламентировано приказами Росздравнадзора. Эти действия позволяют предприятию сделать вывод о том, что безопасность, эффективность и качество разработанного продукта обеспечены, следовательно, новое МИ имеет право на обращение и применение в клинической практике.
Далее предприятие переходит к третьему этапу проекта – решению задач, связанных с достижением повторяемости и стабильности характеристик МИ на основе создания и внедрения системы менеджмента качества и менеджмента риска предприятия, а также – системного анализа результативности действующих медицинских технологий с использованием нового МИ.
Подробно способы постановки и решения этих задач описаны в ГОСТ Р ИСО 9001-2015, ГОСТ ISO 13485-2011 [4, 5] и других связанных с ними стандартах. Эту тему целесообразно рассмотреть в отдельной статье. В контексте рассмотрения инновационного процесса лишь отметим, что именно на этом этапе должна быть выстроена стратегия инновационного развития предприятия, совершенствования организационной структуры, вплотную связанная с бизнес-задачами и конкурентными вопросами расширения присутствия нового МИ на рынке. Реализация стратегии развития инновационного предприятия на данном этапе обозначена нами как «Стадия раннего роста и расширения» проекта.
Задачей предприятия на данной стадии является подготовка и организация серийного производства МИ. В кратком изложении, подготовка производства заключается в следующем: в соответствии со стандартами единой системы конструкторской документации (ЕСКД) оформляется комплект конструкторской документации, затем формируется комплекс технологических процессов по стандартам единой системы технологической документации (ЕСТД), а по ним определяется технологическое оборудование и инструмент, уточняется требуемая квалификация персонала. Именно конструкторская и технологическая документация являются основополагающими информационными источниками для организации всех основных производственных процессов на предприятии.
Поскольку в зоне внимания авторов находятся в основном малые инновационные предприятия, мы обращаем внимание на сохранение преемственности методологии описанных выше этапов реализации инновационного процесса через вовлечение «творческих групп», уже включенных в процесс создания инновационного продукта, в процесс подготовки и осуществления серийного производства. Такое вовлечение позволяет сократить цикл «разработка – внедрение», поскольку конструкторская, технологическая и инструментальная подготовка производства, а также подготовка кадров ведутся практически параллельно.
Одним из важнейших результатов такого подхода становится укрепление горизонтальных связей между специалистами и подразделениями предприятия за счет активного участия значительной части производственно-технического персонала в процессе формирования и наладки серийного производства, а также в обсуждении мер по обеспечению своевременной готовности и качества серийного производства МИ. Кроме того, в работе руководителей при таком подходе устраняется доминирование оперативных проблем над задачами более высокого приоритета, что положительно отражается на эффективности управления предприятием.
В качестве примера приведем опыт создания бизнеса на базе государственно-частного партнерства как высокоэффективного механизма быстрого создания предприятия по производству медицинских изделий. В нашей практике таким примером является создание Медицинского промышленного парка. Особенностью его работы является построение интегрированных для всех резидентов систем конструирования, разработки технологий, логистики и пр., причем резиденты могут параллельно вести собственное производство и участвовать в качестве технологических партнеров в подготовке производства новых МИ, начиная с самых ранних стадий.
Экономическим преимуществом описанного решения является достаточно мягкий переход к 4 и 5 стадиям, обозначенным в нашей концептуальной схеме как «Масштабирование проекта и устойчивое развитие». Наличие развитой инфраструктуры действующих производств Медицинского промышленного парка позволяет в ряде случаев приступить к решению этих задач без существенного вложения инвестиционных ресурсов.
Не затрагивая производственную деятельность предприятия в этой фазе, остановимся на обозначенных нами целях:
- обеспечение взаимодействия и обмена информацией со всеми участниками процесса обращения МИ и использования МТ;
- анализ и пересмотр технических решений; внедрение новых/модернизационных идей.
Как указывалось выше, специфичностью описываемой здесь методологии инновационного процесса является глубокое изучение и реализация в новых медицинских изделиях потребностей современной медицинской практики, формирование новых медицинских технологий диагностики или лечения, компетентные диалоги участников каждого этапа работы.
Предполагается, что в любой ситуации действуют две группы сил: движущие и сдерживающие силы. Ситуация «силового поля», описанная К. Левиным, характерна тем, что для внедрения изменения необходимо оценить сопротивление и постараться изменить этот баланс в свою пользу. Это может быть достигнуто за счет усиления или добавления движущих сил, сокращения или удаления сдерживающих сил или комбинации этих мер. Таким образом, процесс управления изменениями заключается в своевременной диагностике силового поля и планировании действий по управлению балансом сил [6].
Представление различных стадий инновационного процесса в единой циклической модели позволяет решать и эту проблему. Если система диалогов в начале проекта по созданию нового МИ оптимальна, то масштабирование проекта идет достаточно быстро. Однако если они не поддерживаются топ-менеджментом, то постепенно начинают превалировать рутинные процессы рыночных взаимоотношений и в результате возникает рассогласование творческих и производственно-технических групп. На предприятии возникает кризис, приводящий либо к стагнации и потере конкурентных преимуществ, либо к кардинальной перестройке, имеющей чаще всего структуру нового проекта, со всеми вышеописанными целями и задачами, включая объем инвестиционных ресурсов.
При правильной организации работы по анализу информации и клинического опыта применения МИ (то, что часто называют «постпродакшн» или «информация о клиническом применении»), специалисты предприятия имеют возможность постоянно накапливать данные о пожеланиях конечных пользователей, об эффективности и безопасности и пр. За счет регулярного диалога не накапливается сопротивление ни со стороны пользователя, ни со стороны предприятия, доступен процесс небольших модернизаций, положительно влияющих на имидж предприятия.
Полученные данные, обработанные службой качества, являются отличной почвой для обсуждения теми «творческими группами» и «фокус-группами», которые являлись носителями идеи нового МИ, а также основой для модернизационных изменений в производстве. Для малого инновационного предприятия эта информация также важна с позиции риск-ориентированного мышления, которое стало базовым принципом стандарта ГОСТ Р ИСО 9001-2015.
Очевидно, что при таком алгоритме управления изменениями и модернизациями МИ, по мере реализации проекта создаются предпосылки для создания следующего проекта в виде модернизационного продукта и начала его реализации в описанной методологии. Если выполнение проекта предполагало создание новых материальных активов, то на стадии эксплуатации активов предприятие обеспечивает как внедрение модернизационного продукта, так и интенсификацию использования мощностей.
Выводы
Эффективность реализации потенциала малого инновационного предприятия в рамках предложенной модели управления основывается на строгом и осознанном соблюдении последовательности реализации задач каждого из этапов инновационного цикла разработки и организации производства МИ, вытекающем из понимания необходимости интегрирования и итеративного анализа результатов, полученных на различных стадиях.
Описанная модель может быть органично вписана в систему процедур предприятия, внедряющего систему менеджмента риска, согласно требованиям европейской Директивы 93/42, т.к. использование предлагаемых элементов методологии системного и обоснованного решения задач обеспечения качества, безопасности и эффективности инновационных МИ позволяет предприятию поэтапно структурировать указанные задачи и методы их решения в ряде специфических аспектов разработки и организации производства МИ.
Важным элементом модели является понимание руководителями и менеджментом необходимости внесения своевременных изменений в продукт и в деятельность предприятия, направленных на повышение качества и конкурентоспособности выпускаемых МИ.

