Проблема лечения последствий тяжелой черепно-мозговой травмы (ЧМТ), инсульта и ряда других нейродегенеративных процессов является наиболее сложной и социально значимой проблемой современной медицины. Более половины пациентов с тяжелой ЧМТ страдают от функциональных нарушений и когнитивных дефицитов. Первичные механизмы ЧМТ, такие как непосредственное механическое повреждение, кровоизлияние и повреждение аксонов, сопровождающиеся гибелью нейронов и глии, повреждением кровеносных сосудов и диффузной аксональной дегенерацией, приводят к возникновению сложных вторичных нарушений, включая активацию микроглии, провоспалительных цитокинов и хемокинов, нарушение гомеостаза кальция, дисфункции митохондрий и повышению уровня окислительного стресса. Показано, что активация иммунного ответа достигает максимума между 5 и 7 днями после ЧМТ и остается повышенной в течение 2 недель, что дает временной интервал для терапевтического вмешательства [1]. Наконец, ЧМТ приводит к апоптозу и ишемии ткани головного мозга и функциональному дефициту [2].
Несмотря на многочисленные исследования механизмов вторичного повреждения, фармакологические методы лечения, направленные на устранение вторичных факторов, не показали благоприятных результатов [3].
В настоящее время одним из наиболее перспективных методов терапии ЧМТ является нейротрансплантация 3D носителей из синтетических биодеградируемых биосовместимых материалов, которые бы создавали определенное микроокружение при длительном процессе восстановления нейронных сетей и поддерживали дефект до восстановления структуры ткани [4, 5]. Но оптимальное время лечения для максимизации функционального восстановления, избегая потенциально антагонистического острого, провоспалительного микроокружения, остается недостаточно изученным.
В связи с вышеизложенным на модели открытой черепно-мозговой травмы мышей линии C57BL/6 была проведена сравнительная оценка функционального состояния животных при имплантации 3D биодеградируемого скаффолда на 5 и 7 сутки посттравматического периода.
Материалы и методы исследования
Работа выполнена на 8–10 недельных мышах самцах линии C57BL/6 массой 20–22 г (n = 40). Основные правила содержания и ухода за экспериментальными животными соответствовали нормативам, данным в руководстве «Guide for care and use of laboratory animals (ILAR publication, 1996, National Academy Press)», Национальном стандарте РФ ГОСТ 33044-2014 «Принципы надлежащей лабораторной практики (GLP)» и были согласованы с этическим комитетом при ФГБОУ ВО НижГМА Минздрава России.
3D биодеградируемый скаффолд был создан с использованием микростереолитографической техники путем комбинации высокомолекулярного модифицированного хитозана (80 кДа, степень ацетилирования 0.15) (Поли[(1 → 4)-2-амино-2-деокси-β-D-глюкоза]) [6] и высокомолекулярной гиалуроновой кислоты [7], соотношение по массе 3:1.
Моделирование открытой черепно-мозговой травмы (ЧМТ) проводилось «weight-drop» способом по оригинальной методике [5, 8]. Механическую травму наносили путем падения груза с тупой поверхностью, что обеспечивает ускорение головы при минимальном локальном воздействии в точке приложения травмирующей силы. Данная модель наиболее полно воспроизводит клиническую картину тяжелого очагового повреждения головного мозга и позволяет изучать травматические изменения, сопровождающиеся вторичной гибелью нервных клеток, а также оценивать грубые двигательные нарушения, изменения тонкой координации движений, дефицит когнитивных функций [5].
В ходе эксперимента животные случайным образом были разделены на группы: первая группа – контрольные животные (PBS, 30 µl; имплантация на 7 сутки) (n = 10), вторая – контрольные животные (PBS, 30 µl, имплантация на 5 сутки) (n = 10), третья группа – имплантация скаффолда (размер 2х1 мм) на 7 сутки (n = 10), четвертая – имплантация скаффолда (размер 2х1 мм) на 5 сутки (n = 10).
Функциональными параметрами оценки трансплантации 3D биодеградируемого скаффолда являлись тестирование неврологических, когнитивных функций мышей, а также определение иммунологического статуса животных до моделирования травмы и затем через 1, 3, 4, 5 и 6 месяцев после ЧМТ.
Тест «открытое поле»
Животное помещалось в центр поля (установка Open Field LE800S, PanLab / Harvard Apparatus Испания; Stoelting, США), и за ним велось наблюдение. Видеорегистрация отдельных поведенческих реакций животных осуществлялась с помощью видеокамеры SONY SSC-G118 (Япония). Регистрация и анализ данных контролировались программой Smart v.3.0.03. (Panlab Harvard Apparatus Испания; Stoelting, США).
С целью определения нарушений ориентировочно-исследовательской и двигательной активности животных в течение 5 минут регистрировались следующие показатели поведенческой активности: горизонтальная двигательная активность ГДА: пройденное расстояние (см), длительность двигательной активности (с); скорость двигательной активности (см/с); вертикальная двигательная активность ВДА (количество стоек – подъемов на задние лапы).
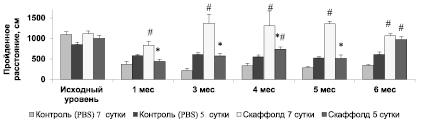
Рис. 1. Динамика изменения горизонтальной двигательной активности мышей линии C57BL/6 в посттравматическом периоде. Примечание. * – p < 0,05 по отношению к группе с имплантированием скаффолда на 7 сутки; критерий Манна – Уитни; # – p < 0,05 по отношению к контрольной (PBS) группе животных; критерий Манна – Уитни. n = 10 в каждой группе
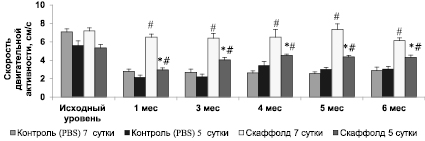
Рис. 2. Динамика изменения скорости двигательной активности мышей линии C57BL/6 в посттравматическом периоде. Примечание. * – p < 0,05 по отношению к группе с имплантированием скаффолда на 7 сутки; критерий Манна – Уитни; # – p < 0,05 по отношению к контрольной (PBS) группе животных; критерий Манна – Уитни. n = 10 в каждой группе
Тест распознавания нового объекта
Тест состоял из трех этапов: привыкание, обучение и тестирование [9]. В ходе эксперимента на этапах обучения и тестирования регистрировали совокупное время исследования знакомого и нового объектов (установка LE802S PanLab / Harvard Apparatus Испания; Stoelting). Видеорегистрация отдельных поведенческих актов поведения животных осуществлялась с помощью видеокамеры SONY SSC-G118 (Япония). Регистрация и анализ данных контролировались программой Smart v.3.0.03. (Panlab Harvard Apparatus Испания; Stoelting, США). Состояние функций памяти определяли как дискриминационное время исследования нового объекта (DIR) по формуле
Dir = [(доля времени исследования животным нового объекта – доля времени исследования знакомого объекта во время сеанса тестирования) / общее время исследования во время сеанса тестирования] х 100 [10].
Метод проточной цитофлуометрии
Иммунологический статус животных оценивали методом проточной цитометрии с помощью набора BD™ CBA Human Th1/Th2 Cytokine Kit (кат. номер 550749) для количественного определения в растворе цитокинов IL-2, IL-4, IL-6, IL- 10, TNF в одном образце на приборе BD FACSCanto II. Регистрация и анализ данных контролировались программой FCAP ArrayTM.
Результаты исследования и их обсуждение
Тест «открытое поле»
Предварительное тестирование животных не выявило различий между группами по основным поведенческим показателям.
ЧМТ приводила к нарушению структуры поведения животных, происходило снижение двигательной и исследовательской активности в сравнении с исходным уровнем (p < 0,05). Восстановления ориентировочно-исследовательского поведения не происходило ни в одной из групп мышей с ЧМТ.
Начиная с 1 месяца посттравматического периода горизонтальная двигательная активность в группе с имплантированием в очаг повреждения 3D биодеградируемого скаффолда на 7 сутки после травмы восстанавливалась и была достоверно выше, чем в контрольной группе (p < 0,05) и группе с имплантированием скаффолда на 5 сутки (p < 0,05) (рис. 1).
К 6 месяцу посттравматического периода в группе с имплантированием 3D скаффолда на 5 сутки двигательная активность также восстанавливалась до исходного уровня. Расстояние, пройденное животными за время тестирования, статистически значимо превышало показатель контрольной группы (p < 0,05) и не отличалось от аналогичного показателя группы с имплантированием скаффолда на 7 сутки (p > 0,05).
Результаты исследования показали, что скорость общей двигательной активности в обеих группах с имплантированием скаффолда в очаг повреждения (на 5 и 7 сутки после травмы) восстанавливалась к 1 месяцу посттравматического периода и была достоверно выше, чем в соответствующих контрольных группах животных (p < 0,05).
В то же время в группе с трансплантацией скаффолда на 7 сутки скорость двигательной активности была статистически значимо выше в сравнении с группой с имплантированием скаффолда на 5 сутки на протяжении всего посттравматического периода (p < 0,05) (рис. 2).
Тест распознавания нового объекта
Результаты исследования показали, что моделирование открытой тяжелой ЧМТ у животных приводит к значительным нарушениям гиппокампзависимой кратковременной памяти, что согласуется с данными литературы [5].
К 1 месяцу посттравматического периода дискриминационное соотношение времени исследования в группе с трансплантацией скаффолда на 7 сутки достоверно превышало соответствующий показатель группы с имплантированием скаффолда на 5 сутки (p < 0,05) (рис. 3). Начиная с 3 месяца дискриминационное соотношение времени исследования между опытными группами статистически значимо не различалось (p > 0,05) и было достоверно больше, чем в соответствующих контрольных группах мышей с введением в очаг повреждения раствора PBS (p < 0,05), что свидетельствует о восстановлении функций СА1-СА3 полей непространственной гиппокампзависимой кратковременной памяти распознавания.
Иммунофлюоресцентный анализ
Результаты исследования показали, что имплантирование 3D скаффолда через 1 неделю после ЧМТ снижало выраженность воспалительного процесса, так как уровень провоспалительных (TNF, IL-2, IL-6) и противовоспалительных (IL-4, IL-10) цитокинов в плазме крови мышей был достоверно ниже, чем в контрольной группе (p < 0,05) и группе с имплантированием скаффолда через 5 дней после нанесения травмы (p < 0,05) (рис. 4).
Важно отметить, что трансплантация 3D биодеградируемого скаффолда через 7 дней после ЧМТ не стимулировала аутоиммунные процессы в головном мозге животных. Концентрация цитокина IL-17A в плазме крови была статистически значимо меньше, чем в группе с имплантацией скаффолда на 5 сутки после ЧМТ (p < 0,05).
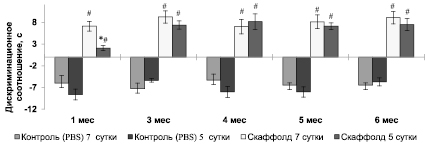
Рис. 3. Исследование функций кратковременной памяти мышей линии С57BL/6 в посттравматическом периоде. Примечание. * – p < 0,05 по отношению к группе с имплантированием скаффолда на 7 сутки; критерий Манна – Уитни; # – p < 0,05 по отношению к контрольной (PBS) группе животных; критерий Манна – Уитни. n = 10 в каждой группе
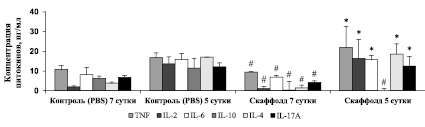
Рис. 4. Влияние времени имплантации 3D скаффолда на уровень цитокинов плазмы крови мышей в посттравматическом периоде. Примечание. * – p < 0,05 по отношению к группе с имплантированием скаффолда на 7 сутки; критерий Манна – Уитни; # – p < 0,05 по отношению к контрольной (PBS) группе животных; критерий Манна – Уитни. n = 10 в каждой группе
Заключение
Выявленные функциональные параметры жизнедеятельности мышей свидетельствовали о более выраженном нейропротекторном действии имплантации через 1 неделю после ЧМТ 3D биодеградируемого скаффолда на восстановление поведенческих и когнитивных функций животных, а также иммунного статуса, в сравнении с имплантацией скаффолда на 5 сутки после травмы.
Одним из важнейших показателей, характеризующих выраженность воспалительной реакции после перенесенной травмы, является цитокиновый спектр плазмы крови. Цитокины вырабатываются не только клетками иммунной системы, но и вспомогательными клетками, обладающими иммунной функцией, такими как астроциты и клетки микроглии, играющими важную роль в восстановлении структуры головного мозга после травмы.
Трансплантация 3D биодеградируемого скаффолда через 7 суток после травмы мозга, в отличие от трансплантации на 5 сутки, оказывала положительное действие на восстановление структуры поведения животных в отдаленном посттравматическом периоде.
Также в работе было установлено: имплантирование через 1 неделю после моделирования ЧМТ в очаг повреждения 3D биодеградируемого скаффолда, в сравнении с трансплантацией на 5 сутки, оказывало более быстрое протекторное действие на восстановление когнитивных функций мышей в посттравматическом периоде.
Кроме того, имплантирование через неделю после ЧМТ в очаг повреждения 3D биодеградируемого скаффолда, в отличие от трансплантации скаффолда на 5 сутки посттравматического периода, снижало выраженность воспалительного процесса и не стимулировало аутоиммунные процессы в головном мозге при черепно-мозговой травме по уровню цитокинов крови в посттравматическом периоде.
Таким образом, имплантирование 3D скаффолда на 7 сутки после ЧМТ является наиболее оптимальным временем для дальнейшего функционального восстановления животных.

