Культивирование клеток часто используется в биологии и медицине. Культуры клеток используются в фундаментальной биологии, в биотехнологии как продуценты различных биологически активных веществ. Широко распространены также фармакологические исследования, в которых клетки, выращиваемые в культуре, служат модельным организмом для исследования воздействия различных лекарств [1]. Наиболее распространенным способом культивации клеток является их выращивание в питательной среде, на различных, как правило, пластиковых подложках. При этом клетки вносятся в среду в виде суспензии и в дальнейшем они закрепляются на подложке.
Однако сейчас активно развиваются методики не только культивирования однородных клеток, но и культивирования тканей, состоящих из разных клеток [2]. Для этого важно иметь способы контролируемого распределения клеток по площади. В настоящее время возможно применение методов 3Д-печати [3]. Для этого используются специализированные 3Д-принтеры, которые способны распределять живые клетки с микронной точностью, либо на двумерной подложке, либо в геле, позволяющем создавать трехмерные культуры. Использование нескольких экструдеров или одного экструдера, в котором смешиваются различные культуры, позволяет печатать сложные ткани, состоящие из нескольких разновидностей клеток.
Однако 3Д-биопринтинг довольно дорог и, как правило, используется не в клинических задачах, а для создания различных имплантов. Для фармакологических исследований более оптимальным является использование органоидов – небольших образований из тысяч – десятков тысяч разнородных клеток, способных частично выполнять функции какого-либо органа. Для создания органоидов разрабатываются методы, основанные на магнитном распределении клеток [4]. Например, в статье [5] авторы формировали модель рака груди из клеток опухоли и клеток фибробластов, которые были специфически связаны с полистироловыми сферами, содержащими наночастицы оксида железа. Предварительно в магнитном поле в органоид собирались клетки опухоли, движимые магнитными частицами, потом вторым слоем клетки фибробластов. Авторы показали, что влияние цитостатиков на культуры, выращенные методом магнитного культивирования, можно более достоверно сравнивать с реальной опухолью, чем обычную 2Д-культуру.
Ключевыми параметрами магнитных частиц, применяемых в магнитоуправляемом культивировании клеток, являются низкая токсичность и высокий магнитный момент, позволяющий манипулировать клетками, содержащими магнитные частицы, не вызывающие токсического действия. Настоящая работа посвящена изучению возможности использования оригинальных магнитных наночастиц – нанокомпозитов Fe@C, представляющих собой железное ядро, покрытое углеродной оболочкой. В данной работе используется модификация аминогруппой -NH2 и карбоксильной группой -COOH. Целью работы было создание и опробование простой магнитной системы для локализации клеток на подложке и определение концентрации магнитных частиц в клетках, с одной стороны, достаточной для обеспечения чувствительности к магнитному полю и, с другой стороны, еще не приводящей к токсическим эффектам.
Материалы и методы исследования
Металл-углеродные наночастицы Fe@C синтезировались газофазным методом, описанным в работе [6]. В потоке инертного газа, содержащего углеводородный прекурсор (бутан), высокочастотным переменным магнитным полем разогревалась до температуры порядка 2100 °С железная затравка, что приводило к её постепенному испарению. Бутан каталитически разлагался на конденсированных наночастицах металла, образуя углеродную оболочку, покрывающую железное ядро [6]. Далее наночастицы охлаждались и улавливались тканевым фильтром.
Для модификации поверхности металл-углеродных наночастиц Fe@C применена модифицированная методика с использованием арил-диазониевых солей [7, 8] 4-аминобензиламина или 4-аминофенилуксусной кислоты для модификации аминогруппой и карбоксильной группой соответственно.
Перевиваемая клеточная линия HeLa была получена из Российской коллекции клеточных культур позвоночных института цитологии РАН (Россия, Санкт-Петербург). Культуру клеток поддерживали в пластиковых культуральных флаконах, в среде DMEM c добавлением 10 % эмбриональной телячьей сыворотки и 50 мкг/мл гентамицина, в инкубаторе при +37 °С, в атмосфере, содержащей 5 % СО2. Цитотоксичность анализировалась при помощи МТТ теста. Клетки пересевались в 96-луночный планшет и культивировались в течение суток до концентрации примерно 105 клеток/мл, после чего к ним добавлялась суспензия наночастиц в дистиллированной воде. В качестве контроля соответственно использовалась дистиллированная вода. Через 72 часа инкубации среда менялась на чистую и добавлялся метилтиазолилдифенил-тетразолиум бромид (МТТ) в концентрации 1 мг/мл, инкубация с красителем осуществлялась в течение 4 часов. Интенсивность окраски определялась с помощью планшетного фотометра на длине волны 540 нм, заключение о количестве жизнеспособных клеток делалось путем сравнения интенсивности оптического поглощения клеток бывших в эксперименте с интенсивностью оптического поглощения в контроле.
Исследование токсичности также проводилось при помощи проточного цитометра Beckman Coulter FC-500 (использовался тест на апопотоз и некроз с антителами к аннексину, конъюгированными с FITC и ядерным красителем 7-AAD). Для исследования клетки, проинкубированные в течение суток, с разными концентрациями железо-углеродных наночастиц, промывались фосфатным буфером, отщеплялись от планшета при помощи раствора трипсина-Версена и ресуспендировались в чистой питательной среде. Далее анализ осуществлялся по стандартному протоколу для исследования апоптоза/некроза.
Захват клетками наночастиц детектировался при помощи оптической микроскопии, а также при помощи проточной цитометрии (проточный цитометр Beckaman Coulter-FC-500). Для этого инкубированные с наночастицами клетки смешивались в суспензии с контрольными клетками, после чего смесь клеток анализировалась на проточном цитометре. Контрольные клетки брались для определения нормального уровня гранулярности. Количественное изучение накопления наночастиц в клетках производилось при помощи ЯМР-релаксометрии культуральной среды, содержащей наночастицы, не связавшиеся с клетками. Перед инкубацией с наночастицами клетки рассевали в 24-луночные культуральные планшеты, где они росли 24 часа до достижения состояния монослоя. Инкубирование с наночастицами проводили при 37 °С. К клеткам добавляли водную суспензию MNPs, предварительно подвергнутую ультразвуковой обработке для максимальной однородности. Концентрированную суспензию добавляли в среду капельно, после чего ее тщательно перемешивали. Пробы культуральной среды с диспергированными в ней наночастицами отбирались после внесения частиц в среду через 15 минут, 24 часа и 48 часов, после чего анализировались при помощи ЯМР-релаксометра по методике, описанной в [9].
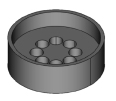


а б в
Рис. 1. а) конструкция держателя, б) конфигурация магнитного поля над магнитами на расстоянии 2 мм, более светлая окраска соответствует большей величине поля, в) распределение клеток с магнитными частицами в культуре. Скопления клеток видны как темные области
Для изготовления магнитной системы были использованы коммерчески доступные магниты Nd-Fe-B диаметром 7 мм и высотой 10 мм, намагниченные вдоль оси. Держатель представлял собой диск с углублением, в которое вставлялась чашка Петри для инкубирования клеток (рис. 1, а). Восемь магнитов размещались на окружности диаметром 20 мм по схеме (-N-S-N-S-).
Клетки предварительно выращивались в культуральном флаконе до достижения 80–90 % конфлюентности, после чего в среду добавлялись магнитные наночастицы до концентрации 0,05 мг/мл. С наночастицами клетки инкубировались в течение суток, после чего промывались фосфатным буфером и чистой культуральной средой. Далее клетки трипсинизировались и переносились в чашку Петри, которая устанавливалась в магнитную систему. Распределение клеток в магнитном поле анализировалось через двое суток.
Результаты исследования и их обсуждение
При помощи МТТ-теста была установлена низкая токсичность металл-углеродных наночастиц, как карбоксилированных, так и аминированных. Не было выявлено достоверных отличий от контроля при концентрации наночастиц в питательной среде до 1 мг/мл. Однако необходимо отметить, что МТТ-тест – это спектроскопический метод исследования, суть которого состоит в анализе светопропускания на определенной длине волны, при этом металл-углеродные наночастицы сами поглощают свет в широком диапазоне длин волн, следовательно, могут давать погрешность в определении жизнеспособности клеток таким методом. В качестве второго метода контроля жизнеспособности клеток была выбрана проточная цитометрия, основанная на анализе флуоресценции, в которую железо-углеродные наночастицы не должны вносить никакого вклада. Методом проточной цитометрии было показано отсутствие токсического эффекта при концентрации железо-углеродных наночастиц в питательной среде до 5 мг/мл.
Накопление наночастиц в клетках анализировалось при помощи оптической микроскопии. В среде наночастицы не видны, так как их размер ниже дифракционного предела, однако в клетках они концентрируются, накапливаясь в лизосомах [10], что позволяет увидеть агрегаты частиц. Наши эксперименты показали, что клетками поглощаются только аминированные железо-углеродные наночастицы (рис. 2), захват карбоксилированных частиц не был зафиксирован.
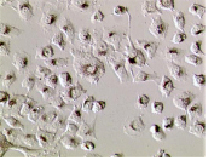
Рис. 2. Оптическая микроскопия культуры клеток HeLa, инкубированных с магнитными наночастицами Fe@C-NH2 . Темные области внутри клеток – скопления частиц
Анализ накопления наночастиц в клетках также проводился при помощи проточной цитометрии. Анализ осуществлялся по так называемому каналу бокового рассеяния, обычно применяемому для анализа гранулярности клеток. Наночастицы, кластеризованные в цитоплазме, усиливали гранулярность клетки, что отчётливо было видно в сравнении с чистыми клетками, как показано на рис. 2. При анализе методом проточной цитометрии также был зафиксирован захват только аминированных наночастиц, при этом не наблюдалось, так же как и методом оптической микроскопии, существенного количества клеток, не содержащих наночастицы.
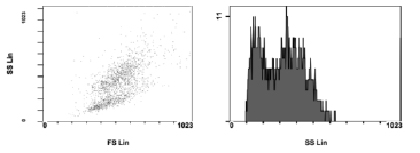
Рис. 3. Двухмерное (данные бокового и прямого светорассеяния) и одномерное (данные бокового светорассеяния) распределение клеток по данным проточной цитометрии. Анализировалась смесь из контрольных клеток и клеток содержащих наночастицы Fe@C-NH2
Количественное исследование накопления железо-углеродных наночастиц проводилось с использованием метода ЯМР-релаксометрии [9]. Анализировалась остаточная концентрация магнитных наночастиц в среде. Достоверно было показано, что концентрация частиц уменьшается в среде только для аминированных наночастиц, при этом в клетках в первые сутки накапливается порядка 25 % от всех наночастиц в среде и ещё 25 % накапливается за вторые сутки. По оценке, сделанной из ЯМР измерений, концентрация наночастиц составляла не более чем 25–30 пкг на клетку. Таким образом, для магнитного распределения клеток в культуре было принято решение нагружать их аминированными железоуглеродными наночастицами.
В магнитном поле клетки с частицами должны двигаться в области с максимальным полем и локализоваться вблизи минимума градиента магнитного поля. Расчет поля в плоскости, расположенной на расстоянии 1 мм от плоскости полюсов магнитов, показал, что в данной конструкции области с максимальной напряженностью горизонтальной компоненты поля (3 кЭ) располагаются между ячейками с магнитами (рис. 1, б). Серым цветом обозначены области, где поле несколько меньше – эти области обрамляют каждый магнит. Эксперимент показал, что клетки скапливались и росли не только в областях с максимальным полем, но и на связывающих их дугах (рис. 1, в). Видимо, формирование концентрационных пятен в виде дуг связано с тем, что значительная часть клеток с частицами при движении попадает в локальные максимумы поля и минимума градиента. Наличие таких локальных максимумов выявил и более тщательный расчет топологии магнитного поля. Таким образом, даже при концентрациях на два порядка меньше, чем максимальная из проверенных на цитотоксичность, клетки с железо-углеродными наночастицами могут быть сконцентрированы магнитным полем относительно простой магнитной системой в определенных участках на подложке в удовлетворительном соответствии с магнитостатическими расчетами. В дальнейшем планируется оптимизация методики для достижения оптимального роста клеточных органоидов, состоящих из нескольких разных клеток, а также разработка конфигурации поля и магнитной системы для достижения магнитной левитации клеток на границе раздела жидкость – газ.
Заключение
1. Методами оптической микроскопии и проточной цитометрии было зафиксировано накопление наночастиц в клетках. Было показано, что наиболее эффективно захватываются клетками аминированные наночастицы Fe@C-NH2.
2. Показана низкая токсичность магнитных наночастиц Fe@C для клеток культуры HeLa.
3. Продемонстрировано, что при использовании простой магнитной системы можно целенаправленно локализовать область прикрепления и последующего роста клеток.
Работа выполнена в рамках государственного задания ФАНО России (тема «Магнит», № 01201463328) и проекта № 15-9-24-10 Комплексной программы; разработка и изготовление релаксометра финансировались за счет гранта РНФ № 17-15-01116.

