N-замещенные производные пиримидиновых оснований зарекомендовали себя в качестве «привилегированных молекул», проявляющих разнообразную фармакологическую активность, в том числе противовирусную [1], противоопухолевую [2] и антибактериальную [3]. Ранее среди N-бензилпроизводных 5-(фениламино)урацила был выявлен ряд соединений, эффективно подавляющих репликацию ВИЧ-1 и герпесвирусов [4]. В продолжение этих исследований нами осуществлен синтез новых N-бензилпроизводных 5-(фениламино)урацила, содержащих бензофеноновый фрагмент в составе боковой цепи, который обеспечивает, как нами было показано ранее [5], эффективное связывание производных урацила с аллостерическим сайтом обратной транскриптазы ВИЧ-1.
Синтез N1-моно- и N1,N3-дибензилзамещенных производных 5-(фениламино)урацила (1) был основан на разработанном нами методе N-алкилирования триметилсилилпроизводных пиримидиновых оснований алкилгалогенидами с невысокой реакционной способностью [6] (схема).
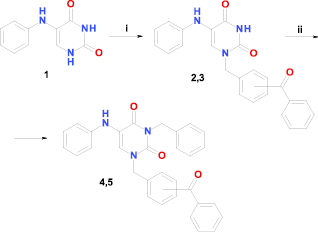
Синтез N-бензилпроизводных 5-(фениламино)урацила. Условия и реагенты: i) ГМДС, NH4Cl, кипячение, 1 ч; бензоилбензилбромид, 1,2-дихлорэтан, кипячение, 20 ч; ii) бензилхлорид, К2СО3, ДМФА, 80–85 °С, 2 ч
Кипячение исходного 5-(фениламино)урацила (1) в избытке гексаметилдисилазана в присутствии каталитического количества аммония хлорида в течение 1 ч приводит к образованию прозрачного раствора, упаривание которого в вакууме с количественным выходом дает триметилсилилпроизводное 5-(фениламино)урацила. Однако, в отличие от триметилсилилпроизводных урацила, тимина или 6-метилурацила, производное 5-(фениламино)урацила быстро и полностью кристаллизуется при охлаждении, что свидетельствует о его более высокой полярности. Методом спектроскопии ЯМР было установлено, что экзоциклическая аминогруппа 5-(фениламино)урацила (1) не подвергается силилированию, и полученный продукт представляет собой 2,4-ди(триметилсилилокси)-5-фениламинопиримидин. Тем не менее, триметилсилилпроизводное 5-(фениламино)урацила легко растворяется в малополярном 1,2-дихлорэтане, что способствует успешному селективному N1-алкилированию этого соединения.
Взаимодействие триметилсилилпроизводного 5-(фениламино)урацила с бензоилзамещенными бензилбромидами протекает в течение 20 ч при кипячении их раствора в 1,2-дихлорэтане с защитой от влаги воздуха. Выход целевых 1-(бензоилбензил)производных 5-(фениламино)урацила (2, 3), составляющий 46–51 %, можно считать достаточно высоким, поскольку алкилирующие агенты не выделялись в индивидуальном состоянии и не подвергались очистке.
Заключительное N3-бензилирование соединений 2 и 3 бензилхлоридом, приводящее к дибензилпроизводным 5-(фениламино)урацила (4, 5), протекает в «классических» условиях – при нагревании в среде безводного диметилформамида в присутствии карбоната калия, что обеспечивает удовлетворительный (69–74 %) выход конечных продуктов.
Спектры ЯМР регистрировали на спектрометре Bruker Avance 600 (600 МГц для 1H и 150 МГц для 13C) в ДМСО-d6. Температуры плавления измерены в стеклянных капиллярах на приборе Mel-Temp 3.0 (Laboratory Devices Inc., США).
1-(3-Бензоилбензил)-5-(фениламино)урацил (2). К кипящему раствору 5,0 г (25,5 ммоль) 3-бензоилтолуола в 50 мл безводного тетрахлорметана при интенсивном освещении светом видимого диапазона добавляют в течение 30 мин раствор 4,5 г (28,2 ммоль) брома в 25 мл тетрахлорметана, кипятят с защитой от влаги воздуха 4 ч, растворитель отгоняют в вакууме водоструйного насоса на кипящей водяной бане и получают продукты бромирования в виде вязкого янтарного масла. Смесь 5,0 г (24,6 ммоль) 5-(фениламино)урацила, 50 мл гексаметилдисилазана и 0,05 г хлорида аммония кипятят с защитой от влаги воздуха в течение 1 ч до образования прозрачного раствора, избыток гексаметилдисилазана удаляют в вакууме, остаток растворяют в 50 мл безводного 1,2-дихлорэтана, добавляют раствор продуктов бромирования в 50 мл 1,2-дихлорэтана и кипятят в течение 20 ч. Охлаждают, добавляют 10 мл воды и 2 мл концентрированного гидроксида аммония, перемешивают, выдерживают при температуре 0–5 °С в течение суток, образовавшийся осадок отфильтровывают, промывают 25 мл холодного 1,2-дихлорэтана водой, сушат на воздухе, дважды кристаллизуют из 95 % этилового спирта и получают 4,35 г золотистого игольчатого кристаллического вещества, выход 46 %, т. пл. 179–181,5 °С.
Спектр ЯМР 1Н, δ, м. д.: 5,00 с (2Н, СН2); 6,65–7,76 м (14 Н, арил, NH); 7,81 с (1Н, H6); 11,63 с (1Н, NH).
Спектр ЯМР 13С, δ, м. д.: 53,40; 117,81; 120,22; 121,54; 131,96; 132,00; 132,24; 132,37; 132,45; 133,05; 135,28; 136,19; 138,07; 140,18; 140,59; 141,06; 149,01; 153,35; 165,18; 198,86.
1-(4-Бензоилбензил)-5-(фениламино)урацил (3) получают аналогично из 4-бензоилтолуола. Золотистое пластинчатое кристаллическое вещество, выход 51 %, т. пл. 196,5–198,5 °С.
Спектр ЯМР 1Н, δ, м. д.: 5,03 с (2Н, СН2); 6,66–7,76 м (14 Н, арил, NH); 7,74 с (1Н, H6); 11,59 с (1Н, NH).
Спектр ЯМР 13С, δ, м. д.: 53,53; 118,03; 120,43; 121,67; 130,81; 131,94; 132,23; 132,95; 133,41; 136,05; 137,58; 139,67; 140,40; 145,29; 148,90; 153,32; 165,17; 198,73.
1-(3-Бензоилбензил)-3-бензил-5-(фениламино)урацил (4). Смесь 1,0 г (2,52 ммоль) 1-(3-бензоилбензил)-5(фениламино)урацила (2) и 1,0 г (7,24 ммоль) тонко измельченного безводного карбоната калия в 25 мл безводного диметилформамида перемешивают при температуре 80–85 °С в течение 30 мин, добавляют 0,35 мл (3,04 ммоль) бензилхлорида и перемешивают при той же температуре в течение 2 ч. Охлаждают, фильтруют, фильтрат упаривают в вакууме, остаток растирают с 10 мл воды, выдерживают при температуре 0–5 °С в течение суток, образовавшийся осадок отфильтровывают, промывают водой, сушат на воздухе, кристаллизуют из метилового спирта и получают 0,85 г лимонно-желтого кристаллического вещества, выход 69 %, т. пл. 122–124,5 °С.
Спектр ЯМР 1Н, δ, м. д.: 5,04 с (2Н, СН2); 5,08 с (2Н, СН2); 6,65-7,76 м (20Н, арил, NH); 7,94 с (1Н, H6).
Спектр ЯМР 13С, δ, м. д.: 47,59; 54,67; 117,90; 119,63; 121,69; 130,57; 130,85; 131,71; 131,96; 131,98; 132,28; 132,39; 132,47; 133,04; 135,30; 136,22; 137,22; 140,14; 140,39; 140,62; 140,82; 148,96; 153,47; 163,24; 198,83.
1-(4-Бензоилбензил)-3-бензил-5-(фениламино)урацил (5) получают аналогично из 1-(4-бензоилбензил)-5-(фениламино)урацила (3). Светло-желтое кристаллическое вещество, выход 74 %, т. пл. 135–137,5 °С.
Спектр ЯМР 1Н, δ, м. д.: 5,07 с (2Н, СН2); 5,11 с (2Н, СН2); 6,68-7,76 м (20Н, арил, NH); 7,88 с (1Н, H6).
Спектр ЯМР 13С, δ, м. д.: 47,67; 54,81; 118,15; 119,89; 121,84; 130,58; 130,83; 130,99; 131,71; 131,94; 132,28; 132,95; 133,41; 136,07; 136,62; 139,73; 140,38; 140,42; 145,05; 148,82; 153,48; 164,27; 198,71.
Противовирусная активность новых соединений 2–5 in vitro была изучена в Рега институте медицинских исследований (Католический университет, Лёвен, Бельгия). Обнаружено, что 1-(3-бензоилбензил)-5-(фениламино)урацил (2) проявляет умеренную активность в клеточной культуре HEL в отношении различных герпесвирусов: цитомегаловируса человека (герпесвирус человека типа 5) и вируса ветряной оспы / опоясывающего лишая (варицелла-зостер вирус, герпесвирус человека типа 3) при невысокой цитотоксичности. Интересно отметить, что активность этого соединения в отношении штамма вируса варицелла-зостер, не кодирующего тимидинкиназу (TK- VZV, штамм 07-1), была значительно выше, чем в отношении вируса, кодирующего этот фермент (TK+ VZV, штамм OKA), в то время как для других противогерпетических агентов, в частности ацикловира, обычно наблюдается обратная закономерность. Это позволяет сделать предположение о том, что соединение 2 является ненуклеозидным ингибитором репликации вируса варицелла-зостер. Остальные соединения 3–5 не продемонстрировали заметной противовирусной активности в отношении указанных герпесвирусов (таблица).
Ни одно из новых соединений 2–5 не проявило активности in vitro в отношении других ДНК- и РНК-содержащих вирусов: вируса герпеса простого типа 1 и типа 2, вируса оспы, аденовируса, коронавируса, вируса везикулярного стоматита, Коксаки вируса, респираторно-синцитиального вируса, вируса парагриппа, реовируса, вирусов Синдбис, Пунта Торо и желтой лихорадки, вирусов гриппа A/H1N1, A/H3N2 и B. Очевидно, что наличие, спектр и уровень противовирусного действия соединений этого ряда в значительной степени определяется характером замещения в бензильном фрагменте при атоме азота N1 пиримидиновой системы, тогда как введение второго бензильного заместителя к атому азота N3 приводит к потере противовирусной активности.
Противовирусная активность синтезированных соединений in vitro
|
Соединение |
Противовирусная активность, ИК50, мкг/млa |
Цитотоксичность, ЦК50, мкг/млb |
|||
|
Цитомегаловирус |
Варицелла-зостер вирус |
||||
|
Штамм AD-169 |
Штамм Davis |
Штамм OKA |
Штамм 07-1 |
||
|
2 |
1,64 |
1,64 |
11,14 |
1,92 |
91,72 |
|
3 |
> 20 |
> 4 |
> 20 |
5,52 |
> 100 |
|
4 |
> 100 |
> 20 |
> 100 |
> 100 |
> 100 |
|
5 |
> 100 |
> 20 |
> 100 |
> 100 |
> 100 |
|
Ганцикловир |
0,58 |
0,16 |
– |
– |
> 100 |
|
Ацикловир |
– |
– |
0,16 |
1,59 |
> 100 |
Примечание. аИК50 (ингибирующая концентрация) – концентрация вещества, обеспечивающая подавление репликации вируса на 50 %; bЦК50 (цитотоксическая концентрация) – концентрация вещества, при которой наблюдается подавление роста 50 % клеток.
Таким образом, нами получен ряд новых производных 5-(фениламино)урацила, содержащих бензофеноновые фрагменты в положении N1 пиримидиновой системы. Целесообразен дальнейший поиск высокоселективных ингибиторов вирусной репродукции для лечения заболеваний, вызываемых цитомегаловирусом человека и вирусом ветряной оспы / опоясывающего лишая на основе соединений этого ряда.
Авторы выражают глубокую благодарность проф. R. Snoek и проф. G. Andrei (Rega Institute for Medical Research, Leuven, Belgium) за широкий противовирусный скрининг полученных соединений.

