В последние годы накапливается всё больше информации о роли Se в регуляции процессов канцерогенеза [1–4]. Наиболее распространенным соединением Se, рассматриваемым в качестве потенциального противоракового агента, способного индуцировать образование активных форм кислорода (АФК) в опухолевых клетках, торможение их роста, влиять на экспрессию проапоптотических генов и др., является SS [1, 5, 6]. Кроме того, Se является компонентом 25 селенопротеинов млекопитающих, которые могут выступать как в качестве опухолевых супрессоров, так и обладать онкогенными свойствами [3], участвовать в поддержании оптимального антиоксидантного статуса в клетке, а также в регенерации и активации низкомолекулярных антиоксидантов (Q10, витаминов С и Е и др.). Поскольку одной из причин развития рака является усиление окислительного стресса в клетках, соединения селена рассматривают в качестве противоопухолевых агентов, однако этот эффект в значительной степени зависит от дозы и химической специфики. Известно, что более половины селенопротеинов млекопитающих обнаружены в семенниках, тогда как три из них (SELV, TGR и GPX4) локализуются и функционируют преимущественно в данном органе [7], но являются малоизученными. Ранее нами показано, что SELV- ядерно-цитоплазматический белок с глутатионпероксидазной и тиоредоксинредуктазной активностями [8, 9], мРНК SELV экспрессируется на протяжении всего постнатального развития, особенно в период полового созревания, в связи с чем рассматривается участие белка в процессах сперматогенеза и поддержания нормальной репродуктивной функции животных [10, 11]. Глутатионпероксидаза GPX4 экспрессируется на поздних стадиях сперматогенеза в сперматидах и участвует в процессах конденсации мужского гаплоидного генома, при его инактивации наблюдаются серьезные структурные нарушения в средней части сперматозоидов, ухудшение качества спермы, что может привести к бесплодию [12, 13]. TGR по своей структуре похож на две другие тиоредоксинредуктазы млекопитающих, но имеет дополнительный глутаредоксиновый домен на N-конце. Фермент преимущественно экспрессируется в семенниках, в ранних сперматидах и участвует в окислительно-восстановительных реакциях в процессе созревания сперматозоидов [14]. У мышей с недостатком Se выявлено снижение подвижности сперматозоидов и нарушение их морфологии, особенно в средней части, что согласуется с данными, полученными для GPX4 [13]. Наличие параллельной пространственной и временной экспрессии GPX4 и TGR, а также участие TGR в изомеризации дисульфидных связей, формирующихся между GPX4 и определенными белками сперматозоидов, предполагает, что оба фермента связаны функционально [15]. Однако до сих пор слабо исследована роль данных селенопротеинов в регуляции процессов канцерогенеза, в частности связанных с раком семенников, поэтому результаты, полученные в ходе данной работы, представляют весомый интерес.
Цель исследования
Изучить влияние SS на жизнеспособность раковых клеток семенников мыши, линия F-9 (тестикулярная тератокарцинома мыши), а также на уровень экспрессии мРНК генов трех селенопротеинов SELV, TGR и GPX4 в данной клеточной линии до и после воздействия SS.
Материалы и методы исследования
Выделение РНК. Тотальную РНК из клеток F-9 (ЦКП «Коллекция культур клеток позвоночных», Санкт-Петербург) выделяли с помощью реагента Extract tRNA reagent («Евроген», Россия), содержащего раствор фенола и гуанидинизотиоционата. Реагент вносили на чашку Петри с клеточным монослоем из расчета 1 мл на 10 см2 поверхности, выделение РНК согласно протоколу производителя.
Обратная транскрипция. Реакцию обратной транскрипции проводили с использованием набора реагентов для синтеза первой цепи кДНК («Евроген», Россия), содержащего ревертазу MMLV в присутствии oligo(dT)-праймеров. Используемое в реакции содержание суммарной РНК (2 мкг) контролировали, проводя параллельно амплификацию с праймерами к гену «домашнего хозяйства» GAPDH.
ПЦР в реальном времени. Полученную кДНК использовали в качестве матрицы для проведения ПЦР в реальном времени с помощью смеси qPCRmix-HS SYBR («Евроген», Россия) и праймеров, приведенных в таблице. Изменение уровня экспрессии мРНК до и после обработки SS, определяли по формуле
ОУЭ = 2-ΔΔСт ,
где ΔСт – разница между значениями пороговых циклов для референсного (GAPDH-ген, кодирующий глицеральдегид-3-фосфат дегидрогеназу) и целевого генов (гены исследуемых селенопротеинов), ΔΔСт – разница значений ΔСт для каждого гена до и после обработки клеток SS. Каждый цикл эксперимента (выделение РНК, реакция обратной транскрипции, ПЦР в реальном времени) повторяли трижды.
Анализ вестерн-блот. Для идентификации исследуемых белков использовали метод иммуноблотинга, для чего клетки отмывали фосфатно-солевым буфером и центрифугировали при 1 000 об/мин в течение 20 мин. Супернатант концентрировали с помощью центрифужных концентраторов Amicon Ultra 4–50 кДа («Merk Millipore», Россия), полученные образцы использовали для проведения ПААГ электрофореза в 10 % разрешающем геле. Далее выполняли иммуноблотинг с коммерческими антителами против исследуемых селенопротеинов и контрольного гена-GAPDH и вторичными антителами, конъюгированными с пероксидазой хрена («Abcam», США).
Анализ жизнеспособности клеток после обработки SS. Для исследования жизнеспособности клеток в режиме реального времени – до, в момент и после оказания на них воздействия использовали анализатор iCelligence RTCA («ACEA Biosciences®», США). Предварительно подбирали концентрации SS («Sigma-Aldrich», США), существенно снижающих жизнеспособность раковых клеток. Клетки подращивали в специальных планшетах прибора в 500 мкл питательной среды (DMEM, 10 % сыворотка) при 37 °С в течение 24 ч, после чего добавляли раствор SS в концентрациях 1, 2,5, 5,0, 7,5 и 10,0 мкМ. Клетки инкубировали еще 48 ч, при 37 °С, замеряя при этом клеточный индекс-показатель сопротивления электронного потока клеткам, находящимся в адгезивном состоянии, который вычисляли по формуле: (значение сопротивления в момент времени n–значение сопротивления в отсутствие клеток)/номинальное значение сопротивления. Процедуру повторяли трижды.
Последовательности праймеров, используемых для проведения реакции ПЦР в реальном времени
|
№ п/п |
Название праймера |
Последовательность прямого праймера 5’->3’ |
Последовательность обратного праймера 5’->3’ |
|
1 |
GAPDH |
AACGGGAAGCTCACTGGC |
CACCACCCTGTTGCTGTAGC |
|
2 |
SELV |
CCAGGTTACAGGGGAGTTTG |
CAGCCACCATCAGAAAAGG |
|
3 |
TGR |
TGGTCGTGACTCCTGTACAAG |
CCACATTTCATTGCAGCTG |
|
4 |
GPX4 |
CCATGCACGAGTTTTCCG |
AATTTGACGTTGTAGCCCG |
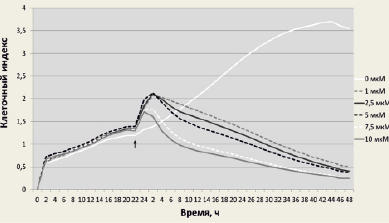
Рис. 1. Жизнеспособность клеток линии F-9 до и после обработки SS в концентрации 1; 2,5; 5; 7,5 или 10 мкМ. SS добавляли через 24 ч после инкубации клеток в анализаторе. Стрелкой обозначен момент добавления SS к клеткам; измерение клеточного индекса проводили в течение 48 ч
Результаты исследования и их обсуждение
Анализ жизнеспособности клеток после обработки SS. Все используемые в данной работе концентрации SS (1; 2,5; 5,0; 7,5 и 10,0 мкМ) приводили к снижению жизнеспособности раковых клеток линии F-9 (рис. 1), наибольший эффект был достигнут при использовании 7,5 и 10,0 мкМ концентраций SS, что соответствует ранее полученным данным на клетках первичной эффузионной лимфомы (линия PEL) [1]. С химиотерапевтической точки зрения подбор концентрации SS является важным этапом в исследовании дозозависимого действия данного агента на конкретную клеточную линию, а также механизма, приводящего к гибели раковых клеток. Se, благодаря своей уникальной способности быть избирательно токсичным для опухолевых клеток и не влиять на нормальные при его использовании в клинически допустимых субтоксичных дозах, рассматривается в качестве перспективного химиотерапевтического средства. В экспериментах по изучению влияния SS на регуляцию экспрессии мРНК SELV, TGR и GPX4 клетки F-9 обрабатывали 10.0 мкМ SS, анализ проводили спустя 24 ч воздействия.
Анализ регуляции SS на экспрессию мРНК SELV, TGR и GPX4. К настоящему времени доказана связь между действием SS и стрессом эндоплазматического ретикулума, опосредованным высоким уровнем АФК. Поскольку большинство селенопротеинов обладают антиокидантными свойствами, благодаря селеноцистеину, входящему в их состав, весьма интересным явилось установление изменения уровней экспрессии мРНК генов трех исследуемых в данной работе селенопротеинов.
А
Б
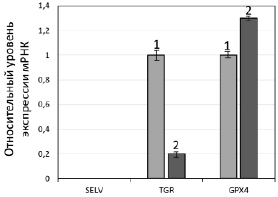
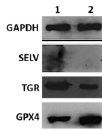
Рис. 2. А. Экспрессия генов селенопротеинов SELV, TGR и GPX4 в клетках F-9 до и после воздействия SS. А. Уровни мРНК SELV, TGR и GPX4 до (1) и после обработки 10 мкМ SS в течение 24 ч (2) относительно мРНК GAPDH (отн. ед.). За единицу принят уровень каждой из исследуемых мРНК в необработанных клетках. Значения представлены как среднее ± SD по трем независимым экспериментам. Б. Электрофоретический анализ белков SELV, TGR и GPX4 до (1) и после обработки SS (2)
На рис. 2, А, представлены результаты ПЦР в реальном времени, которые свидетельствуют о том, что при обработке клеток SS происходило увеличение экспрессии мРНК GPX4, что ожидаемо в условиях усиленного окислительного стресса, вызванного действием SS, поскольку известно, что системы глутаредоксина и тиоредоксина являются основными в поддержании редокс гомеостаза в клетке. Однако обратный эффект наблюдался для гена TGR, для которого установлено существенное снижение экспрессии. Эти результаты не согласуются с ранее полученными данными о совместном функционировании двух ферментов в семенниках [13–15] и дают основание полагать, что TGR может обладать онкогенными свойствами. Безусловно, эти предположения требуют подтверждения в более детальных исследованиях, где будет проанализировано влияние подавления экспрессии гена TGR в нормальных и раковых клетках семенников на пролиферацию клеток, экспрессию генов других селенопротеинов, опухолевых маркеров и др. Что касается третьего белка SELV, его мРНК не была обнаружена ни до, ни после действия на клетки SS, поэтому говорить об его участии/неучастии в процессах злокачественной трансформации рано. Результаты, полученные методом ПЦР в реальном времени, нашли своё подтверждение и при выполнении вестерн-блот анализа (рис. 2, Б).
Заключение
В настоящее время у исследователей в области биологии и медицины имеется понимание важности окислительно-восстановительных процессов для жизнедеятельности организмов в норме и при патологиях. Известно, что существует широкий спектр биологических молекул с антиоксидантными свойствами, которые классифицированы по ряду признаков, среди которых важную роль играют соединения Se. Поскольку одной из причин развития рака является усиление окислительного стресса в клетках, соединения Se рассматривают в качестве противоопухолевых агентов, однако этот эффект в значительной степени зависит от дозы и химической специфики. Однако результаты, полученные в данной работе, можно рассматривать как начальный этап исследований роли селена и селенопротеинов SELV, TGR и GPX4 в канцерогенезе, они требуют дальнейшего подтверждения в более серьезных исследованиях, направленных на изучение изменений, вызванных SS в раковых и нормальных клетках семенников с помощью различных независимых подходов: сайленсинг генов исследуемых селенопротеинов, анализ изменения экспрессии генов других селенопротеинов, опухолевых маркеров, а также известных участников регуляции ЭПР-стресса и др.
Работа поддержана стипендией Президента Российской Федерации молодым ученым и аспирантам СП-2059.2016.4 и грантами РФФИ № 17-04-00356А, 18-34-00118 мол_а.

