В настоящее время для вскрытия платиносодержащего сырья в основном используется процесс гидрохлорирования, в результате которого металлы платиновой группы (МПГ) переходят в раствор в виде комплексных хлоридов. В процессе аффинажа МПГ, как правило, получают отдельно платино-палладиевый концентрат и концентрат, содержащий иридий, родий и рутений. На стадиях разделения МПГ нередко возникают проблемы с выделением иридия из-за чрезвычайной инертности его соединений. Применяемые схемы многостадийны, получение целевого продукта иридия происходит на последних стадиях, что приводит к значительным потерям металла с вторичными растворами [1]. Изучены способы разделения Ir (IV), Rh (III) и Ru (III) из растворов хлористоводородной кислоты N-содержащими экстрагентами: n-октиланилином [2], Alamine336 в присутствии SnCl2 и смесями Alamine336 – ТБФ [3].
Для решения задач селективной экстракции Ir (III, IV) из хлоридных растворов и разделения металлов платиновой группы исследованы различные фосфиноксиды, Cyanex 921 и Cyanex 923 с добавлением ТБФ в качестве модификатора. Широкий спектр исследований в этом направлении обусловлен, как разнообразием проблем, возникающих при переработке различного сырья МПГ, так и недостаточной эффективностью известных технологических решений.
В работе [4] была установлена возможность селективного извлечения иридия трибутилфосфатом в виде комплексной кислоты иридия (IV) – Н[IrCl5•H2O]. Вместе с тем при получении хлоридов иридия (IV) доля этой формы комплексов оказывается небольшой. Так, по данным эстракционно-хроматографических исследований, при СHCl = 8,0 M содержание экстрагируемого соединения [IrCl5•H2O]- составляет лишь 0,2 % от общего количества иридия и возрастает до 8,6 % при СHCl = 0,1 M. Для повышения доли экстрагируемых форм иридия авторы предложили проводить экстракцию из смешанных солянокислых-сернокислых растворов [4, 5].
В настоящей работе исследована экстракция хлорокомплексов иридия трибутилфосфатом в присутствии окислителя, способного значительно увеличить долю хорошо экстрагируемой комплексной кислоты Н[IrCl5•H2O]. Это достигается гетерогенным окислением иридия в хлоридных растворах соединением хлорноватистой кислоты с трибутилфосфатом (ТБФ•HOCl) с одновременной экстракцией иридиевого продукта окисления в органическую фазу.
Материалы и методы исследования
В качестве исходных соединений металлов платиновой группы использовали: хлорокомплексные кислоты H3IrCl6, H2IrCl6, H2PdCl4, H2PtCl6 и соли RhCl3, K2[RuCl5·H2O].
С целью уменьшения содержания хлора, солянокислый раствор комплексных кислот МПГ c расчетным содержанием металла упаривали и разбавляли 0,1 М раствором азотной кислоты до прежнего объема. На этой стадии содержание соляной кислоты снижалось с 1 М до ~0,02 М.
«Окислительную» экстракцию иридия проводили контактированием водных растворов хлорида иридия с раствором HOCl в 80 % трибутилфосфате при равных объемах водной и органической фаз (О:В = 1:1).
Гетерогенный окислитель ТБФ•HOCl получали продувкой хлора через эмульсию трибутилфосфата в водном растворе гидроксида натрия по реакции (1). Процесс протекает с хорошими выходами, если количество хлора несколько превышает количество гидроксида натрия от стехиометрии реакции (1). При этом без больших осложнений в органической фазе может быть достигнута концентрация хлорноватистой кислоты 1–1,5 моль/л. Получаемое соединение достаточно устойчиво и не разрушается при промывке водой. Величина коэффициентов распределения HOCl для 80 % ТБФ составляет около 33–35.
Cl2 + NaOH(в) + ТБФ(o) > ТБФ•HOCl (o) + NaCl(в), (1)
здесь и далее символы (в) и (о) обозначают принадлежность компонента к водной или органической фазам, соответственно.
Концентрации металлов в исходных растворах и в водных фазах после экстракции определяли фотоколориметрическим и атомно-адсорбционным методами. Содержание металлов в органических фазах рассчитывали по разности между концентрациями в исходных растворах и в водных фазах после экстракции.
Электронные спектры поглощения (ЭСП) записывали на регистрирующем спектрометре AvaSpec-2048L.
Результаты исследования и их обсуждение
Окислительно-восстановительные свойства системы «водный раствор – трибутилфосфат – хлорноватистая кислота» исследованы нами в работе [6]. Было установлено, что аддукт ТБФ•HOCl достаточно устойчив и является сильным окислителем. При контактировании этого окислителя с водными растворами кислот окислительный потенциал гетерогенной системы возрастает с увеличением кислотности, достигая значений 1,5–1,53 В для нулевого значения рН раствора. Соответственно, для подкисленных растворов хлоридов иридия (III) в системе будут протекать два основных процесса, это окисление примесей соляной кислоты по реакции (2) и окисление иридия до степени окисления (+4).
H+(в) + Cl-(в) + ТБФ•HOCl(o) >
> ТБФ •Cl2(o) + H2O (2)
Контактирование смесей соляной и азотной, а также соляной и серной кислот с исследуемым экстрагентом показывает, что в избытке HOCl за 10–15 минут 98–99 % соляной кислоты разлагается с выделением хлора. Получаемый по реакции (2) аддукт ТБФ •Cl2 нестоек [6] и разлагается далее с выделением газообразного хлора.
Исходная комплексная кислота иридия (III) – H3IrCl6 слабо экстрагируется трибутилфосфатом. Однако после смешивания ее водного раствора с HOCl в ТБФ наблюдается значительное извлечение иридия в органическую фазу, достигающее в некоторых случаях 90 %. На рис. 1 приведена зависимость величины коэффициентов распределения иридия от исходной концентрации HOCl в органической фазе. В этом эксперименте использовали водный раствор Н3IrCl6 в разбавленной азотной кислоте. Его готовили упаркой солянокислого раствора хлоридного комплекса иридия (для удаления избытка HCl) и последующим разбавлением в 0,1 М азотной кислоты. Как видно из полученных данных, зависимость имеет S-образный характер. На начальном участке иридий экстрагируется слабо. Однако при добавлении в органическую фазу более 0,01 М HOCl наблюдается значительный рост извлечения иридия с достижением коэффициентов распределения до величин 2–2,5. Низкие коэффициенты распределения иридия при добавлении небольших количеств HOCl, очевидно, обусловлены окислением остатков HCl в водном растворе. После удаления хлорид-иона из раствора в системе начинает образовываться хорошо экстрагируемая форма иридия, что обусловливает значительный рост коэффициентов распределения металла. Такой формой не может быть продукт окисления иридия – H2IrCl6, который, так же как и H3IrCl6, слабо экстрагируется трибутилфосфатом.
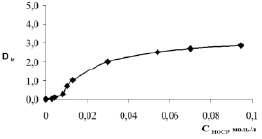
Рис. 1. Влияние концентрации HOCl на извлечение иридия в системе ТБФ-HOCl СIr = 0,008М
Анализ электронных спектров поглощения органической и водной фаз показал, что при гетерогенном окислении иридия HOCl в системе образуется значительное количество моногидратного хлоридного комплекса иридия (IV) – H[IrCl5H2O], который и обеспечивает хорошее извлечение иридия в органическую фазу. Электронные спектры поглощения (ЭСП) исходного водного раствора, иридиевого экстракта для системы HOCl-ТБФ и для сравнения – экстракта для ТБФ без HOCl приведены на рис. 2. Как видно из приведенных данных, при экстракции хлоридных комплексов иридия (III) трибутилфосфатом без окислителя в ЭСП экстракта (рис. 1, спектр 2) регистрируются полосы с λmax = 420 нм, подтверждающие извлечение комплексного аниона [IrCl6]3-. ЭСП экстрагируемых комплексов иридия, полученные при экстракции ТБФ•HOCl (рис. 1 спектр 3), характеризуются двумя полосами поглощения с λmax = 450 нм и λmax = 360 нм, что позволяет говорить об образовании и извлечении в органическую фазу комплексной кислоты H[IrCl5•H2O], которая, как уже упоминалось выше, хорошо извлекается трибутилфосфатом.
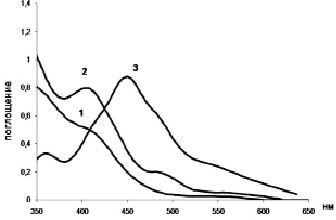
Рис. 2. ЭСП водного исходного раствора комплексной кислоты Н3IrCl6 (1) и органических фаз после экстракции иридия (III) раствором ТБФ (2), ТБФ•HOCl (3) в гептане
При экстракции иридия смесями ТБФ•HOCl наряду с хорошо экстрагируемыми соединениями H[IrCl5•H2O] образуются слабо экстрагируемые комплексы H2[IrCl6], которые в основном остаются в водном растворе. На рис. 3, а, приведен ЭСП органической фазы после экстракции в такой системе, а на рис. 3, б, – ЭСП водной фазы. Спектры водной и органической фаз значительно отличаются друг от друга и отвечают комплексным кислотам, соответственно H[IrCl5•H2O] для экстракта и H2[IrCl6] – для рафината. Доли экстрагируемой и плохо экстрагируемой форм заметно изменяются в зависимости от условий эксперимента.
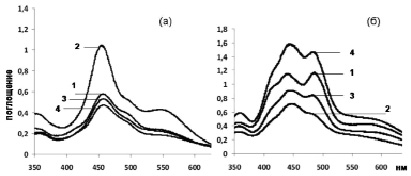
Рис. 3. ЭСП органических (а) и водных фаз (б) после экстракции иридия в системе ТБФ-HOCl. Условия: рН равн = 0,3 (1–1); 0,55 (2–2); 1,07 (3–3); 1,36 (4–4); τэкстракции = 10 мин
В целом полученные предварительные данные показали, что при гетерогенном взаимодействии растворов хлоридных комплексов иридия (III) с хлорноватистой кислотой в ТБФ может со значительным выходом образовываться хорошо экстрагируемая ТБФ комплексная кислота H[IrCl5•H2O] по общей реакции (3).
3H+(в)+IrCl63-(в)+2ТБФ•HOCl(o)>
> 2ТБФ•H[IrCl5H2O] (о)+1,5Cl2^+ H2O. (3)
Очевидно, что процесс протекает по более сложной схеме с окислением иридия в водной или органической фазах, учитывая обратимость межфазных процессов распределения всех участников реакции. Одной из главных задач, решение которой позволило бы оптимизировать процесс и обеспечить условия максимального извлечения иридия и отделения его от других металлов платиновой группы, является понимание механизма образования моногидрата хлоридного комплекса иридия (IV) – H[IrCl5H2O], с заменой одного аниона хлорид-иона на молекулу воды.
Для этого процесса можно выделить два основных маршрута его реализации. Первый – заключается в окислении иридия до четырехвалентного состояния на начальной стадии хлорноватистой кислотой (4) или хлором (5), также присутствующим в системе, с последующим окислением хлорид-иона внутренней координационной сферы комплекса и образованием моногидрата (6).
H+ + IrCl63- + HOCl > IrCl62- + 1/2Cl2 + H2O, (4)
IrCl63- + 1/2Cl2 > IrCl62- + Cl- + H2O, (5)
H+ + IrCl62-+ HOCl > [IrCl5H2O]- + Cl2. (6)
Во втором варианте сначала образуется моногидратный комплекс иридия (III) по реакции (7), который затем окисляется хлорноватистой кислотой (8). Избыток хлорид-иона удаляется из раствора также окислением HOCl (9).
IrCl63- + H2O > [IrCl5H2O]2- + Cl-, (7)
Н+ + [IrCl5H2O]2- + HOCl >
[IrCl5H2O]- + 1/2Cl2 + H2O, (8)
H+ + Cl- +HOCl > H2O + Cl2. (9)
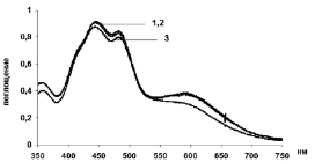
При оценке возможности протекания процесса по первому варианту учитывали, что реакции окисления хлоридов иридия (III) протекают достаточно легко. Лимитирующей стадией в этом случае может являться замещение хлорид-иона водой (6) в инертном комплексе иридия (IV). С учетом этого водные растворы, содержащие IrCl62-, контактировали в течение различного времени с хлорноватистой кислотой в ТБФ (рис. 4). Из полученных данных видно, что окислительная обработка гексахлоридных комплексов иридия (IV) органическим раствором ТБФ•HOCl в течение 10 мин и 60 мин не приводит к заметному уменьшению содержания IrCl62- и образованию моногидратов [IrCl5H2O]-.
Рис. 4. ЭСП водных фаз после контактирования растворов IrCl62- с 0,04 моль/л раствором HOCl в 80 % ТБФ: время контакта фаз, мин: 10 (1), 30 (2), 60 (3)
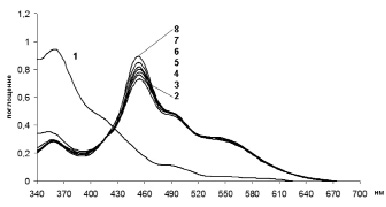
Низкая скорость реакции может быть обусловлена гетерофазным характером реакции и невысокими концентрациями реагирующих компонентов – с одной стороны, HOCl в водной фазе, а с другой – иридия в органической. В этой связи реакцию реализовали в одной – органической фазе при высоких содержаниях как иридия, так и HOCl. Для повышения концентрации Н2IrCl6 в органической фазе необходимое количество гидратированной твердой кислоты H2IrCl6 растворяли в 80 % ТБФ, затем к полученному раствору добавляли избыток HOCl в ТБФ и следили за изменением ЭСП комплексов во времени. Однако, как и для водной фазы, в спектрах комплексов H2IrCl6 в органических растворах не наблюдалось в течение 1 часа заметных изменений.
Аналогичный эксперимент с комплексной кислотой иридия (III) – Н3IrCl6, показывает (рис. 5), что окисление этого соединения в органической фазе приводит к быстрому образованию моногидратной формы Н[IrCl5H2O].
Рис. 5. Изменения ЭСП органической фазы при окислении комплексов H3IrCl6 хлорноватистой кислотой: 1 – 80 % ТБФ в гептане, СH3IrCl6(исх) = 0,0017 моль/л; 2 – 80 % ТБФ в гептане, СH3IrCl6(исх) = 0,0017 моль/л СHOCl(исх) = 0,015 моль/л через 5 мин после добавления; 3–8 – условия системы (2) с последующими временными интервалами 10 мин
Таблица 1
Извлечение металлов платиновой группы (МПГ) раствором хлорноватистой кислоты в 80 % ТБФ (п. 1) и 80 % раствором ТБФ (п. 2)
|
№ п/п |
Экстрагент |
% извлечения МПГ |
||||
|
Ru |
Rh |
Pd |
Ir |
Pt |
||
|
1 |
0,11 М раствор хлорноватистой кислоты в 80 % трибутилфосфате (разбавитель гептан) |
<5 |
<5 |
10 |
90 |
<5 |
|
2 |
80 % трибутилфосфат (разбавитель гептан) |
<5 |
<5 |
8 |
<5 |
<5 |
Таблица 2
Коэффициенты разделения иридий/МПГ при обработке водных растворов хлоридов МПГ раствором хлорноватистой кислоты в 80 % ТБФ (п. 1) и 80 % раствором ТБФ (п. 2) (разбавитель гептан)
|
№ п/п |
Экстрагент |
Коэффициенты разделения иридий/МПГ (DIr/DМПГ) |
|||
|
Ir/Ru |
Ir/Rh |
Ir/Pd |
`Ir/Pt |
||
|
1 |
0,11 М раствор хлорноватистой кислоты в 80 % трибутилфосфате |
>170 |
>170 |
82 |
>170 |
|
2 |
80 % трибутилфосфат |
~1 |
~1 |
<0,5 |
~1 |
При добавлении к раствору иридия HOCl интенсивность пиков ЭСП комплекса H3IrCl6 снижается почти на порядок в первые минуты (рис. 5). При этом одновременно появляются пики поглощения комплекса Н[IrCl5H2O]. Основные изменения в системе наблюдаются в течение первых минут и далее в течение 60–80 мин доля комплекса Н[IrCl5H2O] возрастает еще приблизительно на 10 %.
Таким образом, выполненные эксперименты показывают, что в исследуемой системе хорошо экстрагируемый комплекс Н[IrCl5H2O] образуется в результате протекания процесса по второму варианту, когда на первой стадии образуется моногидрат иридия (III), а затем происходит окисление металла. Окисление иридия в начале процесса приводит к образованию кинетически устойчивой формы H2IrCl6, что снижает глубину извлечения иридия в органическую фазу.
Исследуемая система представляет значительный практический интерес для решения проблем выделения иридия из технологических растворов и его очистки, так как другие металлы платиновой группы (Pt, Pd, Rh, Ru) экстрагируются ТБФ в присутствии хлорноватистой кислоты слабо и их основная часть остается в водном растворе при экстракции [7].
В табл. 1 представлены результаты некоторых исследований экстракции иридия, платины, палладия, родия и рутения растворами хлорноватистой кислоты в 80 % трибутилфосфате и для сравнения 80 % трибутилфосфатом (растворитель – гептан) без окислителя. При использовании ТБФ•HOCl извлечение иридия за 1 контакт составляет 90 % (коэффициент распределения – 9). Для других МПГ извлечение не превышает 5 % (коэффициент распределения менее 0,05), за исключением палладия, извлечение которого составляет 10 % (коэффициент распределения – 0,25).
Коэффициенты разделения для пар Ir/МПГ (βIr/МПГ) приведены в табл. 2. Можно видеть, что селективность извлечения иридия очень высока и величины βIr/МПГ составляют от 80 до более чем 170.
Реэкстракция иридия из органической фазы достигается обработкой экстрактов водой. За 1 контакт извлечение иридия в водную фазу составляет около 80 % при отношении О:В=1:1.
Учитывая практическую важность данной системы, значительный интерес представляет ее дальнейшее исследование, выявление особенностей механизма процесса, установлению влияния различных факторов на извлечение иридия.
Заключение
Изучена гетерофазная реакция хлоридных комплексов иридия (III) с органическим раствором хлорноватистой кислоты в трибутилфосфате. Показано, что при межфазном взаимодействии с большим выходом образуется моногидрат хлоридного комплекса иридия (IV) – Н[IrCl5H2O], который извлекается в органическую фазу с достаточно высокими коэффициентами распределения и разделения относительно других металлов платиновой группы. В процессе экстракции одновременно из раствора удаляется избыток хлорид-иона в виде молекулярного хлора. Анализ электронных спектров поглощения растворов и данных межфазного распределения иридия позволяет заключить, что основным маршрутом гетерофазного процесса является замещение хлорид-иона на молекулу воды на первой стадии процесса и последующее окисление иридия до четырехвалентного состояния на завершающей. Это обеспечивает образование хорошо экстрагируемого трибутилфосфатом иридиевого комплекса.

