Перфорин наряду с гранзимами А и В относится к семейству литических протеинов, которые содержатся в секреторных ацидофильных гранулах цитотоксических Т-лимфоцитов и NK-клетках и способны лизировать опухолевые клетки и внутриклеточно располагающиеся вирусы и микроорганизмы, такие как Mycobacteria, Brucella. Перфорин имеет молекулярную массу 67-kDa. Он активируется посредством расщепления С-конца в его структуре и способствует проникновению гранзимов А и В через цитоплазматическую мембрану. Существует представление, что гранзимы переносятся через плазматическую мембрану через специфический рецептор: катион-независимый маннозо-6-фосфатный рецептор и перфорин приводит гранзимы к конкретным активным участкам цитоплазматической мембраны. В опосредованном перфорин/гранзимы пути апоптотической гибели клеток-мишеней важную роль играет сериновая протеаза серглицин (SG). Он является протеогликаном, в котором хондроитинсульфаты или гепарансульфатгликозаминогликаны (GAG связаны с Ser-Gly-повторами в центральную часть основного белка. Считается, что отрицательно заряженные цепи GAG способствуют сохранению гранзимов А и В в виде мультимерных комплексов и, как было показано, гранзим В секретируется в форме, связанной с серглицином. В свою очередь перфорин способствует эффективной доставке комплексов гранзим В – серглицин в цитозоль клеток-мишеней путем пермеабилизации. Полноценность этого процесса зависит от ионов Са2+ [1].
Цитотоксический ответ против различных клеток-мишеней, в том числе и макрофагов, инфицированных микобактериями, осуществляется различными субпопуляциями клеток. Они представлены небольшой популяцией МНС – не рестриктированных γδ T T (CD3+γδ T TCR+ ) клетками, имеющими еще дополнительные фенотипические маркеры CD56+ и/или CD16+. Другой более важной популяцией цитотоксических лимфоцитов являются МНС-I рестриктированные CD8+ и МНС-II рестриктированные CD4+ цитотоксические субпопуляции Т-клеток. Третью популяцию представляют NK-клетки. Цитотоксический эффект двух последних групп клеток осуществляется комплексом цитолитических молекул после контакта с опухолевыми клетками, клетками, инфицированными вирусами, или макрофагами, содержащими микроорганизмамы (в том числе с микобактериями). NK-клетки после контакта с мишенями усиливают продукцию и выделение во внутриклеточную среду перфорина, гранзима А и гранулизина, которые связываются непосредственно с клетками-мишенями через образованные нанотрубчатые структуры и посредством мембрана-атакующего комплекса лизируют мишени, подобно С9 компоненту комплемента. Описана мутация молекулы перфорина Ala91Va, которая приводит к низкой стабильности молекулы и развитию различных типов опухолей, таких как В-клетки и Т-клеточные лимфомы и острый лимфобластный лейкоз у детей [2].
Способность цитотоксических CD8+ Т-лимфоцитов лизировать внутриклеточные микроорганизмы зависит от их способности привлекать инфицированные клетки, а также от секреции цитолитических и антимикробных эффекторных молекул (хемокина CCL5, перфорина и гранулизина). Макрофаги, инфицированные вирулентными Mycobacterium tuberculosis, вызывают экспрессию CCL5 только у CD8+ лимфоцитов, сенсибилизированных к антигенам микобактерий. Функционально CCL5 эффективно привлекает M. tuberculosis инфицированные макрофаги, но не оказывает прямой антибактериальной активности. Зараженные макрофаги также вызывают экспрессию гранулизина в CD8+ Т-клетках, и при этом гранулизин обладает высокой активностью в отношении M. tuberculosis, как чувствительных, так и резистентных к лекарственным средствам клинических изолятов. Подавляющее большинство CCL5-позитивных клеток CD8+ лимфоцитов являются также продуцентами перфорина [3].
Исследования о роли перфорина при туберкулезе не многочисленные. Так показано, что у больных с активным туберкулезом легких наряду с достоверным снижением в крови общего количества лимфоцитов и их супопуляций CD4+ и CD8+ наблюдается значительный подъем CD8+ клеток, содержащих внутриклеточно выявляемый перфорин, в сравнении с группой здорового контроля, что предполагает усиление цитолитической активности CD8+ клеток у больных туберкулезом [4].
S. Rahman и соавт. (2009) [5] изучали биоптаты лимфатических узлов детей, больных туберкулезом внутригрудных лимфатических узлов, которых на основании in situ ПЦР-анализа на антигены микобактерий разбили на группы ТБ+ и ТБ-. Методом иммунофлюоресценции у больных ТБ+ не выявлено увеличение пропорции CD3+ и CD4+ T клеток, но содержание CD8+ T клеток было достоверно выше, чем в биоптатах у ТБ- больных.
Кроме того показано, что индукция таких важных при туберкулезе цитокинов, как IFN-γ и TNF-α, была низкой, а IL-17 незначительной в случаях TB+ лимфаденита по сравнению с контрольной группой (срезы лимфоидной ткани глоточного кольца). Более того, в то время как экспрессия мРНК гранзима А была значительно увеличена, экспрессия перфорин, и гранулизин оставались низкими при ТБ+ лимфадените. Напротив, экспрессия всех цитолитических эффекторных молекул была значительно выше в TB – лимфадените. При этом CD8+ T клетки, экспрессирующие гранзим А. перфорин и гранулизин располагались в основном в паракортикальных слоях лимфоузлов. Отмечено также, что избыточное накопление регуляторных Т-клеток, экспрессирующих мРНК для FoxP3, TGF-β и IL-13, но не IL-10 и IL-4, обратно коррелирует с накоплением CD8+ T клеток.
Описана значимость некоторых аллелей главного комплекса гистосовместимости на содержание перфорин-положительных CD4, CD8, CD16 и CD56 клеток в периферической крови. Типирование с помощью ПЦР на основе специфических олигонуклеотидных последовательностей для аллеей HLA-DR2 у 156 здоровых доноров и 102 больных легочным туберкулезом показало значительное снижение общего числа перфорин-положительных клеток, а также CD8+, CD16+ и CD56+клеток у HLA-DR2-позитивных больных туберкулезом по сравнению с HLA-DR2 – отрицательными больными туберкулезом. При этом процент перфорин-положительных CD8+ клеток не отличался у DRB1*1501 и DRB1*1502 больных. Однако выявлено снижение процента перфорин-положительных CD16+ и CD56+ клеток у больных, несущих аллель DRB1*1501, по сравнению с больными с аллелью DRB1*1502. Авторы предполагают наличие ассоциации между HLA-DR2 и снижением перфорин-положительных цитотоксических лимфоцитов и естественных киллеров у больных туберкулезом [6].
Материалы и методы исследования
Исследование проведено на 49 больных, разделенных на три группы. В группу больных с деструктивным туберкулезом включено 13 человек в возрасте от 14 до 17 лет. Инфильтративный туберкулез в фазе распада и обсеменения диагностирован у 6 человек, диссеминированный туберкулез в фазе распада – у 3 человек, множественные туберкулемы в фазе распада и обсеменения – у 2 человек, фиброзно-кавернозный туберкулез – 1 человек и казеозная пневмония – 1 человек.
В исследование включено 27 больных в возрасте от 3 до 16 лет с «малыми» формами туберкулеза органов дыхания. Туберкулез внутригрудных лимфатических узлов (ТВГЛУ) диагностирован у 14 человек, в том числе с очагами отсева в легочную ткань – 5 человек; очаговый туберкулез легких – 13 человек Большинство процессов были выявлены в фазе начинающейся кальцинации – 12 чел. и реже в фазе уплотнения – 10 чел., и в фазе инфильтрации – 5 чел.
Группу инфицированных МБТ составили 9 пациентов в возрасте от 5 до 14 лет, обратившихся по поводу контакта с больными туберкулезом и имевших положительные реакции пробу Манту с 2 TE и Диаскинтест.
Перфорин-1 определяли в К3ЭДТА плазме методом иммуноферментного анализа с помощью набора SEB317Hu (Cloud-Clone Corp.) согласно инструкции изготовителя. Диапазон определения тест-системы 1,56–100 нг/мл, минимальная определяемая концентрация 0,62 нг/мл. Результаты обрабатывались статистически с помощью пакета Microsoft Exel.
Результаты исследования и их обсуждение
Сравнение результатов содержания перфорина в плазме крови группы инфицированных пациентов и больных деструктивными и «малыми» формами туберкулеза до начала курса противотуберкулезной химиотерапии выявило, что при деструктивных формах туберкулеза имеется достоверно более низкое содержание этого фактора по сравнению с группой инфицированных МБТ пациентов (34,15 ± 1,5 нг/мл и 39,5 ± 1,1 нг/мл соответственно, р = 0,01366). У больных с ТВГЛУ/очаговым туберкулезом содержание перфорина было достоверно выше, чем при деструктивных формах поражения легких (38,7 ± 0,78 нг/мл и 34,15 ± 1,5 нг/мл соответственно, р = 0,01712) (таблица, рис. 1).
Концентрация перфорина (в нг/мл) плазмы крови больных исследованных групп
|
Срок исследования Группы наблюдения |
0 мес. |
3 мес. |
6 мес. |
|
Деструктивный ТБ |
34,15 ± 1,5 *^ |
32,6 ± 0,38** |
31,35 ± 0,19*** |
|
ТВГЛУ/очаговый ТБ |
38,7 ± 0,78 ** |
40,3 ± 1,62 |
39,3 ± 1,7 |
|
Инфицированные МБТ |
39,5 ± 1,1 |
– |
– |
Примечания: ^Р = 0,01366 по сравнению с группой инфицированных МБТ; *Р = 0,01712 по сравнению с группой ТВГЛУ/очаговый ТБ; **Р = 0,001139 по сравнению с группой ТВГЛУ/очаговый ТБ; ***Р = 0,00055 по сравнению с группой ТВГЛУ/очаговый ТБ.
В процессе лечения значения перфорина плазмы крови практически не изменялись как у больных деструктивным туберкулезом, так и при ТВГЛУ/очаговых формах туберкулеза (рис. 2, таблица). Однако уровень перфорина у больных с деструктивным туберкулезом по сравнению с «малыми» формами был достоверно ниже во все сроки наблюдения (0 мес. – р = 0,01712; 3 мес. – р = 0,00139 и 6 мес. р = 0,00055). При рассмотрении динамики содержание перфорина у больных «малыми» формами туберкулеза, подразделенными на подгруппы ТВГЛУ и очагового туберкулеза нами были выявлены некоторые особенности динамики этого фактора. Если у больных ТВГЛУ показатели оставались неизменными в процессе всех сроков исследования, то у больных очаговыми формами наблюдался временный подъем концентрации перфорина на срок 3 мес. (38,05 ± 1,05 нг/мл и 42,15 ± ± 1,3 нг/мл соответственно, р = 0,05071) (рис. 3). При этом показатель достигал уровня группы инфицированных МБТ. Следует также отметить, что содержание перфорина в группе ТВГЛУ/очаговый туберкулез сравнимы с аналогичным показателем группы инфицированных МБТ, что предполагает более эффективное функционирование этого звена противотуберкулезного иммунитета.
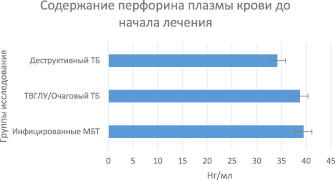
Рис. 1. Содержание перфорина плазмы крови у больных исследованных групп до начала курса химиотерапии
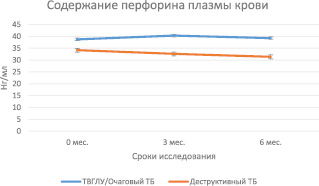
Рис. 2. Динамические изменения перфорина плазмы крови при проведении противотуберкулезной химиотерапии
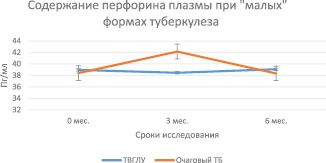
Рис. 3. Динамические изменения перфорина плазмы крови при проведении противотуберкулезной химиотерапии у больных ТВГЛУ и очаговыми формами туберкулеза
Данные о содержании в крови больных легочным туберкулезом CD4+ и CD8+ лимфоцитов, в том числе и продуцирующих цитолитические молекулы, достаточно противоречивы. Если при деструктивных формах туберкулеза отмечено достоверное снижение этих субпопуляций лимфоцитов по сравнению со здоровыми индивидами [4], то для больных туберкулезным поражением лимфоузлов такие данные отсутствуют. Методом ПЦР в реальном времени показано отсутствие различий уровня экспрессии CD4 мРНК и увеличение для CD8 мРНК in situ в ткани лимфоузлов положительных и отрицательных по наличию ДНК микобактерий по сравнению с тканью здоровых миндалин человека. Кроме того, этим же методом показано преобладание мРНК гранзима А, перфорина и гранулизина в ткани лимфоузлов больных туберкулезом отрицательных по обнаружению микобактерий туберкулеза по сравнению с биоптатами, где микобактерии были выявлены [7]. То есть отсутствие или временные колебания количества CD4+ и CD8+ лимфоцитов в крови можно объяснить явлениями компартментализации иммунного ответа в пользу очага воспаления. Повышение уровня перфорина в плазме крови у больных «малыми» формами туберкулеза может зависеть от аллельного полиморфизма локуса HLA-DR2 и, в частности, от отсутствия у больных с этими формами туберкулеза аллели DRB1*1501, что не приводит к снижению процента перфорин-положительных CD16+ и CD56+ [6]. Повышенный уровень перфорина плазмы также может отражать проявление аутокринного механизма, который регулирует баланс потребности в цитотоксических CD8+ лимфоцитах на поздних стадиях иммунного ответа [8]. Представленные нами данные о различиях и динамике изменений содержания перфорина в плазме больных деструктивными и «малыми» формами туберкулеза, вероятно, отражают баланс потребности в цитотоксических CD8+ лимфоцитах на различных стадиях этих форм туберкулезного процесса.

