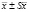В настоящее время внимание биологов привлекают различные физические факторы в связи с перспективой их использования как для создания ценного исходного материала для селекции, так и в качестве стимуляторов роста и развития растений.
Установлено, что физические факторы влияют на процесс прорастания семян, посевные качества, некоторые физиологические и цитологические изменения и, в частности, оказывают стимулирующее влияние на митотическую активность и рост растений [1–7].
Широкое применение как в медицине, так и растениеводстве получило лазерное излучение. Показано, что синий и красный свет лазера оказывает достоверное улучшение энергии прорастания, всхожести, силы роста и других показателей растения [1, 8–11].
Известно, что рост растений тесно коррелирует с процессами деления и растяжения клеток. Максимальное увеличение митотической активности, а также сокращение продолжительности клеточного цикла наблюдается в период наибольшей стимуляции роста и изучение данного вопроса открывает широкие возможности регулирования процессами органогенеза побега и растения в целом и, в конечном итоге – продуктивностью.
Основой ритмичности органообразовательных процессов является суточная периодичность митозов. Этот вопрос давно вызывал интерес исследователей. Не ослабевал он и в последующие годы продолжается и по сей день [12, 13].
На кафедре физиологии, генетики и молекулярной биологии КБГУ в течение многих лет ведутся исследования по влиянию физических, химических факторов на ростовые и органообразовательные процессы культурных растений.
Активно изучается влияние постоянных и переменных магнитных полей, ультрафиолетового, инфракрасного и лазерного излучения с целью поиска таких путей воздействия на семена, органы растений, которые привели бы к стимуляции их роста и развития, поскольку в литературе встречаются разноречивые сведения: о наличии стимулирующего эффекта, об отсутствии ответа на воздействие, а в некоторых случаях их ингибирования [5].
Таким образом, условия, при которых происходит реализация стимулирующего эффекта конкретного физического фактора, а также происходящие в растении ответные реакции на облучение требуют дальнейшего их изучения.
Целью данной работы была оценка влияния лазерного излучения на динамику митотической активности апикальной меристемы корешков луковицы Allium сера L., а также анализ ритма клеточного деления на протяжении суток.
Материалы и методы исследования
Наши исследования были проведены на стандартном тест-объекте, который был апробирован в течение длительного времени и известен как Alliumtest, сорт Штутгартен Ризен. Allium-test хорошо зарекомендовал себя как объект, на котором можно изучать эффект воздействия различных факторов на начальных этапах онтогенеза, а также использовать в цитогенетическом мониторинге окружающей среды.
Схема вариантов исследования была следующей:
1) контроль – необработанные луковицы;
2) луковицы, облученные лазером в течение 5 мин;
3) луковицы, облученные лазером в течение 10 мин.
Облучение провели с использованием твердотельного гелий-неонового лазера, мощностью 2 Вт, длиной волны 532 нм. Опытные варианты отличались временем экспозиции.
Проращивание луковиц провели в пробирках, где донце луковицы постоянно находилось на поверхности воды, при комнатной температуре (30–32 °) и естественном освещении. На каждый вариант опыта поставили по 10 луковиц. С момента появления корешков, а в последующем и надземной части луковиц, в течение двух недель, ежедневно, в одно и то же время, проводили промеры длины корешка и пера. Для получения точных результатов по показателю «длина корешка» измеряли все корешки на донце луковицы, а затем вычисляли их среднее значение.
Для проведения цитофизиологического анализа были использованы корешки трех, пяти и семидневных проростков. Фиксацию корешков проводили в растворе Карнуа (уксусный алкоголь) в течение 12 часов, затем корешки переносили в 70 ° спирт и хранили их в холодильнике. Давленые препараты готовили по методике, предложенной З.П. Паушевой [14], краситель – ацетокармин. В каждом варианте использовали по 10 корешков, просмотр вели в пяти полях зрения, в среднем по 100 клеток. Учитывали все клетки на стадии профазы, метафазы, анафазы и телофазы. Анализ препаратов провели на микроскопе Ломо «Микмед 5». Митотический индекс определяли по формуле
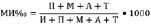 .
.
Математическую проверку провели по Б.А. Доспехову [15].
Для установления суточной периодичности митозов на третий день проращивания фиксировали корешки длиной 5–6 мм через каждые 3 часа (6, 9, 12, 15, 18, 21, 24, 3, 6). Для каждой пробы брали по 5 корешков, просмотр вели в трех полях зрения.
Интенсивность ростовых процессов определяли по формулам
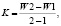
где W1 – длина на предыдущую дату;
W2 – длина на последующую дату;
2–1 – число дней между предыдущим и последующим днем.
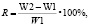
где R – относительная скорость;
W2 – длина на определенную дату;
W1 – длина на предыдущую дату.
Основу цитологических исследований составляет изучение митотической активности клеток, так как при ее повышении обеспечивается более активный рост проростков, что и является одним из факторов урожайности. Изучив большое количество образцов различных видов культурных растений, автор сделал заключение, что, используя цитофизиологический анализ, можно уже на ранних этапах онтогенеза прогнозировать конечный результат – продуктивность растения.
Результаты исследования и их обсуждение
Как показали полученные нами результаты, в корешках луковиц, облученных лазером, митотический индекс выше, чем в контроле (рис. 1).
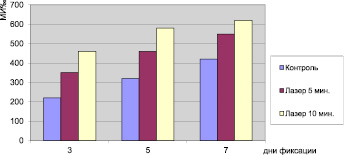
Рис. 1. Митотическая активность в меристеме корешков лука Allium cepa L.
При этом он повышается от третьего дня к седьмому, достигая к этому дню максимальной величины. Однако внутри опытных вариантов абсолютные показатели митотического индекса выше в меристеме корешков луковиц, облученных в течение 10 мин.
Учитывая то, что рост органа в длину находится в тесной связи с уровнем митотической активности меристематической ткани был проведен анализ динамики роста как длины корешка, так и надземной части (пера). Полученные результаты показывают, что все образцы из опытного варианта имеют показатели выше, чем в контроле, и относительная скорость роста у них была достоверно выше, чем в третьем варианте (таблица).
Интенсивность ростовых процессов корешков луковицы лука Allium сера L. в условиях опыта
|
Варианты |
Дни измерений |
Длина (мм)
|
Достоверность, t |
Скорость роста |
|
|
Абсолютная K (мм) |
Относительная R ( %) |
||||
|
1. Контроль |
3 5 7 |
15,2 ± 0,5 21,0 ± 0,6 30,0 ± 0,6 |
2,9 4,5 |
20,0 29,0 |
|
|
2. Лазер мощностью 2 Вт 5 мин |
3 5 7 |
16,8 ± 0,1 23,5 ± 0,5 35,6 ± 0,5 |
3,1 3,2 7,2 |
3,5 6,0 |
23,0 35,0 |
|
3. Лазер мощностью 2 Вт 10 мин |
3 5 7 |
18,8 ± 0,4 30,2 ± 0,7 44,4 ± 0,8 |
5,6 10,0 14,4 |
4,5 7,1 |
29,0 43,0 |
Промеры длины пера луковицы сохранили аналогичную закономерность. Максимальные показатели по длине пера отмечены в варианте, где луковицы облучались лазером в течение 10 мин, чуть ниже показатели во втором варианте. В контроле получены самые низкие величины.
Показано, что процессам роста свойственна периодичность, которая обуславливается как особенностями самих процессов роста, так и факторами внешней среды. У растений наиболее распространены циркадные ритмы с периодом около суток. С такой периодичностью изменяется и суточная динамика митозов [13].
Полученные нами результаты показали, что в условиях опыта в меристеме корней луковицы лука на протяжении суток четко проявляется периодичность клеточных делений. Нужно отметить, что суточный ход митозов не является равномерным, так как наблюдаются колебания, выражающиеся в подъемах и спадах активности деления клеток (рис. 2).
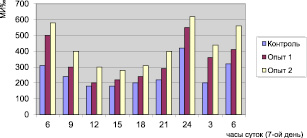
Рис. 2. Суточные изменения митотического индекса в условиях опыта
Динамика митотической активности в меристеме корня в контроле отмечена двувершинной кривой, где максимум делящихся клеток приходится на 24 и 6 часов утра и митотический индекс составил соответственно 420 и 320 ‰. Снижение деления клеток после первого подъема пришлось на 3 часа, затем вновь резко повторилась. В последующее время суток наблюдается чередование спада и подъема митотической активности. Минимальные значения митотической активности приходятся на 12 и 15 часов. В остальное время показатели МИ варьировали незначительно от 280 до 300 ‰, т.е. интенсивность клеточного деления в это время оставалось почти на одном уровне.
В целом во всех опытных вариантах характер изменения митотической активности в меристеме корешков луковицы сохраняется, т.е. время подъема и спада митотического индекса такое же как в контроле и пики митотической активности приходятся на 24 и 6 часов, в то же время в количественном отношении митотический индекс имеет более высокие значения в опытных вариантах, а максимальные показатели – в третьем варианте (лазер 10 мин).
Анализ встречаемости отдельных фаз митоза показывает, что к 6 часам утра в клетках меристем корешков луковицы в преобладающем количестве содержатся ана- и телофазы, в то время как в полночь – профазы.
Следует заметить, что ритм суточной активности может отличаться у разных видов растений и зависеть от разных причин. Так, у березы повислой максимальные значения МИ зафиксированы в 9 и 21 час, а в остальное время варьирование незначительное- от 3,6 до 4,8 ‰ [13], у пшеницы максимум делящихся клеток приходится на 8 и 16 часов.
Есть предположение, что суточная ритмика митотической активности может быть обусловлена ритмом биосинтеза белка и нуклеиновых кислот.
Заключение
Таким образом, лазерное облучение луковицы лука Allium сера длиной волны 532 нм, мощностью 2 ВТ, временем экспозиции 5 и 10 мин показал наличие стимулирующего эффекта, влияющего на процессы роста и развития на начальном этапе онтогенеза. Суточная ритмика апикальной меристемы корешка луковицы отличается двувершинным пиком. Максимальная митотическая активность у лука отмечена в полночь-24 часа и раннее утро 6 часов.
Знание пиков митотической активности может иметь практическое значение при проведении цитологического анализа при изучении митоза в клетках растений разных видов при выборе времени фиксации исходного материала.