Врожденные пороки развития сосудов являются причиной приблизительно 20 % смертей в неонатальном периоде, а также занимают значительное место в практике акушерства и гинекологии, медицинской генетике, детской хирургии и ортопедии, патологической анатомии [1]. Аномалии развития артерий и вен, такие как агенезия, аплазия, артериальные и венозные аневризмы, недоразвитие клапанного аппарата вен возникают при нарушении образования сосудистых стволов. По данным Brewster L., Robinson S., Wang R., Griffiths S., Li H., Peister A., Copland I., McDevitt T. (2017) нарушения ангиогенеза, критичные для жизни, наблюдаются среди населения в 1 % случаев [2], а связанные с заболеванием периферических артерий – в 10 % [3–5]. При этом традиционные варианты реваскуляризации возможны только у 50 % пациентов, остальным потребуются методы клеточной терапии, с использованием клеток костного мозга, мезенхимальных стволовых клеток (мск), обладающих большим потенциалом в качестве альтернативы реваскуляризационной терапии [6]. Nguyen H.L., Boon L.M., Vikkula M. (2017) указывают на то, что возникают сосудистые аномалии как следствие неправильного развития и регуляции ангиогенеза [7]. Исследуя ангиогенез, Varazashvili M.N., Mchedlishvili G.I. (1991), Mchedlishvili G.I. (1996) пришли к выводу, что агрегация эритроцитов вызывает нарушения кровотока и ишемию [8–10].
Знания о патофизиологических основах сосудистых аномалий резко возросли за последние 5 лет, дополнив теорию эмбриогенеза сосудистой системы молекулярно-генетическими находками [11]. Нарушения общих внутриклеточных сигнальных путей, часто активирующие мутации, по мнению автoров новых концепций, вызывают эндотелиальную клеточную дисфункцию [12–14]. Mathiyalagan P., Liang Y., Kim D., Misener S., Thorne T., Kamide C.E., Klyachko E., Losordo D.W., Hajjar R.J., Sahoo S. (2017) большую роль отводят СD34+ стволовым клеткам, которые, по их мнению, способны через паракринную секрецию влиять на ангиогенез. Подавляя и одновременно модулируя экспрессию генов, участвующих в ангиогенезе, ответственных за синтез сосудистого эндотелиального фактора роста, ангиопоэтина 1 и ангиопоэтина 2 (ANG1, ANG2), metallopeptidase 9 (MMP9), thrombospondin 1(TSP1), они оказывают терапевтический эффект при ишемии задних конечностей у мыши, что может быть перспективным для экстраполяции в медицинскую практику [15].
Предметом острых дискуссий является вопрос происхождения эндотелия. Rigato M., Fadini G.P. (2017) считают, что циркулирующие прогениторные клетки (circulating progenitor cells, СРС) и эндотелиальные прогениторные клетки (endothelial progenitor cells, ЕРС) являются незрелыми клетками, участвующими в сосудистой регенерации и связанными со многими аспектами макро-и микрососудистых заболеваний [16]. Lu W., Li X. (2017) считают стволовые/прогениторные клетки (VSCs) выполняющими ключевую роль в развитии организма и важным источником всех видов сосудистых клеток, необходимых для создания, поддержания, регенерации и ремоделирования кровеносных сосудов. Авторы выделяют четыре основных типа VSCs, в том числе эндотелиальные прогениторные клетки (Ерс), гладкие мышечные прогениторные клетки (SMPCs), перициты и мезенхимальные стволовые клетки (Мск) [17]. Lin C.S., Lue T.F. (2013) подвергают сомнению роль перицитов, как стволовых, с учётом экспериментальных доказательств их ингибирующих ангиогенез свойств и функционального разнообразия [18]. Мезенхимальные стволовые клетки (мск) существуют в большинстве тканей взрослого человека и располагаются вблизи или внутри кровеносных сосудов. Ibrahim M., Richardson M.K. (2017) свидетельствуют о важности изучения ангиогенеза, так как состояние этого вопроса тормозит развитие трансплантологии, методов репаративной регенерации во всех областях медицины, и на современном этапе имеет недостаточность в изучении на материале человека [19]. Guerin C.L., Rossi E., Saubamea B., Mignon V., Silvestre J.S., Smadja D.M. (2017), подтвердив результаты Банина В.В., Куприянова В.В., Karaganov J.L., Мчедлишвили, Welt с соавторами [20] выдвинули концепцию реваскуляризации критически ишемизированной конечности за счёт выделенных из костного мозга мелких эмбрионально подобных плюрипотентных эндотелиальных прогениторных клеток, способных дифференцироваться в эндотелиоциты с терапевтическим реваскуляризационным потенциалом [21].
Поскольку ангиодисплазии не относятся к казуистическим находкам, существует острая необходимость разработки стратегий консервативного лечения на основе клеточных технологий. Однако, по данным Kang J.M., Yoon J.K., Oh S.J., Kim B.S., Kim S.H. (2017), в клинической практике использование взрослых стволовых клеток имеет ряд ограничений, таких, как низкая выживаемость клетки и низкая терапевтическая эффективность [22]. Несмотря на значительные успехи в изучении ангиогенеза, наличие нескольких противоречивых концепций развития сосудов в теле эмбриона человека (из мезенхимы и целома), а также участия в ангиогенезе циркулирующих ангиобластов, свидетельствуют о том, насколько далека эта проблема от решения. Множество концепций ангиодисплазий учитывают экзо- и эндогенные, молекулярно-генетические, метаболические и другие факторы, которые на современном этапе не получили окончательного подтверждения, а теория эмбриогенеза сосудистой системы требует значительной доработки, поэтому гистогенез эндотелия на современном этапе является одной из важнейших проблем васкуло- и ангиогенеза [23]. Calderon G.A., Thai P., Hsu C.W, Grigoryan B., Gibson S.M., Dickinson M.E., Miller J.S. (2017) подтвердили исследования Banin V.V. [24]. Jeong H.W., Hernfndez-Rodriguez B., Kim J., Kim K.P., Enriquez-Gasca R., Yoon J., Adams S., Scholer H.R., Vaquerizas J.M., Adams R.H. (2017) указывают, что молекулярные механизмы, регулирующие эндотелиальную активность клеток на различных этапах сосудистого роста, ремоделирования, созревания и покоя, остаются неясными [25]. Васкуло- и ангиогенез представляют собой сложные процессы, которые требуют скоординированных изменений в эндотелиальных клетках [26]. Многочисленные гипотезы происхождения эндотелиоцитов трактуют их развитие в связи с теорией трех зародышевых листков [27]. Существенная роль кровеносных сосудов в тканях и органах человека, понимание функциональных свойств и основополагающей молекулярной основы VSC имеет решающее значение для фундаментальных исследований [28]. Современное неудовлетворительное состояние данных по вопросу эмбрионального ангиогенеза определило направление нашего исследования.
Цель исследования – изучить кровеносные сосуды эмбриона человека в эмбриональном периоде.
Материалы и методы исследования
Исследование выполнено с учётом положений Хельсинской декларации (2000) и с разрешением этического комитета ФГАОУ ВО «Дальневосточный федеральный университет». Биоптаты эмбрионов были получены в соответствии с приказом Минздравмедпрома РФ от 29.04.94 № 82 «О порядке проведения патологоанатомических вскрытий» и в соответствии с номенклатурой клинических лабораторных исследований МЗ РФ (приказ 21 февраля 2000 г. № 64). Изучен материал эмбрионов человека 3, 5, 8 недель эмбрионального развития. Распределение материала представлено в табл. 1.
Таблица 1
|
Количество материала |
Возраст эмбрионов |
||
|
3 недели |
5 недель |
8 недель |
|
|
12 |
11 |
14 |
|
|
Итого |
37 |
||
Таблица 2
|
Методы |
Гематоксилин и эозин |
CD68 |
CD163 |
|
Возраст/ количество |
|||
|
3 недели |
2 |
5 |
5 |
|
5 недель |
3 |
5 |
3 |
|
8 недель |
3 |
5 |
6 |
|
Итого |
37 |
||
В работе использованы классические морфологические методы исследования и иммуногистохимические для выявления локализации фагоцитов, имеющих рецепторы на маркеры CD68 и CD163 (табл. 2).
Возраст эмбрионов человека определяли методом Гроссера и по таблице, составленной на основании данных УЗИ, в зависимости от длины эмбриона (табл. 3, 4).
Таблица 3
Определение возраста по диаметру плодного яйца
|
0,8 см = 3 нед. 3 дня |
2,7 см = 6 недель |
4,7 см = 9 недель |
|
1,4 см = 4 нед. 3 дня |
3,4 см = 7 недель |
5,3 см = 10 недель |
|
2,0 см = 5 нед. 5 дней |
4,0 см = 8 недель |
6,0 см = 11 недель |
Таблица 4
Возраст эмбрионов и плодов человека по данным УЗИ
|
0,3 см = 3 нед |
3,2 см = 8 нед. 4 дня |
|
0,4 см = 3 нед. 1 день |
3,3 см = 8 нед. 4 дня |
|
0,5 см = 3 нед. 4 дня |
3,4 см = 8 нед. 5 дней |
|
0,6 см = 3 нед. 6 дней |
3,5–3,6 см = 9 недель |
|
0,7 см = 4 нед. 2 дня |
3,7 см = 9 недель |
В работе использованы современные высокочувствительные иммуногистохимические методы EPOS и En Vision. С помощью иммунной гистохимии выявлены различные фенотипы клеток, несущих маркеры CD68, CD163 фирмы DAKO, для последующего сравнительного анализа динамики их количества в ранний период онтогенеза человека и в условиях раннего ангиогенеза. Все статистические данные получены с помощью компьютерного программного обеспечения микроскопа Olympus BX51и цифровой камеры CD25 фирмы Olympus.
Результаты исследования и их обсуждение
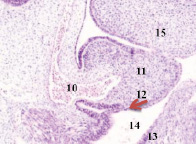
Нами установлено, что в конце 3-й – начале 4-й недели эмбрионального развития зародыш из 100-клеточного организма стремительно вырастает от 1,5 мм до 3,5 мм. На этом сроке начинается закладка всех систем будущего организма. Особенно важный этап – формирование нервной трубки, из которой в дальнейшем образуются головной мозг и вся нервная система. Головной конец эмбриона занимает больше половины всего объёма, около 2,5 мм, на туловище приходится 1,0 мм. В этот период углубляется желточная складка, образуется желточный стебель и наблюдается приподнятие зародыша в полости амниона (рис. 1, а). Сегментация дорсальной мезодермы достигает 10 сомитов, происходит её дифференцировка на миотом, склеротом и дерматом. В конце 3-й недели замыкается нервная трубка, увеличиваются мозговые пузыри на переднем полюсе эмбриона, отмечается закладка лёгкого, печени, сердца, поджелудочной железы и эндокринных желёз (рис. 1).
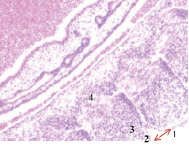
а) б)
в) г)
Рис. 1. Эмбрион человека. Начало 4-й недели эмбрионального развития человека. а) сомиты мезодермы; б) нервная трубка; в) печень; г) сердце, лёгкое. Окраска гематоксилином и эозином (а, в, г); гематоксилином (в). Ув. (а, в, г) х100; (б) х200. 1. Сомиты мезодермы. 2. Эктодерма. 3. Мезодерма. 4. Энтодерма. 5. Нервная трубка. 6. Эктомезенхима. 7. Кровеносный сосуд. 8. Трабекулы гепатоцитов. 9. Синусоиды. 10. Аорта. 11. Миокард. 12. Эпикард. 13. Перикард. 14. Спланхнотом. 15. Лёгкое
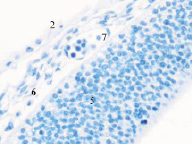
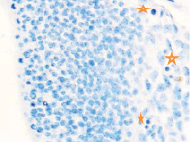
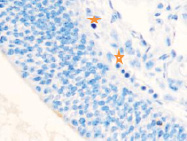
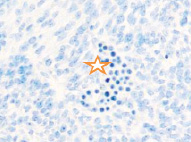
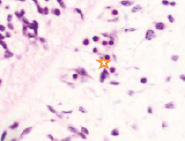
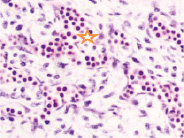
Именно в этот период происходят закладка и формирование кровеносных сосудов в различных отделах, как головного, так и туловищного отделов эмбриона. Отмечаются очаги формирования сосудов на переднем полюсе в области растущего переднего мозгового пузыря и в теле зародыша (рис. 2).
а) б)
в) г)
д)
Рис. 2. Эмбрион человека. Начало 4-й недели эмбрионального развития человека. а) передний мозговой пузырь; б) нервная трубка; в) мезодерма; г) мезенхима; д) в области перехода головного конца эмбриона в туловищный отдел. Звёздочками отмечены очаги васкулогенеза. Окраска гематоксилином и эозином (г, д); гематоксилином (а, б, в). Ув. х200
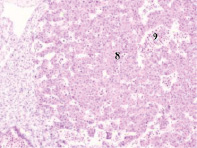
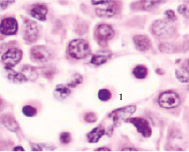
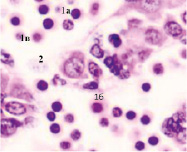
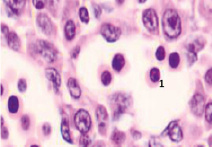
Следует отметить, что в ранние сроки эмбрионального развития в структуре нервной трубки и паренхиме сердца васкулогенез отсутствует. Трофика стенки формирующегося сердца в этот период осуществляется за счёт диффузии содержимого спланхнотома и просвета выходящей из верхушки сердца аорты. Также в отличие от других авторов, утверждающих, что в этот период в просвете формирующихся сосудов отсутствуют клетки, по нашим данным в них располагаются многочисленные мегалобласты. Более того, их заселение ткани в промежутках между клетками происходит до появления кровеносных сосудов. На этом этапе паренхима печени, представленная трабекулами гепатоцитов, имеет губчатое строение. В ячейках трабекулярных сетей пространства заполнены мегалобластами, часть из которых содержит крупные ярко окрашенные базофильные эксцентрично расположенные ядра и яркую оксифильную цитоплазму. Часть мегалобластов имеет признаки апоптоза, содержит пикнотизированные ядра. Также идентифицируются признаки митоза. Клетки с гомогенно окрашенными оксифильными ядрами крупнее клеток с бледно окрашенными и пикнотизированными ядрами в 1,5–2 раза. Периферия пространств, заполненных мегалобластами, представлена гепатоцитами, на некоторых участках уплощёнными Морфологическая картина печени эмбриона человека на 4-м месяце эмбриогенеза свидетельствует о том, что пространства, по которым циркулируют мегалобласты, ограничены уплощающимися гепатоцитами, в некоторых участках появляется мембрана. В рамках нашего исследования можно предположить, что кровеносные сосуды в структуре печени развиваются под влиянием взаимодействия мегалобластов и гепатоцитов. Кроме этого, в поле зрения идентифицируются безъядерные мегалоциты эллипсоидной формы, чаще полихроматофильные (рис. 3). В этот период развития они идентифицируются только в печени.
а)
б) в)
г)
Рис. 3. Эмбрион человека. Начало 4-й недели эмбрионального развития человека. Окраска гематоксилином и эозином. А) Печень с формирующимися трабекулами из гепатоцитов. Звёздочками отмечены пространства между трабекулами гепатоцитов, заполненных мегалобластами. 1. Мегалобласты: а) пикноз ядер; б) крупные клетки, в) мелкие клетки; в) гепатоциты. 2. Мегалоцит. Ув. а) х100; б, в, г) х400
Принято считать, что в результате неизвестных пока механизмов вентральная эндодерма первичной кишки приобретает способность получать сигналы из мезодермы сердца. Эти сигналы в форме различных факторов роста фибробластов и белков – регуляторов морфогенеза кости вызывают спецификацию клеток, которые будут формировать печень, и активацию специфичных для печени генов. В моделях на животных отмечено, что такая спецификация происходит еще до образования видимого зачатка печени [29]. На следующем этапе эти новые специфицированные клетки мигрируют в краниальном и вентральном направлении в область поперечной перегородки, и к 4-й неделе беременности начинается морфогенез печени. Рост и развитие вновь образованного зачатка печени требует его взаимодействия с эндотелиальными клетками [30]. Мы не нашли подтверждения данных других авторов о том, что энтодермальные тяжи печени сталкиваются с блуждающими мезенхимными клетками с морфологией мелких лимфоцитов и эндотелиальными клетками врастающих капилляров. Сравнительный анализ собственных данных показал, что в печени не только нет мезенхимы, врастающих капилляров, но и мегалобласты заселяют пространства между трабекулами гораздо раньше, чем происходит васкулогенез в печени.
Особенностями развития сосудов в печени, сердце и развивающемся мозге эмбриона можно объяснить не только формирование капилляров синусоидного типа в печени, но и органную специфичность капилляров других органов человека.
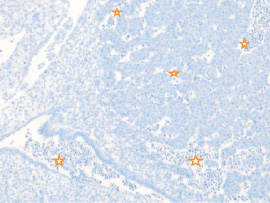
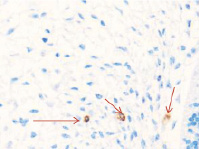
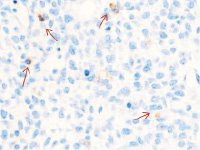
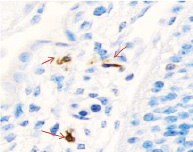
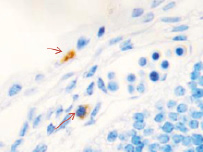
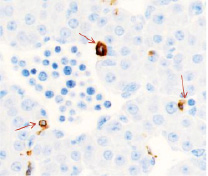
Методом иммунной гистохимии на выявление локализации клеток, несущих рецепторы на CD68 и CD163, выявлено, что самый ранний период развития эмбриона человека характеризуется положительной экспрессией клеток в эктомезенхиме головного конца эмбриона, мезенхиме вокруг или вблизи очагов васкуляризации в теле эмбриона человека (рис. 4).
а) б)
в) г)
д)
Рис. 4. Эмбрион человека. Начало 4-й недели эмбрионального развития человека. а) Мезенхима без сосудов; б) васкулогенез в мезенхиме; в, г) васкулогенез в эктомезенхиме. Иммунная гистохимия на выявление локализации CD68 и CD163. Стрелками указаны экспрессированные клетки. а, б – CD68; в, г – CD163. Ув. а, б) х200; в, г) х400
Нами отмечено, что в сосудах эмбриона отсутствуют клетки, имеющие положительную экспрессию на маркеры CD68 и CD163. Локализация маркеров отмечается исключительно вокруг или вблизи кровеносных сосудов. Также положительно экспрессируется часть клеток эктодермы головного конца эмбриона. В области сомитов эктодерма не содержит клетки, несущие маркеры CD68 и CD163.
Признанной концепцией считается утверждение о том, что сосудистая система (как кровеносная, так и лимфатическая) является одним из характернейших производных мезенхимы. По мнению большинства гистологов и эмбриологов, это относится, в частности, и к эндотелиальной выстилке сосудов. Наряду с этим существует предположение, что сосудистая система филогенетически возникла как система сильно разветвившихся выростов вторичной полости тела, или целома. Соответственно, эндотелиальная выстилка сосудов рассматривается как видоизменившийся в филогенезе целомический эпителий [31]. Возникновение сосудистого эндотелия из мезенхимы в эмбриогенезе, согласно утверждению Гаусманн, (1928), Н.Г. Хлопина, (1946), «является лишь кажущимся; в действительности же эндотелий сосудов берет начало из особого сосудистого зачатка – ангиобласта, клетки которого примешиваются к мезенхиме» Этот вопрос на современном этапе продолжает оставаться спорным и нуждается в дальнейшем экспериментальном выяснении.
По А.Г. Кнорре (1967), первые сосуды у зародышей высших позвоночных появляются в мезенхиме внезародышевых частей – желточного мешка, а, в частности, у высших приматов и человека – также хориона. В мезенхимном слое стенки желточного мешка и хориона сосуды возникают в форме плотных клеточных кучек – кровяных островков, сливающихся далее в сеть, причем периферические клетки перекладин этой сети, уплощаясь, дают начало эндотелию, а глубжележащие, округляясь, кровяным клеткам. В теле же зародыша сосуды развиваются в форме трубок, не содержащих кровяных клеток. Лишь позднее, после установления связи сосудов тела зародыша с сосудами желточного мешка, с началом биения сердца и возникновения кровотока, кровь попадает из сосудов желточного мешка в сосуды зародыша [31].
По другим данным, сосудистая система эмбриона закладывается на 5–10-й неделе внутриутробного развития в виде массы ангиобластических клеток, из которых в дальнейшем развивается капиллярная сеть, представляющая собой единую недифференцированную первичную сосудистую систему зародыша. Постепенно из нее образуются артериальные и венозные стволы с сохраненными между ними сетями шунтов. Далее некоторые артериальные стволы подвергаются обратному развитию или остаются в рудиментарном состоянии, другие же выливаются во вновь образованные сосуды. Отклонение от нормального развития кровеносных сосудов влечет за собой возникновение количественных и качественных изменений [32].
По нашим данным, сосуды в теле зародыша развиваются в конце 3-й – начале 4-й недели, после миграции мегалобластов, васкулогенез характеризуется сосудами с просветом, заполненным мегалобластами. В то время как в эктомезенхиме головного конца эмбриона и в мезенхиме его тела идентифицируются сосуды, в мезодерме, стенке сердца, нервной трубке и в печени они отсутствуют. В печени мегалобласты располагаются в просветах между трабекулами из дифференцирующихся гепатоцитов. Мезенхимоциты характеризуются положительной экспрессией на CD68 и CD163, в то время как мегалобласты не несут рецепторов на маркеры CD68 и CD163, функция антигенпрезентации и фагоцитоза является исключительной принадлежностью клеток формирующихся тканей развивающегося организма. Первыми экспрессируются клетки в эктомезенхиме головного конца эмбриона, затем в мезенхиме его тела, в дососудистый период, и вокруг сосудов в период васкулогенеза. В этот срок развития выражена экспрессия и репрессия генов, осуществляются клеточные иммунные реакции. Полученные данные подтверждают роль клеток, несущих маркеры CD68 и CD163 в морфогенезе и васкулогенезе.
Изучение васкулогенеза имеет огромное значение, так как постнатальный ангиогенез происходит под влиянием тех же индукторов и ингибиторов. В последнее время наблюдается значительный прогресс в изучении ангиогенеза, концепция об исключительном врастании в опухоль сосудов опровергнута и получены новые представления о механизмах формирования сосудов опухолей: миграция ангиобластов, что можно рассматривать в рамках нашей концепции эмбрионального васкулогенеза.
Работа выполнена при поддержке Научного фонда ДВФУ, в рамках государственного задания от 2014/36 до 2019 гг.

