Витамин Д связывающий белок (ВДБ), обозначаемый в литературе также как Gc-globulin, является переносчиком в плазме крови витамина Д и его метаболитов, которые в свою очередь поддерживают в организме человека уровень сывороточной концентрации кальция и гомеостаза электролитов. ВДБ является членом белкового семейства, в которое входят альбумин, α-фетопротеин и α-альбумин/афамин. ВДБ имеет молекулярную массу 52–59 kDa и обладает значительным полиморфизмом в виде трех основных электрофоретических вариантов Gc1F, Gc1S и Gc2, из которых 2 первых белка обладают большей аффинностью к 25 (OH)D. Каждый из метаболитов витамина Д имеет собственную константу аффинности к ВДБ. 25 (OH)-витамин D3 (кальцидиол) связывается с ВДБ на 88 % Ka = 4×10−7 M)., тогда как 1,25(OH)2-витамин D3 (кальцитриол), являющийся наиболее активным метаболитом витамина Д, связывается на 85 % (Ka = 4×10−7 M). В трех наиболее изученных вариантах ВДБ (Gc1F, Gc1S and Gc2) было выявлено около 120 редких вариантов, что говорит о значительном генетическом полиморфизме локуса ВДБ из всех на сегодня исследованных участков хромосом, кодирующих белковые структуры [1]. Основная масса ВДБ синтезируется в печени и в минорных количествах в моноцитах. Он имеет период полураспада 2,5 дня и содержится в плазме в концентрации 300–600 мкг/мл. Подобная высокая его концентрация играет важную роль в предохранении организма от интоксикации свободным витамином Д или служит своеобразным источником циркулирующего источника 25 (OH)-vitamin D3 [2].
Метаболит витамина Д кальцитриол (1, 25(OH)2D3) относится к иммуномодулирующим гормонам и через витамин Д-рецептор способен угнетать дифференцировку дендритных клеток, Т-хелперов, NK и цитотоксических Т-лимфоцитов. Показано, что кальцитриол снижает продукцию Тх-цитокинов и увеличивает продукцию супрессорных цитокинов TGF-β1 и IL-4. При туберкулезе активация микобактериальными антигенами ТОЛЛ-рецепторов приводит к повышению экспрессии витамин Д рецепторов и 1α-дегидрогеназ, которые индуцируют продукцию кателицидина и киллинг M. Tuberculosis [3].
Помимо вышеописанной функции ВДБ способен связывать метаболиты белка цитоскелета актина, распадающегося при повреждениях тканей, и вызывающего повреждение микроциркуляторного русла с последующей функциональной недостаточностью внутренних органов. ВДБ участвует в жировом обмене, связывая мононенасыщенные и полиненасыщенные жирные кислоты, которые снижают аффинность 25(OH)-витамина D3 и 1,25(OH)2-витамина D3 [4].
Имеются исследования, показывающие участие ВДБ в различных компонентах воспалительных реакций. Гликозидазы Т и В клеток дегликозилируют ВДБ, превращая его в макрофаг-активирующий фактор, и инициируют проапоптотические процессы в этих клетках.
ВДБ также способен усиливать хемотаксическую активность С5а компонента комплемента посредством связывания с CD44 на мембране нейтрофилов и макрофагов, выступая в качестве кофактора С5а компонента комплемента [5].
Выявление ВДБ в сыворотке при заболеваниях легких проводилось в основном у больных неспецифическими заболеваниями легких. Повышенный уровень этого фактора был выявлен в бронхоальвеолярном лаваже у детей бронхиальной астмой, резистентной к проводимой терапии, причем была показана корреляционная зависимость между концентрацией ВДБ и нейтрофилов и не выявлено корреляционной зависимости между этим фактором и содержанием в смыве лимфоцитов, макрофагов и эозинофилов. Не выявлено также связи с наличием у этих больных астматического статуса. Однако наиболее интересные данные по выявлению этого белка получены при изучении плазмы больных саркоидозом. Авторы изучали содержание свободного ВДБ и его содержание в комплексе с экзосомами, которые имеют размер 30–150 нм и являются производными эндосом клеток. Они выполняют роль клеточных посредников и в зависимости от клеточного микроокружения могут стимулировать или угнетать клетки иммунного ответа через индукцию ИНФ-γ, ИЛ-8, протеинов и энзимов вовлеченных метаболизм лейкотриенов. Было показано, что уровень свободного ВДБ плазмы больных саркоидозом достаточно низкий и практически не отличается от группы здоровых добровольцев. ВДБ связанный с экзосомами определялся у больных в достоверно более высокой концентрации. Помимо этого фактора в более высоких концентрациях с экзосомами были связаны различные гликопротеины, липополисахарид-связывающий белок, кининоген-1, лактотрансерин, протромбин, серотрансферрин, гаптоглобин, аполипопротеин, белки мембрано-атакующего комплекса (МАС) и ферменты метаболизма лейкотриена 4 [3].
Исследования по содержанию ВДБ в сыворотке больных туберкулезом представлены в единичных исследованиях. Так, при сравнении гематологических параметров и различных медиаторов воспаления у 45 пациентов африканского и 83 пациентов евразийского происхождения с впервые выявленным туберкулезом легких, проживающих на территории Великобритании, было показано, что больные африканского происхождения имели более низкие показатели нейтрофилов периферической крови, сывороточные концентрации хемокинов CCL2, CCL11 и ВДБ, но более высокие показатели CCL5 и антиген- стимулированной продукции ИЛ-12 и антагониста ИЛ-1 α рецептора. Однако различия в содержании сывороточного ВДБ были связаны с электрофоретическим генотипом. Самые низкие концентрации наблюдались у носителей генотипа Gc1F / 1F, а высокие у пациентов с генотипом Gc1S / 1S вне зависимости от этнической группы. Связи концентрации ВДБ и электрофоретического генотипа Gc2/2 и Gc2/1 не выявлено. Не показано также значимых динамических изменений этого фактора после проведенной интенсивной фазы противотуберкулезной химиотерапии или генотипа микобактерий. Однако было отмечено, что носители генотипа Gc2/2 и Gc2/1 продуцируют ИНФ-γ в больших количествах после стимуляции антигенами ESAT-6 /CFP-10, чем носители генотипа Gc1/1 [6].
Целью настоящего исследования явилось выявление динамических изменений витамин Д связывающего белка у детей и подростков с деструктивными и «малыми» формами туберкулеза органов дыхания в процессе проведения противотуберкулезной химиотерапии.
Материалы и методы исследования
Исследование проведено на 49 больных, разделенных на три группы. В группу больных с деструктивным туберкулезом включено 13 человек в возрасте от 14 до 17 лет. Инфильтративный туберкулез в фазе распада и обсеменения диагностирован у 6 человек, диссеминированный туберкулез в фазе распада – у 3-х человек, множественные туберкулемы в фазе распада и обсеменения – у 2-х человек, фиброзно-кавернозный туберкулез – 1 человек и казеозная пневмония – 1 человек.
В исследование включено 27 больных в возрасте от 3 до 16 лет с «малыми» формами туберкулеза органов дыхания. ТВГЛУ диагностирован у 14 человек, в том числе с очагами отсева в легочную ткань – 5 человек; очаговый туберкулез легких – 13 человек Большинство процессов были выявлены в фазе начинающейся кальцинации – 12 чел. и реже в фазе уплотнения – 10 чел., и в фазе инфильтрации – 5 чел.
Группу инфицированных МБТ составили 9 пациентов в возрасте от 5 до 14 лет, обратившихся по поводу контакта с больными туберкулезом и имевших положительные реакции на пробу Манту с 2 TE и Диаскинтест.
Витамин Д связывающий протеин определяли в К3ЭДТА плазме методом иммуноферментного анализа с помощью набора SEB810Hu (Cloud-Clone Corp.), образцы плазмы разводили согласно инструкции изготовителя. Диапазон определения тест-системы 0,156 – 10 нг/мл, минимальная определяемая концентрация 0,156 нг/мл. Полученные данные представлены в тексте в единицах мг/мл. Результаты обрабатывались статистически с помощью пакета Microsoft Exel.
Результаты исследования и их обсуждение
Проведенное исследование показало, что до начала проведения специфической противотуберкулезной химиотерапии содержание витамин Д связывающего протеина плазмы в группах больных с деструктивным туберкулезом и «малыми формами» туберкулеза органов дыхания статистически не отличались от такового в группе инфицированных МБТ. Проводимая химиотерапия не влияла на содержание плазменного витамин Д связывающего протеина (таблица, рис. 1).
Концентрация витамин Д связывающего протеина (в мг/мл) плазмы крови больных исследованных групп
|
Срок исследования Группы наблюдения |
0 мес. |
3 мес. |
6 мес. |
|
Деструктивный ТБ |
1,59 ± 0,15 |
1,54 ± 0,03 |
1,65 ± 0,1 |
|
ТВГЛУ/очаговый ТБ |
1,65 ± 0,07 |
1,57 ± 0,06 |
1,67 ± 0,07 |
|
Инфицированные |
1,5 ± 0,04 |
– |
– |
|
ТВГЛУ |
1,77 ± 0,1**v |
1,77 ± 0,05*** |
1,9 ± 0,09 * |
|
Очаговый ТБ |
1,5 ± 0,08 |
1,4 ± 0,08 |
1,46 ± 0,07 |
Примечания: *Р = 0,00230 по сравнению с группой очагового туберкулеза;
**Р = 0,0209 по сравнению с группой инфицированных;
***Р = 0,04702 по сравнению с группой очагового туберкулеза;
vР = 0,0456 по сравнению с группой очагового туберкулеза.
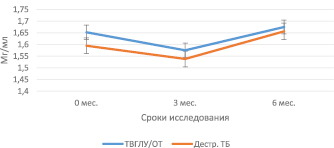
Рис. 1. Динамика витамин Д связывающего протеина плазмы крови у больных деструктивным и «малыми» формами туберкулеза органов дыхания
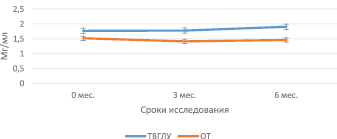
Рис. 2. Динамика витамин Д связывающего протеина плазмы крови у больных ТВГЛУ и очаговыми формами туберкулеза органов дыхания
Поскольку в группу «малых» форм туберкулеза входят две клинико-анатомические формы – туберкулез внутригрудных лимфатических узлов (ТВГЛУ) и очаговый туберкулез легких, мы рассмотрели динамику изменений плазменного витамин Д связывающего протеина в этих подгруппах. Показано, что содержание витамин Д связывающего протеина у больных ТВГЛУ до начала лечения было достоверно выше по сравнению с группой инфицированных МБТ (1,77 ± 0,1 мг/мл и 1,5 ± 0,04 мг/мл, Р = 0,08415 соответственно) (таблица, рис. 2). Показатели витамин Д связывающего протеина у больных ТВГЛУ были также достоверно выше, чем у больных очаговым туберкулезом до начала лечения и через 3 и 6 месяцев специфического лечения (0 мес. – 1,77 ± 0,1 и 1,5 ± 0,08, Р = 0,0456; 3 мес. – 1,77 ± 0,05 мг/мл и 1,4 ± 0,08 мг/мл, Р = 0,04702 и 6 мес. – 1,9 ± 0,09 мг/мл и 1,46 ± 0,07 мг/мл, Р = 0,00230, соответственно) (таблица, рис. 2).
Заключение
Оценить значимость полученных нами данных о более высоком содержании витамин Д связывающего протеина у больных ТВГЛУ достаточно трудно, поскольку в немногочисленных исследованиях по его количественному содержанию в сыворотке в основном исследовались взрослые контингенты больных туберкулезом и вне связи с клиническими формами заболевания. Кроме того методически исследования строились на определении концентрации трех основных электрофоретических вариантов ВДБ Gc1F, Gc1S и Gc2 и для варианта Gc2 показана более высокая ассоциация с заболеваемостью туберкулезом и более высокая продукция ППД-стимулированной продукции интерферона -γ по сравнению с носителями вариантов Gc1F и Gc1S [7]. В проведенном исследовании также показано отсутствие динамических изменений концентрации ВДБ в процессе лечения у детей и подростков как с деструктивными, так и с «малыми» формами туберкулеза органов дыхания, однако выявлены достоверно более высокие показатели ВДБ у больных с ТВГЛУ по сравнению с очаговыми формами туберкулеза. Учитывая наличие различий в сывороточном содержании различных электрофоретических вариантов ВДБ [7], а также показанную на больных саркоидозом роль ВДБ, связанного с экзосомами [3], дальнейшие исследования динамики ВДБ целесообразно проводить с использованием этих более показательных методических подходов. Поскольку одной из основных функций ВДБ является инактивация метаболита кальцитриола, усиливающего избыточную продукцию супрессорных цитокинов IL-4 и TGF-β1, а содержание последнего фактора достаточно высоко в плазме больных ТВГЛУ [8], следует предположить регулирующую роль ВДБ в поддержании баланса продукции TGF-β1 у этой группы больных.

