Одной из самых актуальных проблем в хирургии является перитонит [1]. Актуальность определяется тремя основными факторами: широчайшей распространенностью заболевания, высокой летальностью, наличием сложных и многочисленных нарушений гомеостаза [2]. Применение современных методик (антибиотики широкого спектра действия, иммуномодуляторы нового поколения, экстракорпоральные методы детоксикации и т.д.) не дает существенного снижения летальности [2, 3]. В настоящее время, несмотря на развитие современной фармакологической индустрии, ощущается недостаток в выборе эффективного антибактериального средства в борьбе с перитонитом [4, 5]. Таким образом, все вышеперечисленные аргументы указывают на то, что методы санации брюшной полости нуждаются в доработке. Топическое использование противомикробных средств, депонированных в полимерных имплантах, улучшает результаты лечения, так как в этом случае антибактериальное средство действует локально, в зоне развития микробного воспаления, а также уменьшает вероятность перитонеальной адгезии и последующего спаечного процесса. Цитологическое исследование является одним из важнейших преимуществ сравнения и динамического изучения эффекта применения новых методов лечения воспалительных заболеваний.
Целью работы явилось изучение в сравнительном аспекте цитологической картины, формирующейся в брюшной полости, в процессе экспериментальной апробации образцов полимерных пленчатых имплантов в инфицированных условиях, а также выявление их влияния на течение острого воспалительного процесса.
Материалы и методы исследования
В качестве материала для экспериментальных исследований был использован антибиотик Цефтриаксон и образец полимерных мембран, разработанный ООО «Линтекс» (г. Санкт-Петербург): 76 MHR. В ранее проведенных исследованиях этот образец показал высокую степень адгезии (позволяет фиксировать его бесшовным способом); адекватные сроки деградации (от 7 дней, чего вполне достаточно, чтобы достичь необходимого эффекта); полное рассасывание (исключает необходимость повторных оперативных вмешательств для его извлечения) [6, 7]. Цефтриаксон был выбран в связи с его широким спектром антимикробной активности, наилучшими фармакокинетическими показателями, он обладает стабильностью по отношению к β-лактамазам и высокой проницаемостью через стенку грамотрицательных микроорганизмов [8, 9]. Данный антибиотик был взят в минимальной подавляющей концентрации в тканях – МПК (0,008 мг/мл), так как эта концентрация обладает одновременно бактерицидным действием и лимфостимулирующим [10, 11]. Опыты проводились в соответствии с конвенцией «О защите позвоночных животных, используемых для экспериментов или в иных целях», принятой Советом Европы (г. Страсбург, Франция 1986 г.), и директивой Совета 86/609/EEC от 24.11.86 г., по согласованию законов, правил и административных распоряжений стран-участниц в отношении защиты животных, используемых в экспериментальных и других научных целях. Эксперимент был выполнен на лабораторных крысах-самцах, линии Вистар, массой 250–300 г. Перед введением в эксперимент все животные находились на двухнедельном карантине в экспериментально-биологической клинике (виварии) Курского государственного медицинского университета.
Для моделирования инфицированных условий путем передозировки наркоза умерщвлялось одно животное. Из содержимого слепой кишки этого животного готовилась 10 % взвесь фекалий в изотоническом (0,9 %) водном растворе хлорида натрия. Полученная смесь после однократной фильтрации через четыре слоя марли вводилась интактным животным под наркозом пункционным способом из одного вкола (в центре белой линии живота) в правую и левую подвздошные области из расчета 0,5 миллилитров на 100 граммов массы животных не позднее чем через 20 минут после приготовления (для максимального сокращения потери анаэробной микрофлоры) [12]. Экспериментальных животных (39 крыс) делили на 3 группы. Первой группе (15 крыс) через 12 часов после моделирования инфицированных условий выполняли переднюю срединную лапаротомию, двукратное промывание брюшной полости 0,02 % раствором фурацилина, после чего туда помещали 2 антибактериальные мембраны размером 1х2 см. Для обеспечения длительного бактерицидного действия Цефтриаксона в очаге инфекции, перед использованием мембраны находились в растворе антибиотика (0,008 мг/л) 20 минут. Второй группе (12 крыс) было выполнено только промывание брюшной полости фурацилином. Третьей группе (12 крыс) после моделирования инфицированных условий лечение не производилось. Для оценки цитологической картины проводился микроскопический анализ экссудата, взятого из брюшной полости через 12 часов после моделирования, а также на 7 и 14 сутки, окрашенный по Романовскому – Гимзе. Оценивалось количество макрофагов, нейтрофилов и лимфоцитов, в связи с тем, что соотношения этих трёх групп клеток и даёт представление о характере и интенсивности течения воспалительного процесса. Статистическая обработка результатов проводилась путем вычисления среднего значения, стандартного отклонения, доверительного интервала. Методом доверительного интервала сравнивалась группа № 1 с группами № 2 и № 3. Все расчеты выполнялись с помощью аналитического пакета приложения Microsorft Excel Office 2010, лицензией на право использования которой обладает ФГБОУ ВО КГМУ Минздрава России.
Результаты исследования и их обсуждение
В ходе данного исследования, направленного на изучение антимикробных свойств полимерных пленчатых имплантатов, получены следующие результаты, представленные ниже. Клинически через 12 часов после моделирования – крысы малоподвижны, заторможены, группируются в углу клетки, выглядят вялыми, апатичны к еде, отмечается частое поверхностное дыхание, сухость кожи и взъерошенность шерсти. Цитологические данные (рис. 1) приведены для подтверждения результатов моделирования.
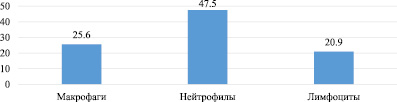
Рис. 1. Число клеток в поле зрения цитологического мазка экссудата брюшной полости через 12 часов после моделирования инфицированных условий
При микроскопии было обнаружено, что клеточный состав экссудата, взятого через 12 часов после моделирования инфицированных условий, представлен в основном лимфоцитами, макрофагами и нейтрофилами. Среди них значительно преобладала одна фракция – нейтрофилы. Это свидетельствует о течении острого инфекционного процесса в брюшной полости, т.е. использованная методика позволяет в эксперименте воспроизводить перитонит, близкий к таковому в клинике. Показатели летальности, приведенные ниже (табл. 1), указывают на улучшение результатов лечения у животных после операции с применением антибактериальных полимерных имплантов.
Таблица 1
Показатели летальности животных в течение исследования
|
Группа |
Через 12 часов после операции |
7-й день |
14-й день |
|
№ 1 (с применением имплантов) |
2 (13,3 %) |
2 (13,3 %) |
0 |
|
№ 2 (без применения имплантов) |
2 (16,6 %) |
5 (41,6 %) |
3 (25 %) |
|
№ 3 (без операции) |
– |
11 (91,6 %) |
1 (8,4 %) |
В третьей группе животных обнаруживается самая высокая летальность, во второй она ниже, но остаётся на достаточно высоком уровне. Наилучшие показатели наблюдались в первой группе, это говорит о том, что только лишь санации брюшной полости зачастую оказывается недостаточно. Динамическое наблюдение за числом клеток экссудата брюшной полости и их соотношением (рис. 2–3) позволило удостовериться в положительном эффекте мембран.
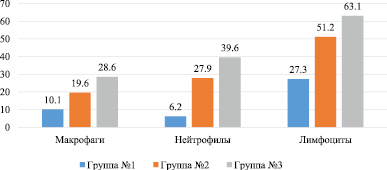
Рис. 2. Число клеток в поле зрения цитологического мазка экссудата брюшной полости на 7 день эксперимента
К седьмому дню количество нейтрофилов значительно уменьшилось, но возросло число лимфоцитов. В третьей группе наблюдаются самые высокие показатели. Во второй группе значения на порядок больше, чем в первой. Таким образом, если соотнести показатели летальности и клеточный состав экссудата на 7 день, то можно сделать заключение, что применение антибактериальных мембран способствует эффективному купированию острого инфекционного процесса.
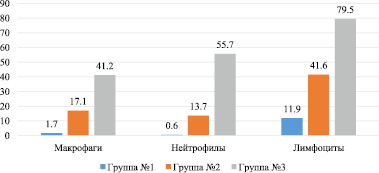
Рис. 3. Число клеток в поле зрения цитологического мазка экссудата брюшной полости на 14 день эксперимента
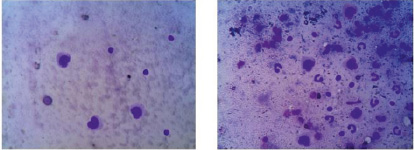
А Б
Рис. 4. Микрофото. Клеточный состав экссудата брюшной полости: А – группа № 1; Б – группа № 2. Окраска по Романовскому – Гимзе. ув. *400
Как видно на диаграмме, к 14 дню в первой группе нет нейтрофилов, обнаруживается небольшое число лимфоцитов и единичные макрофаги. Это свидетельствует о том, что завершилось очищение очага воспаления от микроорганизмов и продуктов альтерации тканей. Ведущая роль в этом, а также в процессах пролиферации, отводится макрофагам и лимфоцитам. Именно поэтому к данному сроку в группе № 1 обнаруживаются эти клетки. На микрофотографиях (рис. 4) существенно выражены различия в количестве лейкоцитов между 1 и 2 группами.
В экссудате второй группы животных можно заметить палочкоядерные нейтрофилы, в то время как в первой – их нет. Что и отражают морфометрические данные, приведённые в данном исследовании (табл. 2). Методом доверительного интервала было выявлено статистически значимое действие антибактериальных имплантов на уровень содержания лейкоцитов в экссудате брюшной полости.
Таблица 2
Клеточный состав и количество клеток в поле зрения цитологического мазка экссудата брюшной полости
|
Срок выведения из эксперимента день/номер группы |
Макрофаги |
Нейтрофилы |
Лимфоциты |
|
Через 12 часов после моделирования |
25,6 ± 3,92 |
47,5 ± 6,31 |
20,9 ± 6,08 |
|
7/группа № 1 (с применением иплантов) |
10,1 ± 3,283,4 |
6,2 ± 2,393,4 |
27,3 ± 7,53,4 |
|
t |
1,66 |
1,21 |
3,79 |
|
7/группа № 2 (без применения имплантов) |
19,6 ± 4,792,4 |
27,9 ± 5,382,4 |
51,2 ± 4,492,4 |
|
t |
2,42 |
2,72 |
2,27 |
|
7/группа № 3 (без операции) |
28,6 ± 6,192,3 |
39,6 ± 6,342,3 |
63,1 ± 5,082,3 |
|
t |
3,13 |
3,21 |
2,57 |
|
14/группа № 1 |
1,7 ± 1,496,7 |
0,6 ± 0,846,7 |
11,9 ± 4,66,7 |
|
t |
0,76 |
0,43 |
2,33 |
|
14/группа № 2 |
17,1 ± 3,285,7 |
13,7 ± 4,695,7 |
41,6 ± 5,195,7 |
|
t |
1,66 |
2,37 |
2,63 |
|
14/группа № 3 |
41,2 ± 6,975,6 |
55,7 ± 3,465,6 |
79,5 ± 7,495,6 |
|
t |
3,53 |
1,75 |
3,79 |
Примечание: 2,3,4,5,6 – наличие статистически значимых отличий при p ≤ 0,05 с соответствующим сроком наблюдения. M – среднее арифметическое; m – стандартное отклонение; t – доверительный интервал.
Проанализировав изменения соотношений между фракциями лейкоцитов, становятся заметны сходства в 1 и 2 группах: постепенно снижается число нейтрофилов и увеличивается количество лимфоцитов. То есть с применением методов оперативного лечения инфекционный воспалительный процесс купируется. Однако в группе, где использовались антибактериальные импланты, положительные изменения наступают значительно быстрее. Это отражается в снижении нейтрофилов к седьмому дню эксперимента: в первой группе их число снизилось в 7,3 раза, в то время как во второй группе – в 1,7 раз.
Заключение
По результатам исследования было выявлено, что морфологический состав клеток при остром микробном воспалении брюшной полости представлен нейтрофилами, макрофагами и лимфоцитами. По итогам морфометрического подсчета клеточного состава можно сказать, что наименьшее число нейтрофилов, макрофагов и лимфоцитов наблюдается в 1 группе. Более выраженное снижение количества лейкоцитов, по сравнению со второй группой, говорит о большей эффективности антибактериальных имплантов. Подтверждают это и низкие показатели летальности в первой группе. Полученные в работе результаты свидетельствуют о том, что использование антибактериальных полимерных имплантов – это эффективный метод купирования острого инфекционного воспалительного процесса. Безусловно, санация является незаменимой составляющей в лечении перитонита, однако после операции в брюшной полости создаются благоприятные условия для развития микробной флоры, что приводит к рецидиву воспалительного процесса. Чтобы избежать этого, в очаге инфекции необходимо создать условия для пролонгированного действия антимикробного средства. Именно для этого необходимы полимерные мембраны, которые помогают обеспечить локальное длительное действие антибиотика.

