Развитие промышленных производств, научных исследований и решений экологических задач делает весьма актуальными разработку и производство миниатюрных, высокочувствительных, быстродействующих приборов, предназначенных для прямого селективного, полностью автоматизированного определения различных химических веществ в промышленных и природных объектах. С развитием микропроцессоров и микро-ЭВМ, позволивших миниатюризировать и резко удешевить систему обработки информации, приходится отказываться от многих химических сенсоров, разработанных ранее. Основные недостатки многих из существующих химических сенсоров – громоздкость, нестабильность, отсутствие электрического выхода, дороговизна, необходимость в проведении таких длительных операций, как взвешивание, фильтрация, титрование, перегонка и др.
Миниатюризация химических датчиков различных газов часто требует отказа от старых подходов и привлечения новых физических и физико-химических принципов работы. Перспективными по совокупности параметров (малый вес и размеры, низкая стоимость, экономичность, высокая надежность и точность) являются полупроводниковые газочувствительные сенсоры. Среди существующих типов химических сенсоров, отличающихся технологией изготовления: керамических, толстопленочных, тонкопленочных и сенсоров на основе полупроводниковых структур – последние два типа являются наиболее перспективными. Это связано с возможностью использования современной микроэлектронной технологии, позволяющей получать в условиях массового производства большие партии дешевых приборов, с одновременным снижением энергопотребления и материалоемкости анализаторов. Вместе с этим такие важные характеристики химических сенсоров, как селективная газочувствительность, длительная стабильность и воспроизводимость рабочих характеристик, целиком определяются свойствами материала, на поверхности которого протекают сложные каталитические превращения при адсорбции различных частиц из окружающей среды.
Цель исследования: изучение механизмов газочувствительности термохимических сенсоров на основе тонких металлических слоев платины и палладия по отношению к различным газовым средам. Выбор материалов был продиктован, с одной стороны, их высокой каталитической активностью, с другой – высокой стабильностью электрических характеристик слоев при высоких температурах.
Результаты исследования и их обсуждение
Как только полупроводник приводится в соприкосновение с газовой средой, его поверхность начинает заполняться газовыми молекулами, т.е. начинается процесс адсорбции. Этот процесс продолжается до тех пор, пока между поверхностью и газовой средой не установится равновесие, при котором число газовых молекул, проходящих за единицу времени на поверхность из газовой фазы, уравновешивается числом молекул, уходящих за тот же промежуток времени с поверхности в газ. Появление адсорбированных молекул на поверхности полупроводника приводит к изменению ее свойств. Таким образом, адсорбция представляет собой тот инструмент, с помощью которого внешняя среда воздействует на свойства поверхности, а через нее также на некоторые объемные свойства полупроводника.
Адсорбционное равновесие устанавливается в течение некоторого времени [1].
В случае установившегося равновесия число газовых молекул N, удерживаемых на единице поверхности, зависит от внешних условий, т.е. от давления P и температуры:
N = N(p, T), (1)
Уравнение (1) представляет собой уравнение состояния. Если в этом уравнении считать T = const, мы получаем уравнение изотермы. При р = const уравнение (1) является уравнением изобары. Значение N при заданных р и Т выражает собой адсорбционную способность поверхности и зависит от величин, характеризующих природу и состояние поверхности и входящих в (1) в качестве параметров.
Образцами для измерений служили термокаталитические сенсорные структуры на основе тонких металлических слоев платины (Pt). Они представляли собой пластину кремния с размерами 1,5*0,7 мм и толщиной 150 мкм с окислом толщиной 1000 А на поверхности. На этой пластине с помощью фотолитографии и магнетронного распыления платины (Рt) формировался металлический слой шириной 200 мкм и толщиной ≈ 0,1 мкм. Затем эта пластина была покрыта тонким (30*40 А) слоем палладия для увеличения каталитической активности. Этот слой не оказывал влияния на температурную зависимость сопротивления слоя платины. Затем методом термокомпрессии к контактным площадкам были приварены золотые проволочки диаметром 30 мкм. Обратная сторона пластины покрывалась золотом толщиной 600 А для того, чтобы уменьшить процесс теплоотдачи.
Для проведения измерений такая структура распаивалась на ножки корпуса
ТО – 5 и помещалась в измерительный патрон. С одной стороны сходный патрон имел патрубок для измерений в потоке газовой смеси. С другой стороны два электрических вывода для подключения к измерительной схеме.
Измерения газочувствительных характеристик проводились на установке, состоящей из трех основных частей:
- комплекса электроизмерительных приборов, источников питания и блоков управления;
- измерительного патрона с корпусированой тестовой структурой;
- системы приготовления и подачи газовых смесей необходимого состава.
Схема электрических измерений позволяла нагревать исследуемые структуры до требуемых температур пропусканием через них регулируемого по величине постоянного тока. При этом сопротивление структур определялось по отношению падения напряжения к протекающему через образец току.
Система приготовления и подачи газовой смеси состояла из газовой и воздушной линий. В воздушную линию входили миникомпрессор, воздушный фильтр и ротоветр, позволяющий контролировать поток воздуха в литрах в час в соответствии с его предварительной градуировкой. Исследуемый газ подавался из баллона через редуктор, регулятор расхода газа на вход трехходового крана, который обеспечивал в одном положении прохождение газовой смеси в вентиляцию, а в другом положении пропускал газовую смесь в тройник, где она добавлялась в общий поток воздуха, непрерывно поступающего в измерительный патрон.
Концентрация исследуемого газа (n, об. %) в общем воздушном потоке определялась выражением [2]:
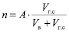 [об. %], (2)
[об. %], (2)
где А – процентное содержание исследуемого газа в исходном баллоне;
Vг.с – скорость потока газовой смеси в литрах в час;
Vв – скорость потока воздуха в литрах в час (л/ч).
Измерение температуры пленки производилось по изменению ее сопротивления. Предварительно снималась температурная зависимость сопротивления пленки Рt. В качестве нагревателя использовался термостат, который позволял устанавливать и поддерживать постоянной температуру в диапазоне от комнатной до 150 °С. Температура измерялась ртутным термометром. Сопротивление определялось как отношение падения напряжения к протекающему току, для чего были использованы амперметр и вольтметр. Такая установка позволяла измерять сопротивление при малых токах, исключая влияние на сопротивление нагрева джоулевым теплом.
В процессе исследования изучались следующие характеристики термохимических сенсоров:
1) температурная зависимость сопротивления образца;
2) зависимость температурного коэффициента сопротивления (ТКС) металлических слоев из Pt + Pd от их сопротивления при комнатной температуре;
3) тепловые характеристики сенсоров в зависимости от конструкционных факторов;
4) температурные зависимости теплового эффекта каталитических реакций взаимодействия молекулярных водорода и монооксида углерода с кислородом;
5) концентрационные зависимости теплового эффекта этих реакций.
Зависимость сопротивления исследуемого образца от температуры (в исследуемом диапазоне) является линейной (рис. 1). Температурная зависимость сопротивления металлов имеет вид [3]:
R = R0(1 + aT), (3)
где R0 – сопротивление металла при 0 °С, Т – температура металла в °С.
Из (3) получаем выражение
Т = (R – R0)/R0a. (4)
Видно, что для того, чтобы определить температуру по измененному значению сопротивления, нужно знать значение R0. Удобно пользоваться выражением, приведенным к комнатным значениям температуры и сопротивления. В этом случае выражение (3) примет вид
R = Rk(1 + aT)/(1 + aTk), (5)
откуда
T = [(R(1 + aTk) – Rk)/Rka]. (6)
Таким образом, если известны значения a и Rk для данной структуры, легко определить ее температуру по измеренному значению сопротивления R.
Для рассмотрения данного вопроса толщина слоев Pt варьировалась от 150 до 2000 А, что соответствовало диапазону сопротивлений нагревательных элементов от 420 до 20 Ом.
Из изложенного выше видно, что температурная зависимость сопротивления нагревательного элемента характеризуется величиной температурного коэффициента сопротивления (ТКС).
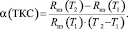 (7)
(7)
Зависимость ТКС от сопротивления нагревательного элемента приведена на рис. 2.
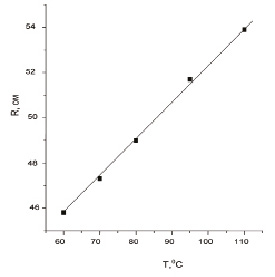
Рис. 1. Температурная зависимость сопротивления слоя платины
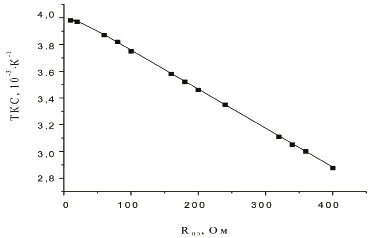
Рис. 2. Зависимость ТКС от сопротивления нагревательного элемента
Из рисунка видно, что с уменьшением сопротивления платинового нагревателя ТКС увеличивается. Большие значения сопротивлений нагревателей, очевидно, соответствуют более тонким слоям платины [4]. При небольших значениях сопротивления ≈ 20 Ом ТКС стремится к величине порядка 4*10-3, К-1, что соответствует массивным образцам Pt.
В процессе исследования изучались концентрационные зависимости изменения температуры, вычисленной по изменению сопротивления для Н2 и СО в потоке воздуха. Полученные зависимости имеют линейный вид. С увеличением концентрации исследуемого газа величина отклика ΔТ линейно возрастает. Измерения проводились при разных рабочих температурах: Т(СО) = 180,8 °С, Т(Н2) = 103 °С. Величина отклика на монооксид углерода гораздо ниже, чем на водород.
В работе изучались также температурные зависимости величины отклика ΔТ для этих же газов в потоке воздуха (10 л/ч). Концентрация СО составляла 0,406 % об, а Н2 – 0,056 %об. При низких температурах зависимости линейны, а при повышении температуры начинается плавное ослабление температурных зависимостей. Наклоны линейных частей графиков различны, они характеризуются разными энергиями активации. Для СО ΔЕА = 237 кДж/моль, для Н2 ΔЕА = 61,9 кДж/моль.
Реакция химического взаимодействия исследуемых газов (Н2 и СО) с атмосферным кислородом протекает на поверхности тонких металлических слоев – катализаторов и является гетерогенной. Известно [5], что кислород из окружающей атмосферы активно адсорбируется на поверхности металлов переходных групп (в том числе на Pt и Pd). При этом доля покрытия поверхности катализатора атомами кислорода очень высокая – 0,7–0,8.
Процесс каталитического окисления в этом случае определяется поступлением на реакционную поверхность только одного вещества, в частности анализируемых газов Н2 или СО. Скорость V гетерогенной химической реакции определяют как количество вещества, реагирующего в единицу времени на единице площади катализатора
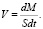 (8)
(8)
С другой стороны, V прямо пропорциональна поверхностной концентрации этого вещества, которая может быть выражена как доля Θ, занятой веществом единицы поверхности катализатора, т.е.
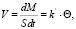 (9),
(9),
где k` – константа скорости процесса. Если k`·S обозначить как k, то
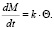 (10)
(10)
Из теории адсорбции Ленгмюра [6] следует, что величина Θ определенным образом связана с константами скоростей адсорбции ka и десорбции kд, а также с давлением газа р, адсорбирующегося на поверхности. Если каждая молекула при адсорбции удерживается одним адсорбционным центром, то
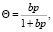 (11)
(11)
где b = ka/kд, р – относительное парциальное давление газа. Если при адсорбции молекула диссоциирует на две частицы, каждая из которых занимает свой адсорбционный центр, то
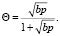 (12)
(12)
В области малых давлений или малых заполнений поверхности адсорбционными частицами, уравнения (11), (12) принимают вид:
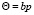 (23`) и
(23`) и 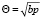 , (13)
, (13)
соответственно для двух отмеченных выше случаев. Подставляя выражения для Θ из уравнений (11) и (12) в уравнение (10), имеем
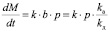 (14)
(14)
для мономолекулярной адсорбции и
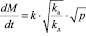 (15),
(15),
для диссоциативной адсорбции.
Скорость выделения тепла dQ/dt в результате экзотермических процессов адсорбции молекул Н2 или СО и их каталитического окисления прямо пропорциональна скорости V, т.е. тепловой поток I0 = dQ/dt приводит к нагреванию термохимического сенсора до некоторой температуры ΔТ, которая определяется уравнением теплового баланса в условиях теплового равновесия.
Отметим, что диапазон давлений (или концентраций) газов Н2 и СО свидетельствует о возможности использования исследуемых сенсоров (с простой линейной зависимостью р – ΔТ) для анализа СО в выхлопных газах бензиновых двигателей внутреннего сгорания и для регистрации довзрывоопасных концентраций водорода на уровне 10 % НКПВ (НКПВ – нижний концентрационный предел воспламенения; для Н2 НКПВ = 0,4 %об).
Выводы
1. Исследованы микроэлектронные термохимические сенсоры с малым энергопотреблением (30*100 мВт), позволяющие регистрировать довзрывоопасные концентрации Н2 в воздухе и определять ПДК СО в выхлопных газах бензиновых двигателей внутреннего сгорания.
2. Показано, что линейный характер концентрационных зависимостей для Н2 и СО связан с мономолекулярной адсорбцией этих газов на активированной поверхности Pd.
3. Предложена модель химических реакций Н2 и СО с кислородом на основе образования промежуточных активированных комплексов. Определены энергии активации этих комплексов (Еа[H2] = 61,9 кДж/моль, Еа[CO] = 237 кДж/моль).

