Первые упоминания о мозаичной анеуплоидии хромосомы Х (X chromosome mosaic aneuploidy) – ХМА относятся к 1960-м гг. в связи с активным изучением генетических причин синдрома Шерешевского – Тернера и дисгенезии гонад [1, 2]. Позднее феномен ХМА неоднократно упоминается в работах по обследованию групп женщин с нарушением репродуктивной функции (бесплодие, повторные спонтанные аборты, преждевременное нарушение функции яичников и др.) [3, 4]. Наличие ХМА у обследованных женщин расценивалось как негативный генетический фактор, влияющий на репродуктивную функцию [5, 6].
Известно, что одна из хромосом Х в женском организме подвержена инактивации, проходит процесс репликации позже и значительно чаще аутосом отстает при расхождении в анафазе, что приводит к неправильному расхождению хромосом. В результате частой постзиготической анеуплоидизации хромосомы Х в соматических клетках возникает мозаицизм низкого уровня с присутствием клеток, содержащих различное количество хромосом Х. Кроме того, анеуплоидные по хромосоме Х клетки более жизнеспособны по сравнению с клетками, имеющими аутосомную анеуплоидию, включая клетки как с моносомией хромосомы Х, так и полисомные клетки с инактивированными дополнительными хромосомами Х [7]. Учитывая вышеизложенное, следует сказать, что мозаичная анеуплоидия хромосомы Х отражает нарушение расхождения хромосом и связана с нестабильностью генома. Мозаицизм по хромосоме Х низкого уровня зафиксирован также в клетках головного мозга больных с различными психическими заболеваниями, у детей с расстройством аутистического спектра, а также у матерей детей с недифференцированной умственной отсталостью и аутизмом [8, 9]. Мозаичная анеуплоидия Х низкого уровня, вероятно, представляет собой динамический процесс анеуплоидизации и может являться свидетельством нестабильности генома. В данной работе исследована группа из 71 женщины с наличием ХМА, превышающем возрастные значения, с целью последовательного цитогенетического и FISH исследований при их отягощенном репродуктивном и генетическом анамнезе.
Материалы и методы исследования
В работе проведены цитогенетические и молекулярно-цитогенетические (fluorescence in situ hybridization – FISH) исследования 71 женщины с отягощенным репродуктивным и генетическим анамнезом. Причины обследования были следующие: бесплодие, спонтанные аборты, мертворождение, наличие детей с задержкой психоречевого развития (ЗПРР), умственной отсталостью, расстройством аутистического спектра (РАС), врожденными пороками (ВПР) и/или микроаномалиями развития (МАР), имеющих в том числе хромосомные перестройки или другую генетическую патологию. Анализировалась группа женщин с мозаичной анеуплоидией хромосомы Х, превышающей допустимый возрастной уровень.
Цитогенетический анализ проводился на хромосомах лимфоцитов периферической крови, культивированных 72 часа. У каждого пациента анализировали 20–30 метафазных пластинок [10]. Для уточнения мозаицизма, выявленного цитогенетическим методом, было проведено молекулярно-цитогенетическое исследование методом FISH на интерфазных ядрах с центромерным ДНК зондом на хромосому Х (DXZ1) в сочетании с контрольным ДНК зондом на прицентромерный участок хромосомы 1 (1q12), использованным для определения контроля плоидности хромосомного набора в ядрах и оценки микроядер с хромосомой X (ХМЯ). Тетраплоидные ядра, встречающиеся при культивировании лимфоцитов, в исследовании не учитывались. У каждой женщины было проанализированно не менее 1000 интерфазных ядер лимфоцитов [11, 12]. При оценке доли анеуплоидных клеток в качестве сравнения использовались ранее опубликованные исследования здоровых женщин, в которых указаны референтные значения ХМА для разных возрастных групп [13, 14].
Результаты исследования и их обсуждение
Информация об отягощенном репродуктивном и генетическом анамнезе, результатах цитогенетических и FISH исследованиях группы женщин представлена в таблице.
Все обследованные женщины были фенотипически нормальными. Средний возраст женщин составлял 34,2 (от 23 до 47 лет). В зависимости от анамнеза обследованных женщин можно было условно разделить на две группы: I – женщины с бесплодием (n = 42) и II – женщины, имеющие детей с наследственными нарушениями (n = 29). В общей группе у 45,1 % женщин были отмечены случаи одного или нескольких спонтанных абортов. В группе с отягощенным репродуктивным анамнезом у 10 женщин (23,8 %) были случаи внематочной беременности, также у 10 женщин (23,8 %) – безрезультатные попытки ЭКО (до 5-ти попыток), преждевременное нарушение функции яичников наблюдалось у 4 женщин. Во второй группе 16 женщин имели детей с ЗПРР, умственной отсталостью, аутизмом, ВПР и/или МАР, причем 6 женщин из них имели двоих и более больных детей. Из этих больных детей (n = 23) было 18 мальчиков на 5 девочек. Среди детей с хромосомными аномалиями наблюдался синдром Дауна у 3 детей, синдром Шерешевского – Тернера – у 2 детей, крупные несбалансированные структурные перестройки хромосом – у 6 детей. Моногенные синдромы были выявлены у 2 детей. В одном случае структурная аномалия хромосомы Х сочеталась с моногенным синдромом (№ 71 в таблице).
При цитогенетическом исследовании, помимо клеток с анеуплоидией по хромосоме Х, у 28,6 % женщин была обнаружена хромосомная нестабильность в виде неспецифичных трисомий аутосом, фрагильности и структурных хромосомных перестроек, в том числе хромосомы Х. Проведенное FISH исследование выявило мозаичную анеуплоидию хромосомы Х со следующей средней частотой: ядра с одним сигналом на хромосому Х наблюдались в 5,3 % (1,5–17,1 %) клеток, с тремя сигналами – в 2,0 % (0,2–5,8 %), с четырьмя сигналами – в 0,3 % (0–1,2 %). В некоторых случаях наблюдались пять и более (до 9) Х сигналов в ядрах (рис. 1).
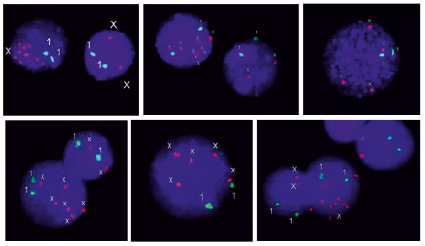
Рис. 1. Анеуплоидия хромосомы Х в интерфазных ядрах, обнаруженная методом FISH. Красным цветом маркирована центромера хромосомы Х, зеленым – хромосома 1 (1q12), использованная в качестве контроля
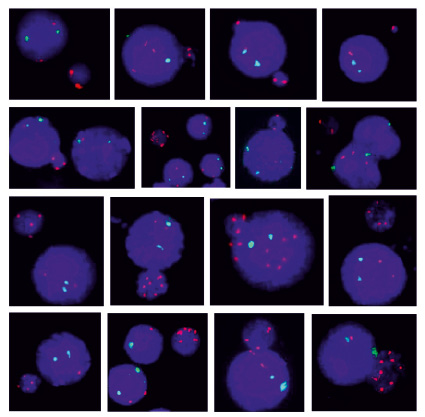
Рис. 2. Микроядра с материалом хромосомы Х (ХМЯ), в которых отсутствуют контрольные сигналы хромосомы 1. Красным цветом маркирована центромера хромосомы Х, зеленым – хромосома 1 (1q12), использованная в качестве контроля. Видно различное число сигналов Х в ХМЯ. Некоторые интерфазные ядра, рядом с которыми расположены ХМЯ, имеют анеуплоидию хромосомы Х
Во всех случаях преобладающим аномальным клоном являлась моносомия хромосомы Х (45,Х), которому всегда сопутствовал следующий по частоте клон с трисомией (47,ХХХ). Интерфазные ядра с четырьмя хромосомами Х встречались с малой частотой у большинства (74,6 %) пациенток. Помимо повышенного уровня анеуплоидии хромосомы Х у 41 женщины (57,7 %) в общей группе были обнаружены микроядра c материалом хромосомы Х. Средняя частота встречаемости ХМЯ на 1000 интерфазных ядер составляла 0,93 % (от 0,4 до 2,1 %). Количество центромерных сигналов Х в таких микроядрах варьировало от 1 до 8, при отсутствии контрольных сигналов на хромосому 1 (рис. 2). Наиболее часто встречались микроядра с двумя Х сигналами. Микроядра c хромосомами Х описаны в литературе, встречаются у женщин в возрасте от 60 лет и состоят из хромосом, отстающих при расхождении в анафазе [15]. Средний возраст женщин, у которых были обнаружены ХМЯ в настоящем исследовании, составлял 35,9 лет.
Известно, что процесс анеуплоидизации хромосомы Х происходит в организме каждой женщины, и доля анеуплоидных клеток увеличивается с возрастом. Devi с соавторами, например, вычислили, что у женщин без нарушения репродуктивной функции образуется около 700 лимфоцитов с кариотипом 45,Х на 106 клеток ежегодно [16]. В результате процесса нерасхождения образуются также клетки с полисомией хромосомы Х, но не в таком количестве, как с моносомией, что показывают FISH исследования, за счет того, что добавочные хромосомы Х в результате отставания в анафазе элиминируются из ядра, вероятно, в виде микроядер [17–19]. Однако, по-видимому, у некоторых женщин процесс анеуплоидизации хромосомы Х в организме происходит более интенсивно.
Представленные нами результаты FISH исследования группы женщин с ХМА выше возрастного уровня показали, что во всех случаях помимо клеточной линии 45,Х присутствуют клеточные линии с полисомией хромосомы Х. Кроме того, наши данные показывают, что почти у 60 % женщин присутствовали микроядра, состоящие из материала хромосом Х. Микроядра с материалом хромосомы Х хорошо охарактеризованы, встречаются у женщин с возрастом после 60 лет и ассоциируются с процессами старения, клеточным апоптозом и хромосомной нестабильностью [20], впрочем, как и микроядра, состоящие из аутосом или их фрагментов. Повышение уровня мозаичной анеуплоидии хромосомы Х также связано с процессом старения организма.
Исходя из полученных результатов данного исследования, основанных на присутствии клеточных линий с полисомией хромосомы Х в сочетании с ХМЯ, мы предполагаем, что феномен мозаичной анеуплоидии хромосомы Х низкого уровня является динамическим процессом анеуплоидизации хромосомы Х, отражающим нестабильность генома. Это подтверждается отягощенным репродуктивным и генетическим анамнезом женщин. Спонтанные аборты, наблюдавшиеся у 45,1 % женщин (которые, как известно, в 60 % этиологически связаны с хромосомными аномалиями), могут иметь связь с нестабильностью генома. Случаи неудачных попыток ЭКО и случаи внематочных беременностей этиологически также могут быть связаны с геномной нестабильностью. ХМЯ встречались не во всех случаях мозаицизма, но общая тенденция была такова, что их встречаемость коррелировала с высоким уровнем полисомных клеток, содержащих 3 и более хромосом Х. Можно предположить, что наличие ХМЯ связано с повышенной интенсивностью процесса анеуплоидизации. Нельзя исключить, что в некоторых случаях с бесплодием при ХМА была представлена констуционным мозаицизмом с большим преобладанием клона 45,Х над клоном 47,ХХХ (по результатам FISH исследования), как, например, в случае 25 таблицы.
Результаты цитогенетического и молекулярно-цитогенетического (FISH) исследований группы женщин с ХМА
|
№ п/п |
возраст |
Отягощенный репродуктивный и генетический анамнез |
СА |
Кариотип |
Цитогенетическое исследование (число клеток с различным количеством хромосом Х) |
FISH ( % клеток с различным количеством хромосом Х |
||||||||
|
Х |
3 Х |
4–7 Х |
2 Х |
ХН* |
Х |
3 Х |
4 Х |
5–9 Х |
ХМЯ |
|||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
1 |
27 |
б/пл*, мертворождение (плод с МВПР) |
1 |
47,XXX[3]/ 45,X[2]/ 46,XX[25] |
2 |
3 |
25 |
+ |
7,5 |
5,3 |
0,5 |
+ |
||
|
2 |
32 |
б/пл |
2 |
45,X[1]/ 47,XXX[1]/ 46,XX[28] |
1 |
1 |
28 |
+ |
2,3 |
2,5 |
0,2 |
– |
||
|
3 |
31 |
б/пл, ВмБ* |
– |
45,X[2]/ 49,XXХXX[1]/ 46,XX[27] |
2 |
1 |
27 |
– |
11,6 |
1,2 |
1,1 |
+ |
||
|
4 |
27 |
б/пл |
– |
45,X[3]/ 46,XX[27] |
3 |
27 |
– |
3,1 |
0,5 |
– |
||||
|
5 |
33 |
б/пл, ВмБ |
1 |
45,X[2]/ 46,XX[28] |
2 |
28 |
– |
6,2 |
5,1 |
1,0 |
0,5 |
+ |
||
|
6 |
27 |
б/пл, |
– |
45,X[2]/ 46,XX[28] |
2 |
28 |
– |
4,3 |
0,6 |
– |
||||
|
7 |
25 |
б/пл |
1 |
45,X[1]/ 47,XXX[1]/ 48,XXXX[1]/ 46,XX[27] |
1 |
1 |
1 |
27 |
+ |
2,9 |
2,3 |
0,7 |
– |
|
|
8 |
37 |
б/пл |
2 |
47,XXX[2]/ 46,XX[28] |
2 |
28 |
– |
3,8 |
2,1 |
0,3 |
+ |
|||
|
9 |
33 |
б/пл |
1 |
45,X[1]/ 46,XX[39] |
1 |
39 |
– |
2,7 |
1,1 |
0,3 |
+ |
|||
|
10 |
34 |
б/пл |
– |
47,XXX[2]/ 45,X[1]/ 46,XX[37] |
1 |
2 |
37 |
+ |
5,1 |
1,4 |
+ |
|||
|
11 |
33 |
б/пл |
– |
45,X[1]/ 47,XXX[1]/ 46,XX[28] |
1 |
1 |
28 |
+˅ |
4,5 |
0,8 |
+ |
|||
|
12 |
37 |
б/пл, ВмБ |
4 |
45,X[1]/ 47,XXX[1]/ 51,XXXXXXX[1]/ 46,XX[27] |
1 |
1 |
1 |
27 |
– |
12,3 |
2,5 |
0,5 |
0,2 |
+ |
|
13 |
29 |
б/пл |
3 |
47,XXX[2]/ 46,XX[28] |
2 |
28 |
– |
4,3 |
1,8 |
0,4 |
0,3 |
+ |
||
|
14 |
35 |
б/пл, ПНФЯ* |
3 |
45,X[1]/ 47,XXX[1]/ 46,XX[28] |
1 |
1 |
28 |
+˅ |
4,6 |
1,1 |
0,2 |
– |
||
|
15 |
32 |
б/пл |
1 |
45,X[1]/ 47,XXX[1]/ 46,XX[28] |
1 |
1 |
28 |
– |
3,6 |
2,6 |
0,7 |
+ |
||
|
16 |
40 |
б/пл |
4 |
47,XXX[3]/ 45,X[1]/ 46,XX[27] |
1 |
3 |
27 |
+ |
7,3 |
5,8 |
1,1 |
0,2 |
+ |
|
|
17 |
44 |
б/пл |
– |
45,X[2]/ 47,XXX[2]/ 49,ХXXXX[1]/ 46,XX[25] |
2 |
2 |
1 |
25 |
+ |
17,1 |
4,5 |
2,7 |
0,5 |
+ |
|
18 |
37 |
б/пл |
3 |
45,X[1]/ 47,XXX[1]/ 46,XX[28] |
1 |
1 |
28 |
– |
3,4 |
2,7 |
0,2 |
– |
||
|
19 |
25 |
б/пл |
1 |
45,X[2]/ 46,XX[28] |
2 |
28 |
– |
2,4 |
1,5 |
0.4 |
– |
|||
|
20 |
46 |
б/пл |
3 |
45,X[3]/ 47,XXX[2]/ 46,XX[25] |
3 |
2 |
25 |
– |
10,3 |
5,7 |
0,7 |
0,2 |
+ |
|
|
21 |
38 |
б/пл, ВмБ |
– |
45,X[1]/ 47,XXX[1]/ 46,XX[19] |
1 |
1 |
19 |
– |
6,3 |
1,2 |
0,4 |
0,3 |
+ |
|
|
22 |
38 |
б/пл |
2 |
45,X[2]/ 47,XXX[1]/ 46,XX[17] |
2 |
1 |
17 |
+ |
5,7 |
2,6 |
+ |
|||
|
23 |
32 |
б/пл, ВмБ |
1 |
45,X[2]/ 47,XXX[1]/ 48,XXXX[1]/46,XX[16] |
2 |
1 |
1 |
16 |
– |
4,4 |
2,3 |
0,2 |
+ |
|
|
24 |
33 |
б/пл, ВмБ |
2 |
45,X[1]/ 47,XXX[1]/ 46,XX[28] |
1 |
1 |
28 |
– |
4,5 |
3,2 |
0,2 |
– |
||
|
25 |
45 |
б/пл, ПНФЯ |
– |
45,X[4]/ 46,XX[26] |
4 |
26 |
– |
9,3 |
0,2 |
– |
||||
|
26 |
31 |
б/пл |
1 |
45,X[2]/ 46,XX[18] |
2 |
18 |
– |
3,2 |
0,5 |
0,2 |
– |
|||
|
Продолжение таблицы |
||||||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
27 |
40 |
б/пл |
– |
47,XXX[4]/ 46,XX[26] |
4 |
26 |
– |
8,2 |
2,8 |
0,7 |
+ |
|||
|
28 |
38 |
б/пл, ВмБ |
– |
45,X[4]/ 46,XX[26] |
4 |
26 |
– |
6,3 |
2,4 |
0,2 |
+ |
|||
|
29 |
35 |
б/пл, ВмБ |
2 |
47,XXX[1]/ 46,XX[29] |
1 |
29 |
– |
4,5 |
2,8 |
0,2 |
– |
|||
|
30 |
27 |
б/пл |
– |
45,X[1]/ 47,XXX[1]/ 46,XX[28] |
1 |
1 |
28 |
– |
2,7 |
0,8 |
0,2 |
0,1 |
– |
|
|
31 |
41 |
б/пл, ВмБ |
– |
45,X[3]/ 47,XXX[1]/ 46,XX[26] |
3 |
1 |
26 |
– |
7,9 |
2,5 |
0,3 |
0,2 |
+ |
|
|
32 |
45 |
б/пл |
3 |
45,X[3]/ 46,XX[27] |
3 |
27 |
– |
3,5 |
0,8 |
0,1 |
0,1 |
– |
||
|
33 |
27 |
б/пл |
– |
45,X[4]/ 46,XX[26] |
4 |
26 |
+ |
4,1 |
1,3 |
0.7 |
0,1 |
+ |
||
|
34 |
31 |
б/пл |
2 |
45,X[3]/ 46,XX[27] |
3 |
27 |
+ |
3,6 |
0,7 |
– |
||||
|
35 |
38 |
б/пл, два случая ВмБ |
2 |
45,X[1]/ 47,XXX[1]/ 46,XX[28] |
1 |
1 |
28 |
+ |
7,3 |
2,9 |
0,7 |
+ |
||
|
36 |
46 |
б/пл, ПНФЯ |
– |
45,X[4]/ 49,XXXXХ[1]/ 46,XX[25] |
4 |
1 |
25 |
– |
15,2 |
2,6 |
0,4 |
0,1 |
+ |
|
|
37 |
31 |
б/пл |
– |
47,XXX[2]/ 46,XX[28] |
2 |
28 |
– |
1,5 |
1,7 |
0,2 |
0,2 |
– |
||
|
38 |
31 |
б/пл |
– |
45,X[4]/ 48,XXXX[1]/ 46,XX[25] |
4 |
1 |
25 |
– |
7,2 |
2,5 |
0,2 |
+ |
||
|
39 |
38 |
б/пл, ПНФЯ |
1 |
45,X[3]/ 47,XXX[1]/ 48,XXXX[1]/46,XX[25] |
3 |
1 |
1 |
25 |
– |
10,3 |
3,7 |
0,5 |
0,1 |
+ |
|
40 |
39 |
б/пл |
1 |
47,XXX[2]/ 45,X[1]/ 46,XX[27] |
1 |
2 |
27 |
– |
9,1 |
1,6 |
0,5 |
0,4 |
+ |
|
|
41 |
35 |
б/пл |
1 |
45,X[2]/ 48,XXXX[1]/ 46,XX[27] |
2 |
1 |
27 |
– |
5,3 |
0,8 |
0,3 |
– |
||
|
42 |
37 |
б/пл, дисфункция яичников |
– |
45,X[2]/ 46,XX[28] |
2 |
28 |
+˅ |
6,3 |
0,5 |
– |
||||
|
43 |
32 |
Два сына с ЗПРР и РАС |
– |
45,X[1]/ 46,XX[27] |
1 |
27 |
– |
2,8 |
1,1 |
– |
||||
|
44 |
34 |
Дочь с синдромом Дауна |
– |
45,X[1]/ 47,XXX[1]/ 46,XX[28] |
1 |
1 |
28 |
– |
4,3 |
1,7 |
0,1 |
+ |
||
|
45 |
38 |
Дочь с mos del (8)(p23.1) |
– |
45,X[3]/ 47,XXX[1]/ 46,XX[26] |
3 |
1 |
26 |
– |
6,6 |
3,8 |
0,4 |
0,2 |
+ |
|
|
46 |
34 |
Сын с ахондроплазией |
– |
47,XXX[2]/ 45,X[1]/ 46,XX[27] |
1 |
2 |
27 |
– |
2,7 |
2,9 |
– |
|||
|
47 |
43 |
Два сына с МВПР |
2 |
45,X[2]/ 47,XXX[2]/ 46,XX[26] |
2 |
2 |
26 |
+ |
3,9 |
2,5 |
0,3 |
+ |
||
|
48 |
36 |
Сын с синдромом Дауна |
– |
48,XXXX[1]/ 46,XX[29] |
1 |
29 |
– |
3,2 |
1,3 |
– |
||||
|
49 |
27 |
Сын с del(1)(p36) |
– |
45,X[1]/ 47,XXX[1]/ 46,XX[28] |
1 |
1 |
28 |
– |
3,7 |
1,7 |
0,1 |
– |
||
|
50 |
27 |
Два сына с ЗПРР |
– |
45,X[2]/ 48,XXXX[1]/ 46,XX[27] |
2 |
1 |
27 |
– |
4,3 |
1,4 |
0,4 |
– |
||
|
51 |
37 |
Сын с синдромом Дауна (транслокационная форма) |
– |
47,XXX[1]/ 46,XX[29] |
1 |
29 |
– |
5,1 |
0,8 |
1,2 |
+ |
|||
|
52 |
47 |
Сын с РАС |
1 |
45,X[3]/ 46,XX[27] |
3 |
27 |
– |
7,7 |
2,7 |
0,7 |
0,1 |
+ |
||
|
53 |
32 |
Дочь с РАС, ЗПРР |
– |
45,X[1]/ 46,XX[29] |
1 |
29 |
+ |
3,4 |
1,7 |
– |
||||
|
54 |
31 |
Сын с РАС |
– |
45,X[1]/ 47,XXX[1]/ 46,XX[18] |
1 |
1 |
18 |
– |
2,7 |
1,5 |
– |
|||
|
55 |
35 |
Сын с РАС |
– |
47,XXX[2]/ 46,XX[28] |
2 |
28 |
– |
3,8 |
1,3 |
0,2 |
+ |
|||
|
Окончание таблицы |
||||||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
56 |
35 |
Дочь с РАС, ЗПРР |
– |
47,XXX[3]/ 46,XX[45] |
3 |
45 |
+ |
2,6 |
1,5 |
– |
||||
|
57 |
42 |
Сын с РАС |
2 |
47,XXX[3]/ 45,X[2]/ 46,XX[15] |
2 |
3 |
15 |
– |
8,3 |
3,3 |
0,7 |
+ |
||
|
58 |
36 |
Дочь с синдромом Шерешевского – Тернера |
– |
45,X[1]/ 47,XXX[1]/ 46,XX[28] |
1 |
1 |
28 |
+ |
2,9 |
0,9 |
0,4 |
+ |
||
|
59 |
23 |
Дочь с синдромом Шерешевского – Тернера |
– |
45,X[2]/ 46,XX[28] |
2 |
28 |
– |
3,2 |
0,4 |
0,5 |
– |
|||
|
60 |
27 |
Сын с ЗПРР, МАР |
– |
45,X[2]/ 46,XX[28] |
2 |
28 |
– |
4,8 |
1,9 |
0,9 |
+ |
|||
|
61 |
29 |
Сын с ЗПРР |
– |
45,X[2]/ 47,XXX[1]/ 46,XX[27] |
2 |
1 |
27 |
– |
3,4 |
1,4 |
0,3 |
+ |
||
|
62 |
31 |
Сын и дочь с умств.отст-ю, ВПР |
– |
45,X[2]/ 46,XX[28] |
2 |
28 |
– |
4,1 |
0,7 |
– |
||||
|
63 |
34 |
3 ребенка (2 мальчика |
3 |
45,X[3]/ 47,XXX[2]/ 46,XX[45] |
3 |
2 |
45 |
– |
3,1 |
2,3 |
0,6 |
+ |
||
|
64 |
34 |
Сын с ЗПРР |
9 |
45,X[3]/ 46,XX[28] |
3 |
28 |
+ |
4,7 |
3,1 |
0,5 |
0,1 |
+ |
||
|
65 |
32 |
Дочь с ЗПРР и dup(5)(q13.2) |
– |
45,X[2]/ 46,XX[20] |
2 |
20 |
– |
5,1 |
2,3 |
0,3 |
+ |
|||
|
66 |
37 |
Сын с ЗПРР, РАС, ХН и del(15)(q13.1 q13.3) |
– |
45,X[1]/ 48,XXXX[1]/ 46,XX[28] |
1 |
1 |
28 |
– |
2,9 |
1,2 |
0,4 |
– |
||
|
67 |
32 |
Дочь с ЗПРР, ВПР и dup7р21.1р14.1 |
– |
45,X[1]/ 47,XXX[1]/ 46,XX[28] |
1 |
1 |
28 |
+ |
3,5 |
1,3 |
– |
|||
|
68 |
36 |
Дочь и сын с грубой ЗПРР и синдромом Лоу соответственно |
3 |
45,X[1]/ 48,XXXX[1]/ 46,XX[28] |
1 |
1 |
28 |
– |
6,5 |
1,2 |
0,3 |
+ |
||
|
69 |
31 |
Носитель мутации в гене MECP2, переданной ребенку |
1 |
45,X[2]/ 46,XX[28] |
2 |
28 |
– |
2,2 |
1,0 |
+ |
||||
|
70 |
28 |
Сын с ЗПМР, эпилепсией |
– |
45,X[1]/ 47,XXX[1]/ 46,XX[38] |
1 |
1 |
38 |
+ |
4,7 |
1,8 |
0,3 |
+ |
||
|
71 |
28 |
Дочь с delXq22.1 в сочетании с мукополисахаридозом VI типа |
– |
45,X[3]/ 46,XX[17] |
3 |
17 |
– |
5,2 |
1,3 |
– |
||||
Примечание. *б/пл – бесплодие, ВмБ – внематочная беременность, ПНФЯ – преждевременное нарушение функции яичников, ХН – хромосомная нестабильность; ˅ – хромосомная нестабильность, выявленная в кариотипе, включая структурные перестройки хромосомы Х.
Предположение о том, что ХМА низкого уровня может быть свидетельством геномной нестабильности, неоднократно высказывалось в научных публикациях [21, 22]. Последние исследования показывают, что при некоторых психических заболеваниях наблюдается геномная нестабильность в клетках центральной нервной системы, характеризующаяся хромосомным мозаицизмом и множественными аномалиями генома. Так, повышенная мозаичная анеуплоидия зафиксирована в клетках мозга при таких заболеваниях, как болезнь Альцгеймера, синдром Луи – Барр и шизофрения [23, 24]. Обследования детей с аутизмом выявляют относительно высокий уровень ХМА по сравнению с контрольными образцами, как в лимфоцитах крови, так и в нейронах головного мозга [9, 25]. Вероятно, часть женщин с ХМА является носителями определенных мутаций, которые, в свою очередь, могут оказывать влияние на расхождение хромосом Х в соматических клетках. В частности, установлено, что у женщин с премутацией в гене FMR1, связанной с синдромом FRAXA, наблюдается преждевременное нарушение функции яичников и может отмечаться мозаичная анеуплоидия хромосомы Х [26]. Существует мнение, что наличие ХМА низкого уровня может отражать процесс преждевременного старения [21, 27].
Таким образом, на основании результатов настоящего исследования и данных литературы можно подтвердить вывод о том, что мозаичная анеуплоидия хромосомы Х низкого уровня является свидетельством нестабильности генома.
Заключение
Проблема геномной нестабильности в последнее время приобретает большую актуальность, поскольку связана с онкологическими, психическими заболеваниями, увеличением частоты рождения детей с пороками и задержкой развития, с бесплодием. Современные генетические методы диагностики все чаще выявляют случаи множественного повреждения генома у детей с ЗПРР, РАС и ВПР, случаи сочетания двух и более генетических синдромов у одного ребенка. Участились случаи рождения в одной семье нескольких больных детей с различной генетической патологией. Возможно это связано с нестабильностью генома у родителей, выявить которую весьма сложно. Наиболее распространенный цитогенетический метод для определения хромосомной нестабильности (определение нестабильности генома) постепенно заменяется методами молекулярными, позволяющими обнаружить мутации в генах-регуляторах клеточного цикла и генах, участвующих в процессе репарации ДНК. Однако надо отметить, что методы определения нестабильности на клеточном уровне не утратили своей актуальности. Когда на обследование поступает больной ребенок с генетической патологией, мы оказываемся перед свершившимся фактом его заболевания, причины которого, возможно, следует искать, исследуя геном родителей и, в частности, его нестабильность. Проведение таких исследований необходимо также женщинам, подвергающимся безрезультатным попыткам ЭКО и имеющим в анамнезе случаи внематочной беременности, что, как правило, не делается в центрах репродукции. Назначение FISH исследования для определения степени ХМА было бы целесообразно для женщин с проблемами репродукции и имеющими больных детей с целью прогноза будущего потомства, выбора метода проведения пренатальной диагностики при последующей беременности, а также для разработки таргетной терапии, направленной на стабилизацию генома. Несомненно, женщины с ХМА требуют более детального обследования современными молекулярными методами для выявления возможных причин геномной нестабильности.

