Современная регенеративная медицина, тканевая инженерия и трансплантология для восстановления утраченных структуры и функций органов и тканей предполагает использование тканеинженерных препаратов, включающих в себя матрицу, заселенную клетками, а также использование матриц из биологически активных материалов без предварительного заселения их клетками. В качестве основы для получения матриц используются биосовместимые, биорезорбируемые полимеры, такие как хитозан, коллаген, альгинат, полилактид, полигликолид, полигидроксиалканоаты. Матрица может иметь блочную пористую структуру, быть в виде пористой или непористой пленки, а также в виде трубки или волокна [1, 2]. Разнообразие материалов и получаемых на их основе матричных структур ставит вопрос о степени биосовместимости, скорости и механизме биорезорбции, функциональности интегрируемых в организм биоинженерных препаратов [3].
Одной из наиболее значимых медицинских, гинекологических патологий репродуктивного возраста является невозможность родоразрешения через естественные родовые пути, что является причиной нефизиологического родоразрешения путем кесарева сечения матки [4, 5]. Ушивание дефекта матки приводит к грубым нарушениям анатомии и кровоснабжения стенки матки и заживлению посредством рубцовой ткани, повышающей риск осложнений при последующей беременности и родах [6–8]. В связи с этим перспективной является разработка материалов и методов, обеспечивающих полноценное структурное и функциональное восстановление стенки матки за счет репаративной регенерации.
В рамках данной патологии одним из наиболее перспективных способов получения матриц для последующего создания тканеинженерных препаратов является метод лиофилизации замороженных водных растворов биосовместимых биорезорбируемых полимеров, в частности хитозана, альгината и коллагена [9]. В результате получаются пористые 3D структуры с системой открытых пор, которые способствуют достаточно интенсивному обмену питательными веществами и газами, а также миграции клеток во всем объеме матрицы. Кроме того, такая структура придает материалу эластичность во влажном состоянии, что облегчает плотное прилегание матрицы к поврежденной поверхности органа, способствуя более эффективному протеканию регенеративных процессов.
Хитозан является полисахаридом, производным хитина, получаемого из панцирей ракообразных. Он обладает способностью к биорезорбции [10], антибактериальной, антивирусной и фунгицидной активностью [11–13]. В организме хитозан расщепляется до N-ацетил-β-D-глюкозамина и β-D-глюкозамина [14, 15], которые в свою очередь являются компонентами межклеточного матрикса, синовиальной жидкости и хрящевой ткани, входя в состав гликозаминогликана – гиалуроновой кислоты.
Альгинат также является полисахаридом, получаемым в виде альгиновой кислоты из красных и бурых водорослей, с последующим переводом в водорастворимую солевую форму, как правило в альгинат натрия или альгинат кальция [16]. Он обладает иммуномодулирующими и гемостатическими свойствами. При пероральном приеме поддерживает естественную микрофлору кишечника, проявляет бактерицидные и гиполипидемические свойства, является хорошим сорбентом, применяется также для микрокапсулирования лекарственных веществ [17]. Однако механизм и скорость биорезорбции альгинатов in vivo, а также реакция на них окружающих тканей изучены недостаточно.
Коллаген – это фибриллярный белок, составляющий основу соединительной ткани организма человека и животных, входит в состав сухожилий, связок, хрящей, костей, дермы, а также других органов и тканей. В организме коллаген обладает структурообразующими и каркасными свойствами, обеспечивает прочность и эластичность соединительной ткани. Коллаген широко применяется в медицине в качестве гемостатических губок и раневых покрытий, в тканевой инженерии из него получают матрицы для культивирования различных культур клеток [18]. Разрушение коллагена в организме происходит в короткие сроки под действием ферментов коллагеназ, которые расщепляют пептидные связи в определенных участках молекул коллагена [19, 20].
Целью работы являлась разработка пористых биорезорбируемых трехмерных матриц на основе хитозана, альгината и коллагена, исследование их взаимодействия с миометрием матки кролика для оценки перспективности дальнейшего использования в составе тканеинженерных препаратов в регенеративной медицине и тканевой инженерии для восстановления функции стенки матки после кесарева сечения.
Материалы и методы исследования
Для получения пористых матриц использовался хитозан производства фирмы Sigma-Aldrich Corporation (США) артикул 448877, альгинат натрия артикул 180947 Sigma-Aldrich Corporation (США), коллаген из кожи телят артикул C8919 Sigma-Aldrich Corporation (США).
Хитозан и коллаген растворяли в 2 %-ном водном растворе уксусной кислоты, альгинат растворяли в дистиллированной воде, при постоянном перемешивании 120 минут. Концентрация полимеров в растворах составляла 3 мас %. Далее растворы замораживались при Т = – 20 °С, лиофилизировались при Т = – 2 °С и давлении 1,6 Пa на установке Freeze Dry System 7400030 (США). Из полученных заготовок вырезались образцы толщиной 1,2 мм, длиной 40 мм и шириной 20 мм, с размерами пор от 10 до 300 мкм. Хитозановые матрицы обрабатывались 5 мас % раствором NaOH, с целью перевода хитозана из водорастворимой солевой формы в нерастворимую в воде основную форму. Матрицы из альгината переводились в нерастворимую в воде форму обработкой 5 мас % раствором CaCl2. Коллагеновые матрицы переводились в нерастворимую в воде форму путем выдерживания в парах 4 мас % раствора формальдегида в течение 1 часа при 25 °С.
Эксперимент in vivo был выполнен на 36 беременных самках кроликов породы «Советская шиншилла», в соответствии с правилами проведения работ с использованием экспериментальных животных, принципами Европейской конвенции (г. Страсбург, 1986 г.) и Хельсинкской декларации Всемирной медицинской ассоциации о гуманном обращении с животными 1996 г. Вес подопытных животных составлял 4–4,5 кг, возраст – 6 месяцев. Для изучения in vivo матрицы стерилизовали в 70 мас. % этиловом спирте в течение 24 часов, отмывали в избыточном количестве стерильного физиологического раствора. Животных оперировали под внутривенной анестезией (премедикация – атропин 0,1 %, рометар 2 %, дропередол 0,25 % по 0,1 мл на 1 кг массы животного внутримышечно, наркоз – рометар 2 %, дропередол 0,25 %, кетамин 5 % внутривенно до исчезновения роговичного рефлекса). На 3 неделе беременности, после родоразрешения путем кесарева сечения, стенка матки ушивалась, матрицы помещались на поверхность ушитой раны в один из 2 рогов матки, при этом контролировалась плотность прилегания матриц к стенке матки, края матриц фиксировались одиночными швами. На втором роге операция также проводилась и служила контролем, затем послойно ушивалась передняя брюшная стенка. После наложения наружного шва кролики содержались в индивидуальных клетках. Животные получали свободный доступ к воде и стандартную диету. После операции все животные были активны, негативного влияния имплантации материалов на животных не выявлено.
Электронно-микроскопические исследования образцов проводили на сканирующем электронном микроскопе Supra 55VP (Carl Zeiss, Германия) в режиме регистрации вторичных электронов, с предварительным нанесением тонкого слоя платины.
Для морфологического исследования через 1, 2, 4 недели фрагменты стенки матки с предлежащими к ним матрицами фиксировали в 10 % нейтральном формалине на фосфатном буфере (рН 7.4) не менее 24 часов. Используя стандартную гистологическую методику со спиртами возрастающей концентрации, материал заливали в парафиновые блоки. Срезы толщиной 5 мкм готовили с помощью микротома Accu-Cut SRT 200 (Sakura, Япония) и окрашивали гематоксилином Майера и эозином (Bio-Optica, Италия). Препараты изучали в поле светового микроскопа DM-750 (Leica, Германия) с использованием окуляра 10, объективов 4, 10, 40, 100×. Запись цифровых изображений выполняли с помощью фотокамеры ICC50 (Leica, Германия).
Результаты исследования и их обсуждение
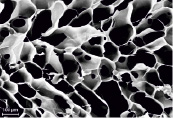
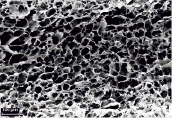
На рис. 1 приведены микрофотографии поверхности поперечного сечения пористой хитозановой матрицы (ПХМ), пористой альгинатной матрицы (ПАМ) и пористой коллагеновой матрицы (ПКМ). Видно, что матрицы имеют пористую структуру с открытой системой пор, которые соединены друг с другом и внешней средой. Такая структура позволяет питательным веществам, продуктам жизнедеятельности, растворенным газам свободно циркулировать в объеме матрицы, а размер пор и незначительная извитость каналов, соединяющих между собой поры, способствуют свободной миграции клеток. Ранее уже была показана перспективность применения подобных 3D-материалов для тканевой инженерии и клеточной трансплантологии [10, 19].
Размер пор в ПХМ и ПАМ достигает 300 мкм (рис. 1, б, г), в ПКМ несколько меньше, до 100 мкм (рис. 1, е). В сухом состоянии ПХМ и ПАМ обладают меньшей эластичностью, чем ПКМ, однако во влажном состоянии все матрицы эластичны, плотно прилегают к поверхности наложения, повторяя ее рельеф (рис. 2).


а) б)

в) г)

д) е)
Рис. 1. Микрофотографии ПХМ (а, б), ПАМ (в, г) и ПКМ (д, е)


а) б)
Рис. 2. Фотографии ПКМ в сухом (а) и влажном состоянии (б)
Исследование ПХМ.
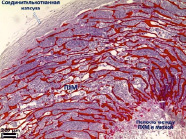
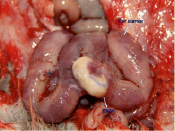
Выявлено наличие умеренно выраженного спаечного процесса у 8 животных из 12, спайки в основном образованы между рогом матки с матрицей и соседним рогом или с петлями кишки (рис. 3, а, б). Также выявлено нарушение плотности прилегания ПХМ к стенке матки с образованием полости, заполненной жидкостью.
а) б)
в) г)
д) е)
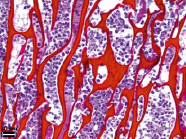
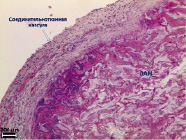
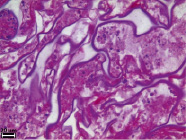
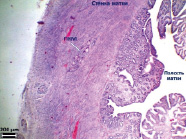
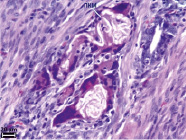
Рис. 4. Гистологическое исследование ПХМ (а, б), ПАМ (в, г) и ПКМ (д, е) через 4 недели после имплантации, (а, в, д) – увеличение об. x4, (б, г, е) – увеличение об. x40
Гистологическое исследование ПХМ через одну неделю экспозиции после имплантации показало, что вокруг матрицы формируется капсула с признаками умеренно выраженного асептического воспаления, с очагами лейкоцитарной инфильтрации с преобладанием сегментоядерных клеток. Матрица окружена расширенными полнокровными сосудами, выявляются геморрагические очаги. Вокруг ПХМ не выявляются гигантские многоядерные клетки инородных тел (ГМКИТ). Во всех порах ПХМ обнаруживается только фибрин, клеточный детрит и лейкоцитарная инфильтрация с преобладанием сегментоядерных клеток.
Через 2 недели после имплантации в капсуле вокруг ПХМ сохраняется умеренно выраженное асептическое воспаление. Клеточный состав капсулы представлен фибробластами, макрофагами, встречаются нейтрофилы и эозинофилы, ГМКИТ не выявляются. В капсуле определяются многочисленные расширенные и полнокровные сосуды. Все поры ПХМ остаются заполненными лейкоцитами, клеточным детритом и фибрином.
Через 4 недели эксперимента вокруг ПХМ (рис. 4, а, б) в сформированной соединительнотканной капсуле сохраняются признаки умеренно выраженного продуктивного воспаления. В капсуле определяется активный ангиогенез, сосуды расширены, полнокровны, с признаками стаза, местами наблюдаются единичные геморрагические очаги. Непосредственно вокруг матрицы определяется лейкоцитарная инфильтрация с преобладанием эозинофилов и макрофагов. По периферии на структурах собственно матрицы выявляются единичные ГМКИТ. Как периферические, так и центральные поры матрицы заполнены фибрином, лейкоцитами и клеточным детритом. Признаков биорезорбции матрицы не выявлено.
а) б)
в) г)
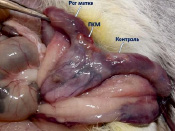
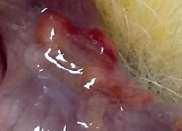
д) е)
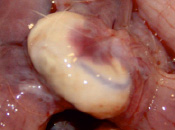
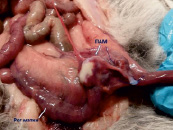
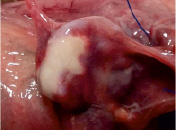
Рис. 3. Вид матки кролика через 4 недели после имплантации ПХМ (а, б), ПАМ (в, г) и ПКМ (д, е)
Исследование ПАМ.
Выявлено наличие более выраженного спаечного процесса по сравнению с экспериментами с ПХМ матрицей. У 11 животных из 12 спайки в основном образованы между рогом матки с матрицей и соседним рогом или с петлями кишки (рис. 3, в, г). Также выявлено нарушение плотности прилегания ПАМ к стенке матки с образованием полости, заполненной жидкостью.
Гистологическое исследование ПАМ через одну неделю после имплантации выявило вокруг матрицы капсулу с выраженным асептическим воспалением с очагами лейкоцитарной инфильтрации. В соединительнотканной капсуле определяются многочисленные полнокровные и расширенные сосуды. Все ячейки матрицы заполнены лейкоцитами, фибрином и клеточным детритом.
Через 2 недели в капсуле вокруг ПАМ сохраняется воспалительный процесс. Клеточный состав капсулы представлен фибробластами, макрофагами, сегментоядерными лейкоцитами и единичными МГКИТ. Многочисленные сосуды с признаками стаза, полнокровны. И периферические, и центральные поры заполнены клеточным детритом, фибрином и эозинофилами.
Через 4 недели экспозиции после имплантации вокруг ПАМ визуально капсула более выражена по сравнению с капсулой вокруг ПХМ на данном сроке эксперимента. В капсуле сохраняются признаки выраженного продуктивного воспаления (рис. 4, в, г), в ней происходит активный ангиогенез. Сосуды резко расширены, полнокровны, местами наблюдаются единичные геморрагические очаги. Внутренний слой капсулы, прилежащий непосредственно к структурам матрицы, инфильтрирован лейкоцитами с преобладанием эозинофилов. На периферических структурах матрицы выявляются ГМКИТ. Периферические поры заполнены эозинофилами, в центральных порах выявляется фибрин, лейкоциты и клеточный детрит. Признаков биорезорбции матрицы не выявлено.
Исследование ПКМ.
Наличия спаечного процесса выявлено не было (рис. 3, д, е). Гистологическое исследование через одну неделю после имплантации показало незначительное асептическое воспаление вокруг ПКМ. Матрица окружена тонкой соединительнотканной капсулой с небольшим количеством тонких коллагеновых волокон, в которой преобладают макрофаги, встречаются единичные ГМКИТ и единичные фибробласты. В периферических и в центральных ячейках матрицы находится фибрин, клеточный детрит, небольшое количество сегментоядерных лейкоцитов и макрофаги.
При гистологическом исследовании ПКМ через 2 недели экспозиции после имплантации площадь, занимаемая матрицей, визуально значительно меньше по сравнению с площадью матрицы через одну неделю после имплантации. Матрица имеет неправильную форму, и вокруг неё выявляется тонкая капсула с фибробластами, макрофагами и ГМКИТ. Ячейки матрицы спавшиеся, очевидно, вследствие сокращения гладких миоцитов и низких каркасных свойств частично резорбированной матрицы. Во всех ячейках ПКМ определяются макрофаги и ГМКИТ. Признаков воспалительной реакции вокруг ПКМ не выявлено.
Исследования через 4 недели показали, что в миометрии выявляются единичные небольшие фрагменты ПКМ (рис. 4, д, е). Вокруг остатков матрицы располагаются ГМКИТ и макрофаги. Признаков воспалительной реакции вокруг ПКМ не выявлено. Лимфоциты и сегментоядерные лейкоциты в миометрии не определяются, гладкие миоциты без признаков дистрофических повреждений, гистологическая картина эндометрия соответствует таковой у контрольных животных.
Заключение
Ранее [10] в нашей работе мы показали, что ПХМ, имплантированная в большую приводящую мышцу бедра крысы, уже со 2-й недели эксперимента начинает заселяться фибробластами, макрофагами и ГМКИТ, и на 6-ю неделю все поры матрицы заполнены соединительной тканью с сосудами, а относительный объём собственно матрицы начинает уменьшаться. При имплантации ПХМ в стенку матки подобных результатов не получено. На 4 неделе эксперимента поры матрицы оставались заполненными клеточным детритом, элементов соединительной ткани в них не выявлялось. Мы предполагаем, это связано с сокращением стенки матки после кесарева сечения, в результате которого матрица деформировалась, первоначально плотный контакт матрицы и стенки был нарушен, что в свою очередь привело к нарушению кровоснабжения и невозможности полноценной миграции клеток в объем матрицы, выраженный воспалительный процесс также препятствовал этому. Аналогично протекали процессы в ПАМ с еще более выраженной воспалительной реакцией и, следовательно, с более выраженной соединительнотканной капсулой.
Интересным оказалось то, что клеточные реакции миометрия на имплантацию ПКМ были схожи с таковыми при имплантации ПКМ в печень и в большую приводящую мышцу бедра крысы, как это было показано нами ранее [19]. Практически полная биорезорбция ПКМ достигалась за 4 недели без выраженной воспалительной реакции и образования соединительнотканной капсулы.
Таким образом, показано, что материалы на основе хитозана и особенно альгината необходимо с осторожностью применять в брюшной полости и полости малого таза в связи с крайне вероятным развитием выраженной воспалительной реакции и спаечного процесса. ПКМ, напротив, показала свою перспективность для дальнейшего применения в качестве матрицы для получения тканеинженерных препаратов короткого срока действия в регенеративной медицине и тканевой инженерии при восстановлении функции стенки матки после кесарева сечения.
Авторы благодарят руководителя лаборатории физиологии и патофизиологии плода НИИ акушерства и гинекологии им. Д.О. Отта РАМН Н.Г. Павлову и сотрудников лаборатории за помощь в проведении экспериментов.
Работа выполнена при поддержке гранта Российского научного фонда, проект № 14-33-00003.

