Структура заболеваемости туберкулезом детей и подростков отличается от взрослого контингента больных и в ней достаточно высока доля «малых» форм туберкулеза (ТВГЛУ – туберкулез внутригрудных лимфатических узлов, и очаговый туберкулез легких), в то же время среди легочных форм туберкулеза встречаются и деструктивные процессы [1]. В клинической практике ТВГЛУ наблюдаются значительно чаще, чем первичный туберкулезный комплекс, хотя лимфаденит является неотъемлемой его частью. Согласно классификации ВОЗ ТВГЛУ относят к формам внелегочного туберкулеза и редко выделяют в исследованиях в отдельную группу, поэтому сопоставить частоту встречаемости ТВГЛУ у больных детей и подростков в различных странах крайне сложно [2].
По существующим к настоящему моменту представлениям макрофаги и миелоидная субпопуляция дендритных клеток верхних и нижних отделов респираторного тракта первыми контактируют с вдыхаемыми чужеродными антигенами (в том числе и микобактериями), фагоцитируют их через посредство целого ряда рецепторов (маннозный рецептор, сурфактант D, DC-SIGN-специфичная для дендритных клеток интегриновая молекула, С-лектиновый рецептор, Nod-подобные молекулы и Toll-подобные молекулы). Впоследствии фагоцитированные антигены переносятся в регионарные лимфоузлы, что показано с помощью метки микобактерий флюоресцирующим белком GFP. Здесь дендритные клетки вырабатывают достаточное количество IL-12p40, IL-12Rβ1 и CD11c и обеспечивают инициализацию иммунного ответа через премирование Т хелперов 1 с последующей выработкой клеток эффекторов и памяти, при этом субпопуляция клеток памяти имеет способность селективно мигрировать в места первичного попадания антигена. Однако микобактерии, попавшие в лимфоузлы в дендритных клетках, обладают способностью снижать презентирующую способность поверхностных молекул MHC class II и создают тем самым условия для длительной персистенции в дендритных клетках лимфоузлов [3].
Исследования, подтверждающие наличие микобактерий в лимфоузлах, немногочисленны и касались преимущественно их периферических локализаций, для ТВГЛУ вообще единичные. Если гистологически различные признаки туберкулезного воспаления выявлялись во всех исследованных биоптатах, то методом посева на BACTEC микобактерии выявлены в 40–60 %, методом окрашивания по Циль-Нильсену в 13,3 %. Молекулярно-генетические методы позволяют увеличить выявляемость МБТ до 82,5 %, при этом дальнейшая характеристика изолятов M. tuberculosis выявила принадлежность к 26 различным сполиготипам (SIT) и 13 к вновь выявленным образцам. Наиболее распространенными штаммами были SIT149, SIT53, SIT26 и SIT37 сублиний T3-ETH, T1, CASI-DELHI и T3 [4]. При сравнении иммуногистохимическими методами обнаружения антигенов микобактерий (секретируемые – MPT32, MPT44, MPT46, MPT51, MPT53, MPT59, MPT63, MPT64 и соматические – Mce1A, Hsp65 и MPT57) в биоптатах легких и лимфоузлов было показано, что в ткани легких обнаруживались как секреторные, так и соматические антигены, а в лимфоузлах прежде всего соматические антигены. Из секреторных антигенов в обоих случаях постоянно обнаруживался только MPT64, что указывало на преимущественное накопление этого антигена в клетках гранулемы в условиях хронически текущей инфекции. Компоненты комплекса антигена 85 (MPT44 (Ag85A), MPT51 (Ag85D), MPT59 (Ag85B) выявлялись в половине случаев. Эти данные указывают на снижение секреторной активности МБТ, находящихся в лимфоузлах и пребывании их преимущественно в персистирующем состоянии [2]. Этому процессу со стороны макроорганизма способствуют различные факторы: повышенная экспрессия генов IL-10 и TGF-β эпителиоидными и многоядерными клетками и факторов апоптоза (Bcl2, Bax, FasL и Fas) гигантскими многоядерными клетками, которые могут использоваться микобактериями для уклонения от иммунного ответа и персистенции в тканях хозяина [5].
По существующим на сегодня представлениям различные субпопуляции Т и В клеток и гуморальные факторы адаптивного звена иммунитета являются ведущими в адекватном функционировании противотуберкулезного иммунитета, а реакции врожденного иммунитета преимущественно активны на стадии «латентной» фазы туберкулеза, определяющегося наличием положительных кожных проб и IGRA-тестов с антигенами микобактерий [6]. Поскольку данные положения получены в результате сравнительного исследования латентных форм и активно распространенного туберкулезного процессов, и небольшие локальные формы практически не находились в поле зрения исследователей, то степень «активности» двух основных звеньев нуждается в дальнейшем изучении.
Эффекторная часть врожденного иммунитета представлена цитолитическими молекулами (гранулизин, кателицидин, перфорин, гранзимы А и В и β-дефензином, содержатся в секреторных ацидофильных гранулах цитотоксических Т-лимфоцитов, небольшой популяцией МНС – не рестриктированных γδ T (CD3+γδ TCR+ ) клеток, и NK-клетках и способны лизировать опухолевые клетки и внутриклеточно располагающиеся вирусы и микроорганизмы, такие как Mycobacteria, Brucella [7].
Адаптивные реакции противотуберкулезного иммунитета крайне разнообразны по субпопуляциям Т и В клеток, спектру цитокинов и хемокинов, и клеток и факторов фагоцитарного звена. Среди цитокиновых факторов, выделяемых Т клетками, ведущая роль отведена интерферону-γ (ИНФ-γ), который вырабатывается в основном премированными CD4+ and CD8+T клетками и в меньшей степени лимфоцитами, относящимися к звену врожденного иммунитета γδ T клетками, NK T клетками и NK клетками. Наиболее высокий уровень экспрессии гена ИНФ-γ и его выработка осуществляется лимфоцитами T хелперами 1 типа, которые активируют киллинг макрофагами микробных тел, усиливают цитотоксическую активность других клеток, индуцируют апоптоз эпителиальных клеток кожи и слизистых, регулируют экспрессию белков МНС I и II класса и презентацию антигенов. Существует значительная вариабельность выработки ИНФ-γ у больных туберкулезом, и если до начала лечения она в целом низкая, то к 6 месяцам проведения противотуберкулезной химиотерапии она возрастает, но отличается значительной вариабельностью показателей в зависимости от степени выраженности и характера течения процесса [8].
Фактор торможения миграции макрофагов (МИФ) является одним из первых открытых цитокинов, основная функция которого состоит в угнетении хаотичной миграции макрофагов и накоплении в очагах воспаления и последующей функциональной их поляризацией на М1 и М2 субпопуляции. В многочисленных исследованиях показано увеличение продукции МИФ в супернатантах клеточных культур и в сыворотке больных туберкулезом, а также его наличие в тканевых структурах гранулем эксперментальных животных и биоптатах лимфоузлов больных туберкулезом, где он способствует накоплению клеток через усиление экспрессии ряда хемокинов (моноцитарный хемоатрактантный протеин МСР-1 и молекул адгезии I-CAM-1 и V-CAM-1) [9]. Ранее нами описана динамика продукции МИФ в культуре крови в зависимости от положительного, торпидного или прогрессирующего характера течения туберкулезного процесса у подростков, больных деструктивными формами туберкулеза [10]. Однако динамика выработки МИФ у больных «малыми» формами туберкулеза органов дыхания пока не изучена.
Целью настоящего исследования явилось изучение значимости динамических изменений цитолитических молекул врожденного иммунитета (гранулизина, перфорина, кателицидина и витамин Д связывающего протеина), фактора ингибиции миграции макрофагов и ключевого цитокина приобретенного противотуберкулезного иммунитета ИНФ-γ у детей и подростков, больных различными формами туберкулеза органов дыхания.
Материалы и методы исследования
Исследование проведено на 85 больных, разделенных на три группы. В группу больных с деструктивным туберкулезом включено 30 человек в возрасте от 12 до 17 лет. Инфильтративный туберкулез в фазе распада и обсеменения диагностирован у 25 человек, диссеминированный туберкулез в фазе распада – у 1 человека, множественные туберкулемы в фазе распада и обсеменения – у 2-х человек, фиброзно-кавернозный туберкулез – у 1 человека и казеозная пневмония – 1 человек.
В исследование включено 55 больных в возрасте от 3 до 16 лет с «малыми» формами туберкулеза органов дыхания. Туберкулез внутригрудных лимфатических узлов (ТВГЛУ) в фазе уплотнения и начинающейся кальцинации диагностирован у 25 человек, в том числе с очагами отсева в легочную ткань – 15 человек; очаговый туберкулез легких – 30 человек, из которых процесс находился в фазе инфильтрации – 12 чел., в фазе уплотнения и начинающейся кальцинации – 18 чел.
Группу инфицированных МБТ составили 9 пациентов в возрасте от 5 до 14 лет, обследованных по поводу контакта с больными туберкулезом и имевших положительные реакции пробы Манту с 2 TE и Диаскинтест.
Гранулизин, кателицидин, перфорин-1 и витамин Д связывающий протеин определяли в К3ЭДТА плазме методом иммуноферментного анализа с помощью наборов SEB517Hu, CEC419Hu, SEB317Hu и SEB810Hu (Cloud-Clone Corp.) согласно инструкции изготовителя. Спонтанную продукцию МИФ определяли в супернатантах суточных культур цельной крови. Образцы супернатантов собирали через 18–22 часа культивирования. МИФ определяли методом иммуноферментного анализа с помощью набора DuoSet Human MIF иммуноферментного анализа R@D (Великобритания). Спонтанную продукцию ИНФ-γ определяли в супернатантах культур мононуклеаров больных туберкулезом, полученных из гепаринизированной крови. После лизиса эритроцитов и 3-кратного отмывания мононуклеары культивировали в количестве 1х106 кл/мл культуральной среды RPMI 1640 с необходимыми добавками. Образцы супернатантов собирали через 22–24 часа культивирования. Концентрацию цитокина определяли методом иммуноферментного анализа с помощью набора «Вектор-Бест» (Россия). Результаты обрабатывались статистически с помощью пакета Microsoft Exel.
Результаты исследования и их обсуждение
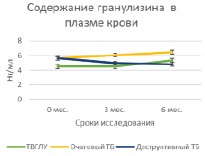
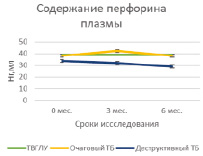
Изучение содержания в плазме крови уровня цитолитических молекул и ВДБ у больных исследуемых групп в сравнении с группой инфицированных МБТ показало отсутствие различий для гранулизина, кателицидина и ВДБ. Содержание перфорина было достоверно низким в группе деструктивного туберкулеза по сравнению с группой инфицированных МБТ (33,8 ± 2,5 нг/мл и 39,5 ± 1,1 нг/мл, соответственно, Р = 0,04403), тогда как для группы очагового туберкулеза и ТВГЛУ различия были статистически недостоверными (табл. 1).
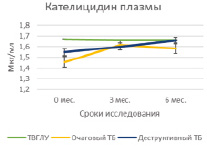
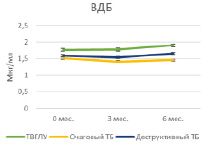
Проведение курса химиотерапии практически не оказывало влияния на содержание гранулиза в плазме крови в исследуемых группах больных за исключением достоверного возрастания его содержаний к 6 мес. у больных очаговым туберкулезом (5,6 ± 0,2 нг/мл и 6,47 ± 0,3 нг/мл, Р = 0,02939) (табл. 1, рис. 1, А). Содержание перфорина плазмы в группах больных также не изменялось под влиянием курса химиотерапии, но при деструктивном туберкулезе его уровень был достоверно низким по сравнению с больными ТВГЛУ и очаговым туберкулезом как на сроке 3 мес. (31,7 ± 1,6 нг/мл по сравнению с 38,8 ± 1,6 нг/мл; Р = 0,00635 и 42,1 ± 1,3 нг/мл; Р = 0,00012 соответственно), так и на сроке 6 мес. (28,9 ± 2,3 нг/мл по сравнению с 39,1 ± 3,1 нг/мл; Р = 0,017774 и 38,3 ± 0,8 нг/мл; Р = 0,00138 соответственно) (табл. 2, рис. 1, Б). В исследованных группах также не наблюдалось значимых изменений плазменного содержания кателицидина и ВДБ (табл. 2, рис. 2, А и Б).
А Б
Рис. 1. Содержание гранулизина и перфорина в плазме крови больных на фоне проводимой противотуберкулезной химиотерапии
А Б
Рис. 2. Содержание кателицидина и ВДБ в плазме крови больных на фоне проводимой противотуберкулезной химиотерапии
А Б
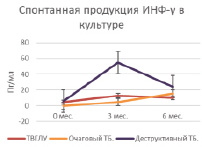
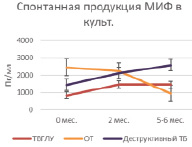
Рис. 3. Спонтанная продукция ИНФ-γ и МИФ в суточной культуре клеток крови больных на фоне проводимой противотуберкулезной химиотерапии
В оценке эффективности основного цитокина адаптивного противотуберкулезного иммунитета ИНФ-γ мы ориентировались на спонтанную продукцию в суточной культуре крови, которая отражает тенденции его динамики у больных туберкулезом детей и подростков [11]. В целом индивидуальные показатели спонтанной продукции этого цитокина у больных характеризуются значительной вариабельностью. Так у больных очаговым туберкулезом до начала лечения она отсутствует и к 3 мес. возрастает до 4,7 ± ± 3,4 пг/мл и впоследствии достоверно не меняется (6 мес. 15,5 ± 7,6 пг/мл). У больных ТВГЛУ до начала лечения она составила 4,4 ± 2,4 пг/мл и к 3 мес. возросла до 13,1 ± 2,5 пг/мл (Р = 0,03471) и впоследствии достоверно не менялась (6 мес. 10,0 ± ± 5,3 пг/мл). У больных деструктивными процесами до начала лечения спонтанная продукция была ниже границы чувствительности метода в 40–60 % случаев. К 3 мес. отмечен подъем продукции ИНФ-γ, который прослеживался до 6 месяцев химиотерапии (0 мес. 4,6 ± 2,4 пг/мл, 58,8 ± ± 8,7 пг/мл, Р = 0,00824 и 6 мес. 23,9 ± ± 7,6 пг/мл, Р = 0,00915), но при этом сохранялись выраженные индивидуальные различия выработки фактора. Следует отметить, что спонтанная продукция ИНФ-γ у больных с деструктивным туберкулезом через 3 мес. лечения была достоверно выше, чем у больных с ТВГЛУ и очаговым туберкулезом (58,8 ± 8,7 пг/мл, 13,1 ± 2,5 пг/мл и 4,7 ± ± 3,4 пг/мл; Р = 0,01741) (табл. 3, рис. 3, А).
Спонтанная продукция МИФ в группе больных ТВГЛУ до начала лечения находилась на уровне 837,3 ± 107,6 пг/мл и была достоверно ниже, чем у больных очаговым туберкулезом 2455,1 ± 522,9 пг/мл (Р = 0,00965) и деструктивным туберкулезом 1439,0 ± 188,8 пг/мл (Р = 0,01826). В процессе проведения химиотерапии (через 3 и 6 мес. лечения) уровень продукции МИФ достоверно не менялся как в группе больных ТВГЛУ (1462,9 ± 384,7 пг/мл и 1451,1 ± 252,9 пг/мл соответственно), так и у больных с деструктивными процессами (3 мес. – 2122,7 ± 362,4 пг/мл и 6 мес. – 2572,2 ± 661,7 пг/мл). В группе больных очаговым туберкулезом уровень продукции МИФ достоверно снижается к 6 мес. лечения (3 мес. – 2246,6 ± ± 366,8 пг/мл и 6 мес. – 952,2 ± 36,2 пг/мл; Р = 0,00486) (табл. 3, рис. 3, Б).
Таблица 1
Содержание цитолитических молекул сыворотки у инфицированных МБТ и больных деструктивными и «малыми» формами туберкулеза органов дыхания до начала противотуберкулезной терапии
|
Факторы Формы ТБ |
Гранулизин (нг/мл) |
Перфорин (нг/мл) |
Кателицидин (мкг/мл) |
ВДБ (мкг/мл) |
|
Очаговый ТБ |
5,6 ± 0,2 |
38,4 ± 0,9 |
1,45 ± 0,15 |
1,5 ± 0,08 |
|
ТВГЛУ |
4,5 ± 0,6 |
39,15 ± 1,2 |
1,7 ± 0,13 |
1,77 ± 0,1 |
|
Деструктивный ТБ |
5,6 ± 0,8 |
33,8 ± 2,5* |
1,55 ± 0,2 |
1,6 ± 0,1 |
|
Инфицированные МБТ |
4,6 ± 0,6 |
39,5 ± 1,1 |
1,7 ± 0,2 |
1,5 ± 0,04 |
Примечание. * Р = 0,01366 по сравнению с группой инфицированных.
Таблица 2
Динамические изменения уровня цитолитических молекул и витамин Д связывающего протеина у больных с различными клиническими формами туберкулеза в процессе проведения химиотерапии
|
Показатель Группы больных |
Сроки обследования |
||
|
до начала химиотерапии |
через 3 мес. химиотерапии |
через 6 мес. химиотерапии |
|
|
Гранулизин (нг/мл) |
|||
|
Очаговый ТБ |
5,6 ± 0,2 |
6,07 ± 0,29 |
6,47 ± 0,3* |
|
ТВГЛУ |
4,5 ± 0,6 |
4,5 ± 0,6 |
5,3 ± 0,5 |
|
Деструктивный ТБ |
5,6 ± 0,8 |
4,9 ± 0,6 |
4,8 ± 0,7 |
|
Перфорин (нг/мл) |
|||
|
Очаговый ТБ |
38,4 ± 0,9 |
42,1 ± 1,3 |
38,3 ± 0,8 |
|
ТВГЛУ |
39,15 ± 1,2 |
38,8 ± 1,6 |
39,1 ± 3,1 |
|
Деструктивный ТБ |
33,8 ± 2,5 |
31,7 ± 1,6** |
28,9 ± 2,3*** |
|
Кателицидин (мкг/мл) |
|||
|
Очаговый ТБ |
1,45 ± 0,15 |
1,6 ± 0,09 |
1,58 ± 0,08 |
|
ТВГЛУ |
1,7 ± 0,13 |
1,65 ± 0,22 |
1,65 ± 0,23 |
|
Деструктивный ТБ |
1,55 ± 0,2 |
1,6 ± 0,06 |
1,6 ± 0,36 |
|
Витамин Д связывающий протеин (мкг/мл) |
|||
|
Очаговый ТБ |
1,5 ± 0,08 |
1,4 ± 0,08 |
1,45 ± 0,07 |
|
ТВГЛУ |
1,77 ± 0,1 |
1,77 ± 0,05 |
1,9 ± 0,09 |
|
Деструктивный ТБ |
1,6 ± 0,1 |
1,53 ± 0,03 |
1,66 ± 0,1 |
Примечание. *Р = 0,02939 при сравнении с уровнем до начала химиотерапии;
**Р = 0,00635 при сравнении с ТВГЛУ; **Р = 0,00012 при сравнении с очаговым ТБ;
***Р = 0,017774 при сравнении с ТВГЛУ; ***Р = 0,00138 при сравнении с очаговым ТБ.
Таблица 3
Динамические изменения уровня интерферона-гамма (ИНФ-γ) и фактора торможения миграции макрофагов (МИФ) у больных с различными клиническими формами туберкулеза в процессе проведения химиотерапии
|
Показатель Группы больных |
Сроки обследования |
||
|
до начала химиотерапии |
через 3 мес. химиотерапии |
через 6 мес. химиотерапии |
|
|
ИНФ-γ (пг/мл) |
|||
|
Очаговый ТБ |
– |
4,7±3,4 |
15,5±7,6 |
|
ТВГЛУ |
4,4 ± 2,4 |
13,1 ± 2,5* |
10,0 ± 5,3 |
|
Деструктивный ТБ |
4,6 ± 2,4 |
58,8 ± 8,7** |
23,9 ± 7,6*** |
|
МИФ (пг/мл) |
|||
|
Очаговый ТБ |
2455,1 ± 522,9 |
2246,6 ± 366,8 |
952,2 ± 36,2***** |
|
ТВГЛУ |
837,3 ± 107,6**** |
1462,9 ± 384,7 |
1451,1 ± 252,9 |
|
Деструктивный ТБ |
1439,0 ± 188,8 |
2122,7 ± 362,4 |
2572,2 ± 661,7 |
Примечание. *Р = 0,03471 при сравнении с уровнем до начала химиотерапии;
**Р = 0,00824 при сравнении с уровнем до начала химиотерапии;
***Р = 0,00915 при сравнении с уровнем до начала химиотерапии;
****Р = 0,00965 при сравнении с очаговым ТБ; ****Р = 0,011826 при сравнении с деструктивным туберкулезом;
*****Р = 0,00486 при сравнении с уровнем до начала химиотерапии.
Заключение
Сравнительная оценка содержания в плазме крови детей и подростков, больных различными формами туберкулеза органов дыхания, цитолитических молекул, характеризующих выраженность реакций врожденного звена противотуберкулезного иммунитета, показала достоверное снижение продукции перфорина у больных деструктивным туберкулезом по сравнению с группой инфицированных МБТ и отсутствие различий в продукции остальных факторов (гранулизин, кателицидин и ВДБ). Низкий уровень продукции перфорина сохранялся у больных с деструктивным туберкулезом, несмотря на проводимое лечение. Можно предположить, что к группе больных с деструктивным туберкулезом в отличие от «малых» форм относятся лица, несущие DRB1*1501 аллель локуса гистосовместимости HLA-DR2, для которых описано значительное снижение общего числа перфорин-положительных клеток CD16+ и CD56+клеток по сравнению с лицами, имеющими аллель DRB1*1502 [12].
Достоверное увеличение содержания гранулизина плазмы крови показано нами только для группы больных очаговым туберкулезом, что в целом совпадает с литературными данными об увеличении его продукции у больных туберкулезом детей активным легочным туберкулезом после проведенного 4-х месячного курса химиотерапии. Однако авторами эти данные представлены для больных туберкулезом без разделения на клинические формы процесса [13].
Нами не выявлено достоверных различий и динамических изменений уровней кателицидина и ВДБ в исследованных группах больных, но делать вывод о малой значимости этих факторов врожденного иммунитета преждевременно, поскольку сравнение проводилось на небольших группах.
Увеличение продукции ИНФ-γ у больных с деструктивным туберкулезом подтверждает аналогичные данные, полученные ранее в других исследованиях [8]. Сведения о его продукции у больных ТВГЛУ и очаговым туберкулезом описаны впервые и представляет интерес факт увеличения его выработки у больных ТВГЛУ к 3 мес. лечения, но отсутствие дальнейшей положительной динамики указывает на недостаточность его выработки для активизации функции макрофагов в элиминации микобактерий, персистирующих в ткани лимфоузлов больных [4]. Фактор торможения миграции макрофагов (МИФ) был одним из первых гуморальных провоспалительных факторов инфекционного иммунитета, открытый одновременно B.R. Bloom, B. Bennet (1966). Вариабельность его продукции у здоровых добровольцев и больных различными инфекционными заболеваниями обусловлена генетически и описана положительная корреляция доминантного аллельного полиморфизма в положении 173С с наличием и выраженностью туберкулеза [14]. Положительная и отрицательная динамика продукции МИФ у больных в зависимости от положительного, торпидного и прогрессирующего характера течения процесса описана нами ранее для различных форм деструктивного туберкулеза [10]. Можно предположить, что при очаговых формах туберкулеза генетически обусловленная изначальная продукция МИФ способствует локализации процесса, тогда как при ТВГЛУ его уровень и функциональная кооперация с другими провоспалительными цитокинами недостаточна для подавления роста и элиминации микобактерий из очагов поражения.

