Перемещение пальца, культи пальца и пястной кости поврежденной одноименной кисти до настоящего времени применяется для реконструкции первого и/или одного из трехфаланговых пальцев кисти довольно редко по разным причинам [1]. Одной из них является возможность возникновения острых сосудистых нарушений (до 36,4 %) при перемещении патологически измененных тканей [2] и неразработанность методов профилактики таких расстройств. Сосудистые расстройства вызывают нарушения кровообращения тканей и частичное или даже полное их омертвение. Сосудистые расстройства приводят к частичным или полным некрозам кожных лоскутов, трансплантатов и перемещенного сегмента, что вызывает существенное снижение функционального и косметического результата операции и увеличение изъяна и без того увечной кисти [1, 3].
Перспективным направлением в профилактике ишемических осложнений в тканях, применяемым в различных отраслях медицины, является ишемическое прекондиционирование тканей [4]. Известны способы механической ишемической тренировки питающих ножек различных несвободных комплексов тканей перед их переносом в реципиентную область в реконструктивной хирургии [5, 6]. В результате экспериментальных и клинических исследований установлено, что механическая тренировка стебля вызывает развитие целого комплекса компенсаторных реакций в тканях на различных уровнях их системной организации. Данное направление используется также перед выполнением различных реконструктивных операций на кисти [7]. Для оценки эффективности метода применяется какой-либо один метод: полярографическое определение кислорода в тканях, реовазография, а также лазерная доплерометрия. Однако возможности данного направления при выполнении реконструкции пальцев кисти в настоящее время не изучены. В связи с этим возникает необходимость в разработке и физиологическом обосновании новых подходов к улучшению макро- и микроциркуляции в рубцово измененных донорских сегментах и профилактике ишемических осложнений на сформированном пальце с использованием комплексного подхода к функциональным исследованиям.
Цель исследования: разработать и обосновать новый способ профилактики послеоперационных ишемических осложнений перемещаемого пальца кисти.
Материалы и методы исследования
Институт обладает опытом перемещения пальца, культи пальца и пястной кости на травмированной кисти у 184 больных. Всего на 189 кистях методом перемещения подобных сегментов выполнена реконструкция 203 пальцев. В 90,2 % случаев перемещаемые сегменты имели рубцовые изменения различной тяжести. Анализ приживляемости сегментов выявил высокую частоту развития ишемических осложнений различной степени тяжести до 34,3 %, что обусловило необходимость разработки методов их профилактики. Наряду с хирургическими методами профилактики ишемических осложнений перемещенных рубцово измененных сегментов использовали способы, направленные на улучшение их кожного кровотока за счет создания перед операцией многократной нарастающей ишемической нагрузки на донорские ткани путем внешнего механического сдавления сосудов сегмента.
Предпосылкой для исследования возможностей этого направления послужили фундаментальные работы об эффективности ишемического прекондиционирования органов [4] при их сосудистой патологии, в том числе для профилактики и коррекции ишемических повреждений тканей в хирургии. С целью исследования механизмов формирования компенсаторных сосудистых реакций и возможности применения этого подхода при перемещении патологически измененных сегментов кисти использовали клинические, рентгенологические, морфологические, биофизические (тепловидение, лазерная доплеровская флоуметрия, реовазография) методы исследования.
Изучалось влияние различных по длительности и частоте ишемических нагрузок на состояние микро- и макроциркуляции донорского пальца. В исследовании участвовало 6 добровольцев-мужчин (средний возраст 29 лет), которым проведено 54 эксперимента. При этом проводилось бинтование второго пальца эластическим артериальным жгутом, причем ногтевую фалангу оставляли открытой для регистрации параметров кровотока. Частота наложения жгута составляла 4 раза в день, а время его нахождения варьировало от 10 до 30 минут [8]. С помощью матричного тепловизора Thermo Tracer ТН-9100 (NEC, Япония) регистрировали динамику температур на тыльной поверхности обеих кистей в 54 экспериментах на 6 добровольцах мужского пола (средний возраст 29 лет) до, во время наложения жгута и после его снятия через различные интервалы времени.
Компьютерный анализ тепловизионных (ТПВ) данных проводили с помощью программы обработки термоизображений GTS 5.1.1.011. Обработка ИК термокарт включала также компенсацию искажений, сегментирование последовательности термоизображений [9]. Исследование параметров макроциркуляции тренируемого пальца проводили на 6-канальном реографе-полианализаторе РГПА-6/12 «Реан-Поли» (Медиком МТД, Россия). Для определения показателей кожной микроциркуляции использовали лазерный доплеровский флоуметр ЛАКК-М (НПП «Лазма», Россия). Проводили изучение активных и пассивных факторов регуляции микрокровотока с применением аппарата вейвлет-преобразования [10]. Статистические исследования выполняли с использованием программы STATISTICA-10. Достоверность статистических гипотез изучали с использованием параметрических и непараметрическеикх критериев.
Результаты исследования и их обсуждение
Основным критерием оценки результата операции в ранние сроки после ее выполнения служили приживляемость сегмента и характер заживления раны, так как данные показатели зависят от состояния кровообращения тканей. Разработанный подход обеспечил полное приживление патологически измененных тканей и заживление ран первичным натяжением во всех случаях. При использовании оригинальных подходов к перемещению и ишемической тренировке достигнуто приживление всех сегментов и заживление ран первичным натяжением при многообразных дефектах кисти механической, огнестрельной и термической этиологии, в том числе в условиях обширных рубцов и нарушений магистрального кровообращения сегмента тяжелой степени.
Дискриминационная чувствительность на восстановленном пальце после перемещения культи пальца составила 6,28 ± 0,77 мм, пястной кости – 7,3 ± 0,6 мм, а интактного пальца – 3,1 ± 0,3 мм.
Установлено, что механическая тренировка пальца к ишемии приводит к улучшению его кровенаполнения и показателей кожной микроциркуляции на ногтевой фаланге, в области первого межпальцевого промежутка и расположения медиальной пальцевой артерии. На ногтевой фаланге бинтуемого пальца наибольший прирост температуры после снятия жгута составлял при десятиминутной экспозиции в среднем 6,68 ± 1,98 °С (р < 0,05) за первые 2 минуты, при этом показатель микроциркуляции возрастал в 3 раза. На пике роста температурных значений происходило увеличение параметров индекса венозного оттока и реографического индекса в среднем на 21 % (р = 0,01), что согласуется с данными авторов, проводивших ишемическое прекондиционирование кисти перед операцией [7]. Нами проводились различные по времени (от 4–6 дней до 6 месяцев) тренировки. Установлено, что характер адаптивных реакций в ответ на окклюзию и сроки их достижения не зависят от длительности тренировок. Выявленные закономерности позволили разработать методику тренировки перемещаемого донорского пальца, обеспечивающей профилактику нарушений периферической микроциркуляции его кожных покровов и перемещенных лоскутов в области первой комиссуры после операции по реконструкции большого пальца [Патент РФ № 2566190].
Тренировка проводилась в течение 4–6 дней путем наложения артериального жгута на палец. Длительность нахождения жгута в первый день составила 10 минут, во второй – 15 минут третьий – 20 минут, в четвертый – 25 минут, в пятый – 30 мнут. Кратность пережатия во все дни равнялась четырем. Тренировку проводили до достижения прироста температуры на дистальной фаланге не менее 1,7 °С. Методика с успехом апробирована на 12 больных, имевших высокий риск развития послеоперационных ишемических осложнений.
Приводим клинический пример.
Мужчина, 42 лет, находился в клинике по поводу отсутствия первого пальца с пястной костью, деформаций 2, 3, 4 пальцев, рубцового дефекта мягких тканей и фаланг второго пальца правой кисти (рис. 1).
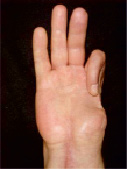
Рис. 1. Внешний вид кисти больного до операции (ладонная поверхность)
Через 2 года и 5 месяцев после травмы проведена реконструкция лучевого края кисти за счет перемещения дефектного второго пальца на двух кожных питающих ножках. Предварительно была устранена его деформация, выполнены кожная лоскутная пластика и тренировка его к ишемии с использованием оригинальной методики.
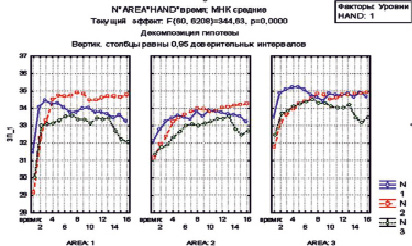
Рис. 2. Диаграмма температур в трех зонах тренируемого пальца у больного Ш. (зона 1 – ногтевая фаланга, 2 – область латеральной тыльной пальцевой артерии, 3 – область «анатомической табакерки»)
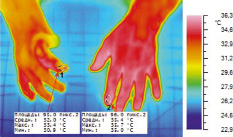
Рис. 3. Термокарта кисти б-го Ш. после первого пережатия (10 минут) сосудов донорского пальца, вторая минута восстановления кровотока
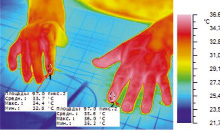
Рис. 4. Термокарта кисти б-го Ш. после 24-ого пережатия (20 минут) сосудов пальца, вторая минута восстановления кровотока
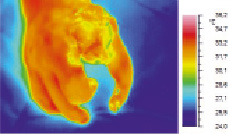
Рис. 5. Термокарта кисти б-го Ш. Через 8 дней после реконструкции пальца
Из приведенных диаграмм температур (рис. 2) и термокарт (рис. 3 и 4) видна положительная динамика нарастания ТПВ показателей в исследуемых областях на этапе постокклюзионного восстановления в результате предоперационной ишемической тренировки. В результате проведенных мероприятий восстановлены первый палец и адекватный первый межпальцевой промежуток. Хорошее кровоснабжением тканей обеспечило приживление тканей и заживление ран первичным натяжением (рис. 5). Перемещение утильного патологически измененного сегмента позволило восстановить схват кисти даже в условиях его деформации и тяжелого нарушения кровообращения в тканях (рис. 6).

Рис. 6. Функция кисти через 1 год после реконструкции лучевого края
Результаты исследования показывают, что ишемическая тренировка тканей, используемые хирургическая и консервативные методики обеспечивают адекватную профилактику ишемических осложнений. При этом достигается метаболическая адаптация тканей, повышается переносимость ими тяжелой гипоксии, отмечаемой при собственно перемещении сегмента кисти и кожных лоскутов. Выполненная нами работа показывает, что разработанный нами подход к ишемическому прекондиционированию пальца обеспечивает надежное приживление донорского пальца кисти.
Как следует из анализа литературных данных, профилактика ишемических осложнений при перемещении пальцев чаще всего осуществляется консервативными методами, включающими применение медикаментов, физических факторов, придание кисти возвышенного положения. Реже применяются хирургические методы, заключающиеся в выполнении первичной артериальной или венозной реваскуляризации сегмента. В ситуации, когда имеются глубокие и обширные рубцы, такие подходы мало пригодны и не всегда эффективны вследствие облитерации, сдавления и/или патологических изменений стенок артерий и вен. Кроме того, даже восстановление магистрального кровотока не обеспечивает адекватной профилактики ишемических осложнений в рубцовых тканях вследствие нарушения в них микроциркуляции и тканевого метаболизма. В случае транспозиции рубцово измененных и тяжело деформированных сегментов, особенно пальцев и их культей на дистальных уровнях, частота некрозов значительно возрастает [2]. При этом чаще отмечаются некрозы концевых отделов пальца, наиболее важных в функциональном отношении. Анализ наших результатов свидетельствует о том, что тяжесть и частота подобных осложнений нарастают по мере увеличения площади и глубины рубцовых поражений тканей, степени деформации, повреждения кисти, а также расстояния переноса донорского сегмента.
Неповреждающая (субкритическая) избирательная гипоксическая нагрузка на донорские ткани путем периодического механического пережатия сосудов временных питающих ножек пересаживаемых тканевых комплексов с помощью жгута или эластичного жома с большим успехом реализуется при пластике несвободным паховым лоскутом для стимуляции его периферической реваскуляризации [5]. Однако данный подход не применим при использовании постоянных питающих ножек, что имеет место при перемещении сегмента кисти, когда необходимо активировать другие механизмы компенсации ишемии и улучшения микроциркуляции. В случае выполнения разнообразных реконструктивных операций на кисти с использованием ее донорских ресурсов для профилактики сосудистых осложнений проводится также предварительная периодическая ишемизация тканей путем наложения артериального жгута на предплечье или плечо [7]. Однако длительность нахождения жгута на конечности ограничена из-за болевых ощущений неврогенного и ишемического характера, что снижает эффективность тренировки перемещаемого сегмента и не обеспечивает ее селективности. Наш подход заключается в ишемическом прекондиционировании непосредственно донорского сегмента [8]. При этом обеспечивается избирательная гипоксическая нагрузка на его дистальные отделы, наиболее подверженные некрозам. Тренировка донорского пальца или его культи сопровождается постепенно возрастающей ишемической нагрузкой, что повышает переносимость тканевой гипоксии, приводит к активизации кровообращения в питающих ножках и улучшает приживляемость тканей всего сегмента. Тренировка сопровождается минимальными болевыми ощущениями, что предотвращает сосудистый спазм. В результате увеличивается длительность окклюзии и ее переносимость, а следовательно, и эффективность прекондиционирования (тренировки) тканей донорского сегмента, а также первого межпальцевого промежутка.
Наш опыт свидетельствует о том, что в случае перемещения сегментов кисти с тяжелой и крайне тяжелой степенями деформаций, рубцовых изменений тканей, повреждениями сосудов целесообразно проводить предварительную тренировку донорского сегмента к гипоксии и бескровным, и оперативным путем. Это не исключает выполнения традиционных консервативных приемов улучшения васкуляризации перемещаемого сегмента.
Заключение
Гипоксическое прекондиционирование перемещаемых сегментов кисти обеспечивает адекватную

