Цереброваскулярные и нейродегенеративные заболевания являются одной из основных причин смертности и инвалидизации населения. В этой связи актуальное значение имеет разработка новых фармакологических подходов для диагностики и лечения этих заболеваний. В 1994 г. обнаружен фактор дифференцировки HLDF (Human Leukaemia Differentiation Factor) и синтезирован его шестичленный фрагмент – пептид HLDF-6, который демонстрирует широкий диапазон ноотропной и нейропротекторной активности [1, 2]. Этот пептид проявляет антиапоптозную активность и защищает клетки против бета-амилоидного (βA) пептида, азида натрия, церамида, этанола, холодового стресса и гипоксии, повышает жизнеспособность эмбрионов мыши in vitro [2]. Пептид легко метаболизируется, неиммуногенен и нетоксичен, характеризуется высокой эффективностью специфической активности и безопасен при дозе, в десять раз превышающей терапевтическую дозу. В опытах с использованием различных экспериментальных моделей животных (водный лабиринт Морриса, тест пассивного избегания, тест распознавания объекта) обнаружено, что центральное и системное введение пептида здоровым животным способствует формированию и хранению долговременной памяти [1]. Показано, что пептид устранял выраженный когнитивный дефицит в экспериментальных моделях клинической патологии и вносил вклад в восстановление нарушенной памяти [3]. Пептид HLDF-6 обладает высокой анксиолитической активностью. В тестах «открытого поля» и «приподнятого крестообразного лабиринта» HLDF-6 демонстрировал анксиолитические эффекты, которые были сопоставимы с таковыми для эталонного лекарственного средства диазепама [1].
Обнаружено, что HLDF-6 вовлечен в регуляцию содержания NMDA-рецепторов в мембранах, что коррелировало с изменением когнитивных функций мозга [4, 5]. Вместе с тем пептид HLDF-6 не влиял на плотность GABA-рецепторов и никотиновых холинорецепторов, но индуцировал уменьшение плотности рецепторов серотонина 5-HT2 [5]. Сделано заключение, что механизм нейроактивности пептида HLDF-6 может реализовываться через его влияние на глутамат- и серотонинергические системы. Полагают, что психотропная активность HLDF-6 является перспективной для его введения в медицинскую практику в качестве высокоэффективного анксиолитического и ноотропного лекарственного средства при психических и неврологических заболеваниях.
Необходимо отметить, что нейронные механизмы эффектов пептида HLDF-6 и возможность его участия в механизмах регуляции биоэлектрической активности и синаптической пластичности не исследовались.
Цель исследования: на полуинтактных препаратах виноградных улиток изучить влияние пептида HLDF-6 на свойства электрогенной мембраны и ответы, вызванные различными сенсорными раздражениями гигантских интернейронов оборонительного поведения ЛПл1.
Материалы и методы исследования
Опыты проводили на интернейроне оборонительного поведения ЛПл1 полуинтактного препарата виноградных улиток Helix lucorum [6]. Показано, что этот нейрон играет важную роль в механизмах оборонительных реакций и их пластических перестройках при разных формах обучения [6]. Перед операцией животное анестезировали охлаждением в смеси воды со льдом в течение 30–40 мин и введением в полость тела непосредственно перед операцией 100–150 мг MgCl2, разведенного в 2 мл физиологического раствора. У улиток удаляли раковину и рассекали по средней линии переднюю часть ноги за исключением ее головного конца. Затем улитку помещали в ванночку, заполненную парафином, и фиксировали вокруг окологлоточного комплекса ганглиев (ЦНС) силиконовое кольцо объемом 200 мкл, в которое постоянно поступал физиологический раствор со скоростью 500 мкл/мин. Отведение биоэлектрической активности нейронов осуществляли стандартными электрофизиологическими методами с помощью стеклянных микроэлектродов, заполненных смесью 2 М раствора цитрата калия и 2М KCl в соотношении 1:1. Электроды имели диаметр кончика менее 1 мкм и сопротивление около 30 МОм.
Пептид HLDF-6 (Thr-Gly-Glu-Asn-His-Arg-NH2) синтезирован в Институте биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН и предоставлен для нейрофизиологических исследований чл.-корр. РАН В.М. Липкиным. Пептид HLDF-6 апплицировали к ЦНС улитки в течение 60 мин в дозах 10 нМ или 1 мкМ.
Для тестирования реакций нейронов на сенсорные раздражители применяли слабый раствор хинина (0,25 %) и тактильные стимулы. Ранее нами показано, что синаптические входы нейрона ЛПл1, возбуждаемые данными стимулами, избирательно регулируются внутриклеточными сигнальными системами [6]. Хинин в объеме 600 мкл апплицировали в течение 30 с на кожу передней части головы улитки. Через 2 мин после окончания аппликации голову животного отмывали физиологическим раствором. Тактильные раздражения наносили на голову или на среднюю часть ноги с помощью электромеханического устройства (давление 1500 г/см2) [6]. В ответах, вызванных сенсорными раздражениями, оценивали площадь (в мВ·с) характерных для интернейронов улитки медленных ВПСП (возбуждающих постсинаптических потенциалов, мВПСП). Измерение площади производили с помощью прибора Digitizer KD 4030B (фирма Graphtec, Япония) и специальной компьютерной программы. Тестирующие раздражения наносили с интервалом 15–20 мин в течение 1–1,5 ч до подведения пептида, во время его подведения, а также в течение 2–2,5 ч после начала его отмывания. Последовательность нанесения стимулов – химического раздражения головы, тактильного раздражения ноги и головы – меняли в каждом опыте. В работах, выполненных нами ранее [3], показано, что стабильность синаптических ответов у нейронов сохраняется на протяжении 5–6 ч эксперимента. Так как у некоторых нейронов генерация потенциалов действия препятствовала измерению площади мВПСП, ответы на раздражители регистрировали при гиперполяризации мембраны до 80 мВ.
Возбудимость плазматической мембраны нейронов оценивали по количеству потенциалов действия, генерируемых при пропускании через внутриклеточный электрод прямоугольного импульса тока положительного направления силой 1 нА в течение 10 с.
В качестве контроля использовали нейроны ЛПл1, к которым подводили физиологический раствор, не содержавший HLDF-6. У этих клеток регистрировали на протяжении 4–5 ч такие же показатели спонтанной и вызванной активности, как у нейронов, к которым подводили пептид.
Всего исследовано 16 нейронов, к которым подводили пептид в дозе 10 нМ, 8 нейронов, к которым апплицировали пептид в дозе 1мкМ и 10 контрольных нейронов.
Полученные данные выражали в процентах, по отношению к исходным значениям (100 %), усредняли и вычисляли стандартную ошибку средней. Для оценки уровня достоверности различий использовали t-критерий Стьюдента.
Результаты исследования и их обсуждение
Аппликации пептида HLDF-6 в дозе 10 нМ вызывали небольшую деполяризацию мембраны нейронов (n = 16) на 4–5 мВ и увеличение ее возбудимости на 50–70 % (рис. 1). Эффекты проявлялись через несколько минут после начала подведения пептида и достигали максимума через 20–40 мин. При отмывании пептида наблюдали постепенное восстановление (в течение десятков минут) исходных величин мембранного потенциала и возбудимости. Есть основания полагать, что пептид HLDF-6 действует на мембранный потенциал и возбудимость мембраны через разные механизмы. Об этом свидетельствует отсутствие в ряде случаев корреляции между изменениями этих показателей активности клетки. Мембранные эффекты пептида могут опосредоваться их участием в регуляции активности Са2+ каналов нейронов [7].
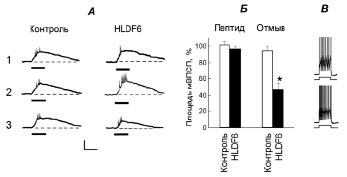
Рис. 1. Действие пептида HLDF-6 на возбудимость и ответы интернейрона оборонительного поведения ЛПл1, вызванные раздражениями хеморецепторов головы улитки. А. Нативные электрофизиологические реакции на 0,25 % раствор хинина контрольного нейрона и нейрона, к которому подводили HLDF-6. 1 – исходные ответы; 2 – реакции через 50 мин после начала подведения пептида; 3 – ответы через 1 ч после начала отмывания пептида. Утолщенные линии под записями – моменты аппликации 0,25 % хинина на голову улитки. Калибровка – 10 мВ/30 с. Ответы зарегистрированы во время гиперполяризации мембраны до 80 мВ. Б. Суммарный график реакций нейронов на раздражения хеморецепторов. По оси ординат показаны площади мВПСП в ответах на сенсорные стимулы, выраженные в процентах (за 100 % приняты площади мВПСП до аппликации пептида). Надписи над графиками: пептид – реакции нейронов на 50–60 мин подведения пептида; отмыв – ответы на 60–70 мин после начала отмывания пептида. В. Измерение возбудимости плазматической мембраны нейрона при инъекции в клетку деполяризирующего импульса тока (1 нА, 10 с). Количество потенциалов действия во время подведения пептида (внизу) больше, чем при тестировании возбудимости перед его подведением. * – p < 0,01, по отношению к ответам контрольных нейронов и исходных реакций на хинин
Аппликации слабого 0,25 %-ного раствора хинина на кожу головы моллюска вызывали в нейроне ЛПл1 генерацию мВПСП, площадь которого составляла 309 ± 42 мВ·с (рис. 1). Площади мВПСП в ответах нейрона на тактильные раздражения, наносимые на голову и среднюю часть ноги, составляли соответственно 175 ± 29 и 121 ± 17 мВ·с.
Во время подведения пептида HLDF-6 в дозе 10 нМ не обнаружено существенного изменения ответов нейронов (n = 16) на тестирующие сенсорные химические раздражения. В частности, на 50–60 мин после начала подведения пептида площади мВПСП в ответах на хинин не отличались от исходных значений и ответов на хинин у нейронов (n = 10) контрольных животных (рис. 1, p > 0,05)
Через 10–20 мин после начала отмывания пептида выявлена выраженная депрессия ответов, вызванных аппликациями слабого раствора хинина на голову улитки (рис. 1). Через 60–70 мин после начала отмывания пептида площади мВПСП в ответах на хинин были на 50–70 % меньше таковых в ответах на хинин у нейронов контрольных животных и в исходных реакциях (p < 0,01; рис. 1). Эффект сохранялся до окончания эксперимента (не менее 2-х часов).
Во время подведения пептида HLDF-6 (10 нМ) к нейронам ЛПл1 (n = 16) и его отмывания отмечена тенденция к депрессии ответов нейронов на тактильные раздражения головы (на 15–30 % от исходной величины реакций и ответов нейронов у контрольных животных), однако эффект был не достоверен (p > 0,05; рис. 2). Ответы нейронов (n = 16) на тактильные раздражения ноги сохранялись относительно стабильными как во время подведения пептида, так и после его отмывания (рис. 3).
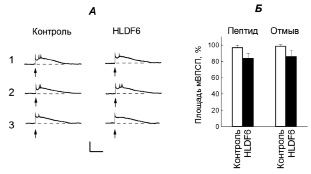
Рис. 2. Влияние пептида HLDF-6 на реакции нейрона ЛПл1, вызванные стимуляцией механорецепторов головы улитки. А. Реакции на тактильные раздражения отмечены стрелками. Остальные обозначения как на рис. 1
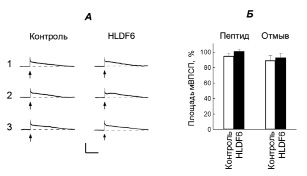
Рис. 3. Действие пептида HLDF-6 на ответы нейрона ЛПл1, вызванные стимуляцией механорецепторов середины ноги улитки. Остальные обозначения как на рис. 1 и 2
Направленность и динамика нейронных (n = 8) эффектов пептида HLDF-6 в дозе 1 мкМ были сходны с таковыми для пептида в дозе 10 нМ. В частности, не обнаружено изменений реакций на сенсорные раздражения во время подведения пептида. Через 10–20 мин после окончания подведения пептида площади мВПСП в ответах на хинин были на 50–70 % меньше исходных значений и ответов контрольных нейронов (p < 0,01). Реакции нейронов на тактильные раздражения головы и ноги после отмывания пептида не изменялись. В исследованиях на различных экспериментальных моделях у млекопитающих также показано сходство эффектов HLDF-6, применяемых в широком диапазоне доз [1, 5].
Таким образом, пептид HLDF-6 в дозах 10 нМ и 1 мкМ оказывал влияние как на электрофизиологические свойства мембраны интернейронов оборонительного поведения ЛПл1 и ППл1, так и на эффективность синаптической передачи. Следует отметить избирательность эффектов пептида по отношению к определенному сенсорному «входу» нейронов – депрессия ответов, вызванных сенсорными раздражениями хеморецепторов головы улитки при отсутствии изменений ответов на раздражение механорецепторов головы и ноги животного.
Ранее мы обнаружили, что сходный по динамике, но противоположный по направленности эффект на нейрон ЛПл1 оказывает опиоидный пептид лей-энкефалин [6]. В частности, подведение этого пептида в течение 1 ч не влияло на реакции нейронов, вызванные раздражениями головы улитки слабым раствором хинина. Однако через 50–60 мин после окончания подведения пептида выявлено выраженное облегчение реакций на химическую стимуляцию головы. Эффект был специфичен для лей-энкефалина, поскольку аппликации другого опиоида мет-энкефалина не оказывали влияния на ответы, вызываемые хинином. Кроме того, эффекты лей-энкефалина устранялись антагонистом опиоидных рецепторов налоксоном. Нельзя исключить, что лей-энкефалин и пептид HLDF-6 оказывают разнонаправленное влияние на одну и ту же молекулярную клеточную «мишень», которая вовлечена в регуляцию синаптических возбуждений от хеморецепторов головы улитки.
Эти результаты согласуются с данными о взаимодействии пептида HLDF-6 и эндогенной опиатной системы ЦНС млекопитающих. В частности, было установлено, что HLDF-6 отменял анальгетический эффект агонистов μ- и k-рецепторов опиоидов [7]. Механизмы модуляторного эффекта HLDF-6 на опиоидную систему пока неясны. Известно, что связывание рецептор-специфических агонистов с опиатными рецепторами разных типов на поверхности спленоцитов или клеток HL-60 приводило к снижению активности аденилатциклазы и уровня цАМФ в клетках [8, 9]. Ранее мы обнаружили [6], что в процессах синаптической пластичности в сенсорных входах нейронов ЛПл1 от хеморецепторов головы избирательно участвуют цАМФ и зависимые от него транскрипционные факторы немедленного раннего гена С/ЕВР (CAAT/enhancer binding protein). Эти факты подтверждают предположение о возможности влияния HLDF-6 на активность ранних генов [3].
Другим возможным молекулярным субстратом, вовлекаемым в реализацию эффектов пептида HLDF-6 на нейронах ЛПл1, являются NMDA рецепторы глутамата. Нами обнаружено, что выработка простой формы обучения – ноцицептивной сенситизации в условиях действия антагонистов NMDA рецепторов не оказывала влияния на ответы нейронов ЛПл1, вызываемые тактильными раздражениями головы или ноги животных, однако индуцировали выраженную депрессию ответов нейронов на химические сенсорные раздражения головы улитки, сохранявшуюся длительное время [6]. Таким образом, обнаруженный нами депрессивный эффект пептида HLDF-6 на синаптическую передачу может опосредоваться через NMDA рецепторы. Это предположение согласуется с данными, полученными в исследованиях на млекопитающих, в которых показано, что HLDF-6 избирательно вовлечен в механизмы регуляции содержания NMDA рецепторов на мембранах [1, 5].
Заключение
В исследованиях на идентифицированных нейронах оборонительного поведения виноградной улитки ЛПл1 нами обнаружено, что пептид HLDF-6 в широком диапазоне доз избирательно индуцировал депрессию синаптических реакций на раздражения хеморецепторов головы улитки, не влияя на синаптические ответы нейронов, вызванные стимуляцией механорецепторов головы и ноги. Синаптическая депрессия развивалась после отмывания пептида и сохранялась продолжительное время. Этот эффект мог реализоваться через различные молекулярные компоненты системы сигнальной трансдукции нейрона. В частности, пептид может быть вовлечен в регуляцию функций NMDA рецепторов глутамата, изменение содержания цАМФ в нейронах, активации транскрипции зависимого от цАМФ раннего гена С/ЕВР. Эффект пептида HLDF-6 был противоположен по направленности действия опиоидного пептида лей-энкефалина, который также избирательно вовлечен в регуляцию синаптического входа от хеморецепторов головы животного, однако вызывал облегчение ответов в этом входе после отмывания пептида. Полученные результаты важны для изучения специфических молекулярных механизмов, вовлекаемых в синапс-специфическую пластичность, лежащую в основе процессов обучения и памяти. Кроме того, данные, полученные на одном нейроне, не только подтверждают и удивительно однозначно соотносятся с результатами, полученными на разных экспериментальных объектах, но и позволяют определить перспективы дальнейших исследований механизмов действия пептида. В частности, представляется интересным изучить возможность участия пептида HLDF-6 в регуляции транскрипции раннего гена С/ЕВР.

