В последние полвека в связи с резким возросшим переселением населения и разработками горнодобывающей промышленности в высокогорных районах Кыргызской Республики, привели к нахождению людей в условиях больших высот, которые затем в последующем возвращаются к условиям среднегорья, что приводит к ряду проблем медико-биологического и социального значения. Деадаптивные процессы представляют собой выражение регресса любой адаптации, при этом подготавливая необходимые механизмы для создания новых реакций адаптации организма в соответствии с изменениям окружающей среды [1–3].
Невзирая на обилие фармакологических препаратов и способов введения больных с гнойно-воспалительными заболеваниями мягких тканей и послеоперационных гнойных осложнений проблема все еще остается весьма актуальной в современной хирургии [4–6]. Местное применение различных лекарственных средств является неотъемлемой составляющей, а иногда и основным методом в лечении гнойных ран [7]. Однако к нынешним временам возбудители ран подверглись значительным изменениям, проявившимся в виде резистентности к современным препаратам антибактериальной терапии [8, 9]. Распространённые мази, которые практикующие хирурги до сих пор используют в лечении ран, хотя и не потеряли свою противомикробную способность, в частности, к значимым возбудителям хирургической инфекции, но весьма заметно стало снижение воздействия на продолжительность заживления этих ран [5]. В связи с этим требования, предъявляемые к новым разрабатываемым антисептикам для лечения гнойных ран – поддержание чувствительности микроорганизмом на высоком уровне [10]. В ходе применения антисептиков на водной основе, последние смешиваются с раневым отделяемым и их концентрация в ране снижаются, что ведет к раннему высыханию [11, 12]. В связи с этим многие исследователи предлагают заменять на полимерные антисептики, обладающими пролонгированными свойствами высвобождения активного компонента [12, 13]. К числу последних на рынке фармацевтических компаний в большом количестве представлены препараты из группы йодофоров, представляющие собой комплексные соединения йода с поливинил-пирролидоном.
Цель исследования: провести оценку заживления экспериментальных гнойных ран в период деадаптации к высокогорью при комплексном применении мази и антисептического раствора.
Материалы и методы исследования
Работа выполнена на базе двух научно-исследовательских лабораторий Национального хирургического центра и Кыргызской государственной медицинской академии им. И.К. Ахунбаева на перевале Туя-Ашуу. Материалом для исследования послужили 72 беспородных разнополых кролика. Экспериментальные животные были разделены на 3 группы по 24 кролика в каждом. Экспериментальные исследования в контрольной группе были проведены в условиях г. Бишкека, животные которые все время пребывали там же. Опытные группы I и II представлены экспериментальными животными, которые после 3- и 30-дневного пребывания в условиях высокогорной базы ЦНИИЛ (3200 м над уровнем моря) вновь возвращены в г. Бишкек. Содержание животных проводилось строго в соответствии с нормативными документами ГОСТ «Содержание экспериментальных животных в питомниках НИИ» 1964 г.
Во время проведения экспериментальных исследований были соблюдены правила лабораторной практики (GLP), в соответствии с правилами гуманного обращения с экспериментальными животными, участвующими в опытах, указанные в «Правилах проведения работ с использованием экспериментальных животных», (1984 г.), а также в соответствии с положениями Хельсинкской декларации Всемирной медицинской ассоциации 1964 г.
Модель стандартной гнойной раны мягких тканей у экспериментальных животных получали по следующей методике: После начала наркоза, в положении животного на брюшке, в межлопаточной области на область планируемого модели раны наносились контуры раны диаметром до 5 см. Послойно рассекалась кожа с шерстью и поверхностная фасция и проводили надсечки в мышцах. Далее сформированный кожный лоскут с шерстью переворачивали обратной стороной к поверхности раны и непрерывным швом капроновой нитью № 4 фиксировали к свободному краю раны и поверхностной фасции на протяжении всего края раневого дефекта. Удаление подшитого лоскута проводили через 2 суток. Сразу же после удаления лоскута 1 раз в день проводили перевязки путем накладывания на раневую поверхность повязку, предварительно пропитанную антисептическим раствором на основе соединения йода с поливинилпирролидоном (10 % Повидон-йод) и мазью Левомеколь, при этом предварительно мазь прогревают на водяной бане при температуре 36 °С до жидкого состояния и смешивают с антисептическим раствором в равной пропорции (Рационализаторское предложение № 845 от 17 июля 2017 г., Кыргызпатент). Оценку эффективности лечения смоделированной раны авторы проводили на 3-е, 7-е, 15-е и 20-е сутки наблюдения, используя определение площади раны по Л.Н. Поповой (1942 г.), индекса заживления и гистологического метода исследования.
Все данные были обработаны с помощью компьютерной программы SPSS 23.0. Последовательно была проведена проверка на нормальности распределения количественных признаков и сравнения по количественному признаку (ANOVA), с использованием апостериорно критерия Тьюки. Основные статистические характеристики представлены: М – среднее, s – стандартное отклонение, n – объем выборки. Статистически достоверными различиями считались при уровня р ≤ 0,05.
Результаты исследования и их обсуждение
Средняя площадь смоделированной раны у всех экспериментальных животных на начало лечения была равнозначна и составляла 1963 ± 2,5 мм2.
Из табл. 1 видно, что на 3-й день от момента лечения наибольшее сокращение площади раны отмечено в контрольной группе, в которой составило 1872,3 ± 3,1 мм2, тогда как в опытной группе I – 1954,0 ± 1,4 мм2, а в опытной группе II – 1959,1 ± 1,4 мм2.
Таблица 1
Площадь ран в исследуемых группах в процессе лечения (мм2, М ± s)
|
Дни исследования |
Группы экспериментальных животных |
||
|
Контрольная группа М1 ± s |
Опытная группа I М2 ± s |
Опытная группа II М3 ± s |
|
|
3 день |
1872,3 ± 3,1 |
1954,0 ± 1,4 |
1959,1 ± 1,4 |
|
р |
М1-М2 ˂ 0,05 М2-М3 ˂ 0,05 |
М1-М3 ˂ 0,05 |
|
|
7 день |
717,3 ± 46,3 |
844,8 ± 15,8 |
913,6 ± 5,3 |
|
р |
М1-М2 ˂ 0,05 М2-М3 ˂ 0,05 |
М1-М3 ˂ 0,05 |
|
|
15 день |
172,0 ± 80,1 |
59,5 ± 5,01 |
387,0 ± 6,83 |
|
р |
М1-М2 ˂ 0,05 М2-М3 ˂ 0,05 |
М1-М3 ˂ 0,05 |
|
|
20 день |
36,1 ± 40,4 |
0 |
155,1 ± 1,1 |
|
р |
М1-М2 ˂ 0,05 М2-М3 ˂ 0,05 |
М1-М3 ˂ 0,05 |
|
На 7-й день наблюдения отмечается схожая закономерность в группах. Наиболее замедленное уменьшение площади раны отмечено в опытной группе II, где она была – 913,6 ± 5,3 мм2 (р ≤ 0,005), а в опытной группе I показатель составил 844,8 ± 15,8 мм2 (р ≤ 0,005), тогда как в контрольной группе – 717,3 ± 46,3 мм2.
Весьма значительные различия были отмечены к 15-м суткам исследования: площадь раны в группе после кратковременного пребывания в горах составила – 59,5 ± 5,0 мм2 (р ≤ 0,005). В эти же сроки в группе после длительного пребывания в условиях высокогорной базы отмечено замедление процесса сокращения площади ран, составив 387,0 ± 6,8 мм2 (р ≤ 0,005), для сравнения, в контрольной группе она уменьшилась до 172,0 ± 80,1 мм2. На 20 день лечения в опытной группе I у всех экспериментальных животных рана затянулась и представлена в виде мягкого рубца. В контрольной группе у 50 % животных также рана зажила, у остальных площадь раны составила 29,5 (0; 76,0) мм2, а в опытной группе II площадь раны была 155,1 ± 1,1 мм2 (р ≤ 0,005).
Из полученных данных показателя суточного уменьшения площади ран в процессе лечения, сформулированы результаты, отраженные в табл. 2. В периоде деадаптации идет достоверно замедленное сокращение площади ран в опытных группах I и II. К 3 дню от момента лечения при сравнительном анализе отмечены равнозначные показатели в опытной группе I (М2) и II (М3), которые составили 0,15 ± 0,02 % (р ˃ 0,05) и 0,06 ± 0,02 % (р ˃ 0,05) и достоверно значимо отличались от контрольной группы (М3) – 1,54 ± 0,05 % (р ˂ 0,05).
Таблица 2
Индекс заживления ран в исследуемых группах ( %, М ± s)
|
Дни исследования |
3 сутки |
7 сутки |
15 сутки |
20 сутки |
|
Контрольная группа |
1,54 ± 0,05 |
15,42 ± 0,62 |
9,56 ± 1,20 |
17,05 ± 3,27 |
|
Опытная группа I |
0,15 ± 0,02* |
14,19 ± 0,20* |
11,62 ± 0,07* |
20,0 ± 0,0* |
|
Опытная группа II |
0,06 ± 0,02** |
13,34 ± 0,07**; # |
7,2 ± 0,12**; # |
11,97 ± 0,11**; # |
Примечание. * – М1-М2 р ˂ 0,05; ** – М1-М3 р ˂ 0,05; # – М2-М3.
В ходе сравнительного анализа отмечено, что у животных после длительного пребывания в условиях гор скорость заживления замедлена и на 7-й день эксперимента составила 13,34 ± 0,07 % за сутки (р < 0,05), а после кратковременного пребывания ускорена – 14,19 ± 0,20 % (р ˃ 0,05) за сутки по отношению к предыдущему дню наблюдения. Для сравнения у животных контрольной группы она равна была 15,42 ± 0,62 %. Ускорение процесса заживления в опытной группе I было замечено как на 15-е, так и на 20-е сутки эксперимента, составив 11,62 ± 0,07 % и 20,0 ± 0,0 % (р < 0,05) за сутки по отношению к данным полученные в предыдущем наблюдении. Рана к концу эксперимента полностью затянулась.
Медленное заживление экспериментальной гнойной раны у животных опытной группы после 30-дневной адаптации к высокогорным условиям отмечалось во всех днях наблюдения. Так, на 15-й день индекс заживления равен 7,2 ± 0,12 % (р < 0,05) за сутки, а на 20-е сутки лечения – 11,97 ± 0,11 % (р < 0,05) за сутки по отношению к 15 дню.
При гистологических исследованиях раневых биоптатов во всех группах на 3-й день лечения рана покрыта фиброзно-гнойными массами, выражено гнойное (флегмонозное) воспаление; множество мышечных клеток в состоянии глубокой дистрофии, отдельные в состоянии некроза. По периферии раны имеются единичные соединительнотканные клетки; капсулы или грануляционной ткани вокруг раны нет. По периферии и в толще гноя имеются колонии бактерий. На некотором удалении от раны имеется разрастание грануляционной ткани с множеством сосудов.
На 7-е сутки наблюдения в контрольной и опытной группе I на поверхности раны имеется гнойное воспаление (рис. 1). На некоторых участках в дерме отмечается разрастание грануляционной ткани разной степени зрелости, где-то уже сформированные сосуды с оформленными волокнами, где-то молодая грануляционная ткань с большим количеством лимфоцитов, лейкоцитов и макрофагов. В опытной группе II сохраняется выраженное гнойное воспаление с дистрофически изменёнными мышечными клетками и полнокровными сосудами. Воспалительный процесс довольно глубоко ушел в толщу дермы и подлежащие ткани.
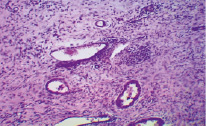
Рис. 1. Морфологическая картина раны на 7-й день комплексного применения мази и антисептического раствора в группе после 3-дневного пребывания в горах. Окр. гемотоксилин-эозин. Ув. х 280
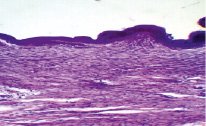
Рис. 2. Морфологическая картина раны на 15-й день комплексного применения мази и антисептического раствора в группе после 3-дневного пребывания в горах. Окр. гемотоксилин-эозин. Ув. х 280
На 15-е сутки наблюдений в опытной группе I рана частично покрыта многослойным эпителием, строение обычное: эпителий с придатками, далее коллагенизированная дерма и мышечный слой с многочисленными сосудами. Этот участок плавно переходит в зону зрелой грануляционной ткани с «наползанием» на нее многослойного эпителия (рис. 2).
В контрольной группе рана представлена без эпителиального покрытия. На значительном отдалении от поверхности, в глубине дермы имеется поле созревшей грануляционной ткани со зрелыми клетками и волокнистыми структурами. Мышечные клетки в глубине дермы практически не изменены. В опытной группе II рана покрыта гнойно-некротической массой, которая местами вдается вглубь дермы, воспаление в ране держится, между волокнами дермы имеются лимфо-лейкоцитарные инфильтраты разной степени выраженности.
На 20-й день лечения в опытной группе I рана полностью зажила, представлена многослойным плоским эпителием, который неравномерно утолщен и имеет многочисленные акантотические выросты. В контрольной группе у половины животных гистологическая картина представлена как в опытной группе, у остальных рана представлена грануляционной тканью, с участками, покрытыми эпителием. К концу исследования, рана в опытной группе II была представлена лишь грануляционной тканью, которая заполняла все раневую поверхность, с множественными сосудами, без явлений воспаления.
Таким образом, результаты исследования и сравнительная их оценка указывают, что при комплексном применении мази и антисептического препарата у животных, которые были кратковременно адаптированы к условиям высокогорья, течение раневого процесса было значительно лучше, при сравнении с неадаптированными животными в 3 раза, которые были замечены с 15 дня наблюдения. Площадь раны при этом в опытной группе I составила 59,5 ± 5,0 мм2, а у неадаптированных животных – 172,0 ± 80,1 мм2 (р ˂ 0,05). В опытной группе II отмечается неблагоприятное течение заживление по сравнение с контрольной группой на 15 день наблюдения в 2 раза, а к 20 дню в 5 раз, связанное с увеличением продолжительности I фазы раневого процесса.

