Под тревожностью обычно понимают индивидуальную психологическую особенность, которая проявляется в переживании эмоционального дискомфорта, обусловленного антиципацией человеком ожидающейся угрожающей или неблагоприятной ситуации, а также в низком пороге возникновения состояния тревоги [1].
Тревожность может быть адекватной, когда она выполняет приспособительную функцию подготовки организма к встрече с реальной угрожающей ситуацией, и неадекватной, когда человек воспринимает объективно безопасные ситуации как угрожающие и реагирует на них развитием состояния тревоги.
Часто выделяют ситуационную и личностную тревожность (ЛТ). Состояние ситуационной тревожности возникает в ответ на конкретную ситуацию, имеющую какие-либо стрессовые факторы. Тревожность как личностная диспозиция определяется тем, насколько часто и интенсивно человек испытывает состояние тревоги, и соотносится скорее с неадекватной формой тревожности [2].
Несмотря на то, что поискам электрофизиологических коррелятов тревожности посвящено большое количество исследований, до сих пор нет однозначного понимания, какие спектрально-пространственные характеристики ЭЭГ наиболее репрезентативны для определения уровня тревожности человека. С тревожностью связывают разные диапазоны биоэлектрической активности мозга, однако чаще всего корреляты тревожности обнаруживаются в рамках α-ритма ЭЭГ. Установлена непосредственная связь уровня тревожности с разными характеристиками α-активности [3]. Показана связь личностной тревожности с мощностью α-ритма в ситуации экзаменационного стресса [4]. В ряде работ применяется БОС-тренинг, ориентированный на управление частотно-амплитудными характеристиками α-ритма, для снятия состояний тревоги и депрессии [5, 6]. Результаты подобных исследований подтверждают, что именно α-ритм является необходимым компонентом имеющим отношение к физиологическому обеспечению состояния тревоги.
В. Клемешем предложена концепция «inhibition–timing hypothesis» [7, 8]. Согласно этой концепции синхронизация α-колебаний может отражать процессы нисходящего контроля, благодаря которым происходит торможение нерелевантной информации, что обеспечивает работу механизмов избирательного произвольного внимания. Кроме этого, α-синхронизация может быть связана с формированием временной структуры процессов прохождения информации по разным корковым зонам. Десинхронизация α-ритма отражает уменьшение торможения и вовлечение большого числа нейронов в обработку информации.
Согласно современным представлениям, α-активность не является однородной, и существует несколько самостоятельных систем генерации α-ритма, которые могут выполнять различные функции. Показано, что α-активность может являться частью системы аффективного внимания [9]. Причем связь с процессами непроизвольного внимания имеет именно низкочастотная компонента α-ритма (α1) [8], тогда как с произвольным вниманием чаще ассоциируют высокочастотную α-активность [10]. Можно предположить, что тревожность также связана с задействованием системы непроизвольного внимания, что обусловлено постоянным непроизвольным мониторингом возможных опасностей, а следовательно корреляты тревожности будут проявляться в низкочастотном α-диапазоне.
Принимая во внимание вышеизложенное, можно заключить, что на сегодняшний день не выработано единой позиции относительно того, какие показатели ЭЭГ наиболее адекватно отражают уровень тревожности вообще и уровень личностной тревожности в частности. С другой стороны, имеются веские основания считать, что показатели ЭЭГ, наиболее тесно связанные с тревожностью, могут находиться в диапазоне низкочастотного α-ритма.
Целью данного исследования было определение спектрально-когерентных характеристик α1-диапазона ЭЭГ, которые могли бы служить коррелятами личностной тревожности.
Материалы и методы исследования
В исследовании на основе добровольного информированного согласия участвовали 42 испытуемых (мужчины в возрасте 18–21 года). Процедура обследования соответствовала стандартам локального этического комитета Первого МГМУ им. И.М. Сеченова. В качестве зрительно-моторной задачи использовался компьютеризированный тест Горбова-Шульте (красно-черные таблицы). Обследование состояло из двух заданий. Во время обследования испытуемый находился в удобном кресле перед экраном монитора (17 дюймов). На мониторе отображалась таблица (7х7 квадратов), содержащая 24 красных и 25 черных квадратов, на каждом из которых имелся собственный номер. Паттерны расположения квадратов для каждого задания были изначально заданы методом случайной генерации. Для всех испытуемых использовался одинаковый набор паттернов.
На основе предварительной инструкции испытуемый должен был в первом задании (КЧ) выбрать (указать курсором мышки) черные квадраты в порядке возрастания их номеров от (1 до 25), а затем – красные квадраты в порядке убывания номеров (от 24 до 1). Во втором задании (ЧЕРЕД) испытуемый должен был выбрать по очереди черные и красные квадраты, черные в порядке возрастания, а красные в порядке убывания: 1 черный, 24 красный, 2 черный, 23 красный и т.д.
По результатам выполнения компьютерной задачи для каждого испытуемого вычисляли время между последовательными кликами по квадратам, величина которого усреднялась по каждому заданию (среднее время клика, мс) и число допущенных при этом ошибок.
У испытуемых тестировали уровень личностной тревожности (STAI) по Ч. Спилбергеру, в модификации Ю.Л. Ханина.
ЭЭГ регистрировали в исходном состоянии при открытых (Ф1ОГ) и закрытых (Ф1ЗГ) глазах, во время выполнения заданий (КЧ, ЧЕРЕД) и в состоянии спокойного бодрствования после выполнения заданий (Ф2ОГ). ЭЭГ регистрировали с помощью электроэнцефалографа «Нейрон-спектр» (г. Иваново) монополярно по схеме «10–20» в затылочных (О2, О1), теменных (Р4, Р3), центральных (С4, С3), лобных (F4, F3) и височных (Т4, Т3) отведениях. Объединённые референтные электроды располагались на мочках ушей. Полоса фильтрации составляла 0,5–35,0 Гц, постоянная времени – 0,32 с, режективный фильтр – 50 Гц. После регистрации все записи ЭЭГ были переведены в компьютерную систему анализа и топографического картирования электрической активности мозга «BRAINSYS» для Windows и обработаны с помощью аппаратно – программного комплекса «НЕЙРО-КМ» (ООО «Статокин», г. Москва). Артефакты исключали из анализируемой записи с использованием возможностей программного комплекса BRAINSYS. Спектрально-когерентный анализ ЭЭГ проводили на основе быстрого преобразования Фурье (пакет программ BRAINSYS). Эпоха анализа составляла 4 сек при длительности каждого фрагмента в 1 мин, частота оцифровки – 200 Гц. Рассчитывали спектральную мощность α1-диапазона (7–10 Гц) ЭЭГ. Для всех пар отведений вычисляли средние значения функции когерентности (Кког) в α1-диапазоне. Для статистической обработки использовался программный пакет STATISTICA v.8.0. При нормальном распределении анализируемых показателей вычисляли среднее значение (M) и стандартную ошибку среднего (m). Достоверность различий анализируемых показателей у испытуемых выделенных групп оценивали с помощью t-критерия для независимых выборок. Достоверность изменения значений показателей в разных ситуациях у одной группы испытуемых оценивали с использованием t-критерия для связанных выборок.
Результаты исследования и их обсуждение
По результатам тестирования по группе испытуемых в целом среднее значение ЛТ равнялось 36 ± 1,33 балла, при индивидуальном разбросе от 23 до 67 баллов. Выделены группы испытуемых с низкой (1-я группа; М = 28,36 ± 0,66 баллов; 14 человек) и высокой (2-я группа; М = 45,85 ± 2,26 баллов; 13 человек) ЛТ.
По результатам выполнения компьютерной задачи достоверных различий по количеству ошибок (КЧ р = 0,487, ЧЕРЕД р = 0,28) и по среднему времени клика (КЧ р = 0,732, ЧЕРЕД р = 0,919) между испытуемыми 1-й и 2-й групп не наблюдалось.
Проведенный спектральный анализ показал, что у испытуемых с низкой ЛТ в исходном состоянии при закрытых глазах мощность потенциалов α1-диапазона ЭЭГ была во всех отведениях достоверно выше, чем у испытуемых с высокой ЛТ (табл. 1). Также у лиц 1-й группы мощность потенциалов α1-диапазона была достоверно выше в некоторых отведениях (Р4, С4, С3, F4, F3) при открытых глазах в состоянии спокойного бодрствования после выполнения всех заданий (Ф2ОГ) (табл. 1). На всех остальных этапах обследования (Ф1ОГ, КЧ, ЧЕРЕД) различия по мощности α1-ритма между испытуемыми обеих групп не зарегистрированы (кроме Т4 в ЧЕРЕД).
Таблица 1
Спектральная мощность потенциалов α1-диапазона ЭЭГ у испытуемых с разной личностной тревожностью в исходном состоянии при закрытых глазах (Ф1ЗГ) и при открытых глазах в состоянии спокойного бодрствования после выполнения задания (Ф2ОГ)
|
Отведения ЭЭГ |
Ф1ЗГ |
Ф2ОГ |
||||
|
Группа 1 (M ± m; мкВ2) |
Группа 2 (M ± m; мкВ2) |
р |
Группа 1 (M ± m; мкВ2) |
Группа 2 (M ± m; мкВ2) |
р |
|
|
О2 |
80,84 ± 16,22 |
26,80 ± 10,19 |
0,0104 |
– |
– |
– |
|
О1 |
63,62 ± 10,04 |
29,58 ± 12,63 |
0,0436 |
– |
– |
– |
|
Р4 |
50,90 ± 11,49 |
18,27 ± 5,39 |
0,0191 |
19,97 ± 3,35 |
10,30 ± 3,27 |
0,0499 |
|
Р3 |
49,08 ± 12,33 |
15,03 ± 4,72 |
0,0191 |
– |
– |
– |
|
С4 |
29,37 ± 4,21 |
11,07 ± 2,90 |
0,0017 |
14,82 ± 2,59 |
6,93 ± 1,58 |
0,0171 |
|
С3 |
31,56 ± 5,15 |
9,96 ± 2,24 |
0,0010 |
14,25 ± 2,57 |
6,87 ± 1,52 |
0,0227 |
|
F4 |
27,99 ± 3,49 |
10,24 ± 2,52 |
0,0004 |
13,49 ± 2,63 |
6,82 ± 1,44 |
0,0390 |
|
F3 |
28,00 ± 3,88 |
9,56 ± 1,97 |
0,0003 |
13,43 ± 2,81 |
6,72 ± 1,44 |
0,0482 |
|
Т4 |
8,85 ± 1,30 |
3,88 ± 0,97 |
0,0055 |
– |
– |
– |
|
Т3 |
9,22 ± 1,28 |
4,25 ± 1,25 |
0,0104 |
– |
– |
– |
Анализ коэффициентов когерентности биопотенциалов α1-диапазона выявил существенные различия между выделенными группами в фоне при закрытых глазах и во время выполнения задания на этапах КЧ и ЧЕРЕД.
У испытуемых 1-й группы на этапе Ф1ЗГ зарегистрированы достоверно более высокие Кког в гомологичных межполушарных взаимосвязях (О1-О2, Р3-Р4, С3-С4, F3-F4), а также в ряде негомологичных межполушарных взаимосвязей (О2-Р3, С3-Т4, С4-Т3, С4-F3, F3-T4, F4-T4, F4-T3) (табл. 2).
Таблица 2
Значения Кког α1-диапазона ЭЭГ у испытуемых 1-й и 2-й групп на этапах обследования
|
Этапы обследования |
|||||||||||
|
Ф1ЗГ |
КЧ |
ЧЕРЕД |
|||||||||
|
Пары отвед. |
1 гр. |
2 гр. |
р |
Пары отвед. |
1 гр. |
2 гр. |
р |
Пары отвед. |
1 гр. |
2 гр. |
р |
|
О2-О1 |
0,722 |
0,602 |
0,027 |
О2-О1 |
0,563 |
0,646 |
0,010 |
О2-О1 |
0,546 |
0,621 |
0,031 |
|
О2-P3 |
0,592 |
0,473 |
0,050 |
О1-P4 |
0,524 |
0,585 |
0,047 |
О1-T4 |
0,292 |
0,371 |
0,032 |
|
О2-T4 |
0,596 |
0,714 |
0,025 |
О1-T4 |
0,321 |
0,404 |
0,046 |
Р4-P3 |
0,538 |
0,628 |
0,034 |
|
Р4-P3 |
0,751 |
0,617 |
0,020 |
Р4-P3 |
0,548 |
0,662 |
0,006 |
Р4-C3 |
0,423 |
0,539 |
0,022 |
|
С4-C3 |
0,802 |
0,684 |
0,031 |
Р4-C3 |
0,441 |
0,577 |
0,004 |
Р4-F3 |
0,306 |
0,399 |
0,035 |
|
С4-F3 |
0,727 |
0,600 |
0,014 |
Р4-F3 |
0,314 |
0,435 |
0,009 |
Р3-C4 |
0,477 |
0,569 |
0,033 |
|
С4-T3 |
0,415 |
0,247 |
0,011 |
Р4-T3 |
0,325 |
0,400 |
0,030 |
С4-C3 |
0,530 |
0,633 |
0,043 |
|
С3-T4 |
0,434 |
0,196 |
0,002 |
Р3-C4 |
0,499 |
0,594 |
0,005 |
С4-F3 |
0,476 |
0,580 |
0,045 |
|
F4-F3 |
0,831 |
0,717 |
0,036 |
С4-C3 |
0,545 |
0,666 |
0,002 |
F4-T4 |
0,544 |
0,421 |
0,032 |
|
F4-T4 |
0,470 |
0,310 |
0,032 |
С4-F3 |
0,491 |
0,608 |
0,006 |
||||
|
F4-T3 |
0,348 |
0,218 |
0,047 |
С3-F4 |
0,525 |
0,621 |
0,013 |
||||
|
F3-T4 |
0,379 |
0,190 |
0,008 |
F4-F3 |
0,588 |
0,682 |
0,023 |
||||
Примечание. В таблице приведены только пары отведений, в которых наблюдались достоверные различия в значениях Кког между группами.
На этапе КЧ наблюдалась обратная ситуация: достоверно более высокие Кког отмечались у испытуемых 2-й группы. Различия были зарегистрированы в гомологичных межполушарных взаимосвязях (О1-О2, Р3-Р4, С3-С4, F3-F4) и в негомологичных межполушарных связях (О1-Т4, О1-Р4, Р4-С3, Р4-F3, Р4-Т3, Р3-С4, С4-F3, С3-F4) (табл. 2).
На этапе ЧЕРЕД достоверно более высокие Кког у испытуемых 2-й группы имели место в гомологичных (О1-О2, Р3-Р4, С3-С4) и в негомологичных (О1-Т4, Р3-С4, Р4-С3, Р4-F3, F3-С4) межполушарных связях и в связи F4-T4 (табл. 2).
На этапах Ф1ОГ и Ф2ОГ достоверных отличий между группами по Кког α1-диапазона выявлено практически не было (за исключением связей С3-Т4 на этапе Ф2ОГ).
Таким образом, у испытуемых 1-й группы по сравнению с лицами 2-й на этапе Ф1ЗГ межполушарные Кког в ряде пар отведений ЭЭГ были достоверно выше, а на этапах КЧ и ЧЕРЕД – достоверно ниже. Анализ причин подобных изменений выявил, что у испытуемых 1-й группы выполнение заданий сопровождалось достоверным уменьшением исходно высоких межполушарных Кког в большом количестве пар отведений при сравнении Ф1ЗГ как с КЧ (О2-О1, О2-Р3, О2-С3, О2-Т3, О1-Р4, Р4-Р3, Р4-С3, Р4-F3, Р4-Т3, Р3-С4, Р3-Т4, С4-С3, С4-F3, С4-Т3, С3-F4, С3-Т4, F4-F3, F3-Т4, Т3-Т4), так и с ЧЕРЕД (О2-О1, О2-Р3, О2-С3, О2-Т3, О1-Р4, О1-Т4, Р4-Р3, Р4-С3, Р4-F3, Р4-Т3, Р3-С4, Р3-Т4, С4-С3, С4-F3, С4-Т3, С3-F4, С3-Т4, F4-F3, F3-Т4, Т3-Т4). У испытуемых 2-й группы во время выполнения заданий межполушарные Кког достоверно увеличивались в отведениях: О2-С3, О1-Р4, О1-С4, Р4-С3, Р4-F3, С4-Т3, С3-Т4 при сравнении Ф1ЗГ и КЧ; О2-С3, О1-С4, С4-Т3, С3-Т4 при сравнении Ф1ЗГ и ЧЕРЕД.
По каждому этапу обследования была составлена карта топографического расположения когерентных связей α1-диапазона для испытуемых 1-й и 2-й групп (рис. 1). На карте представлены только высококогерентные связи, Кког которых превышал 0,55.
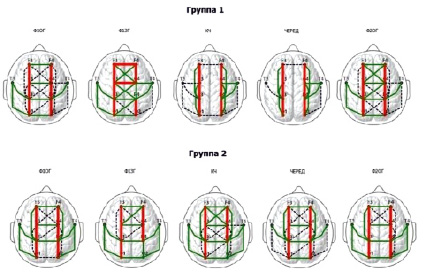
Рис. 1. Топографическое распределение когерентных связей α1-диапазона ЭЭГ испытуемых 1-й и 2-й групп на этапах обследования. Толстые красные линии – Кког > 0,8; тонкие зеленые линии – 0,6 < Кког < 0,8; пунктирные линии – 0,55< Кког < 0,6
Как видно из рис. 1, у лиц с низкой ЛТ имело место различное количество межполушарных связей на этапах спокойного бодрствования (Ф1ЗГ, Ф1ОГ, Ф2ОГ) и на этапах выполнения заданий (КЧ, ЧЕРЕД). У испытуемых с высокими показателями ЛТ такого различия в количестве связей на этапах спокойного бодрствования и на этапах выполнения заданий не наблюдалось.
В целях более детального анализа выявленной закономерности для каждого испытуемого было подсчитано количество высококогерентных межполушарных (за исключением связей с височными зонами Т3 и Т4) связей (Кког>0,55) на каждом этапе обследования, после чего было определено среднее количество таких связей для испытуемых 1-й и 2-й групп. Обнаружено, что у испытуемых 1-й группы при выполнении заданий количество когерентных связей было достоверно ниже относительно предшествующего или последующего этапов спокойного бодрствования (Ф1ЗГ-КЧ р = 0,00027; ЧЕРЕД-Ф2ОГ р = 0,0053) (рис. 2). В отличие от них у испытуемых 2-й группы количество межполушарных связей во время выполнения заданий относительно этапов спокойного бодрствования достоверно не изменялось.
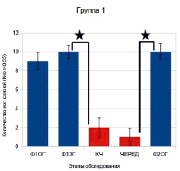
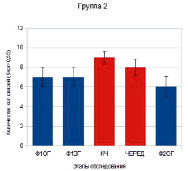
Рис. 2. Количество межполушарных (за исключением связей с височными зонами Т3 и Т4) когерентных связей (Кког > 0,55) α1-диапазона ЭЭГ у испытуемых 1-й и 2-й групп на этапах обследования: синие столбики – этапы фона и спокойного бодрствования, красные – выполнение заданий. Звездочками отмечены достоверные различия между количеством когерентных связей на этапах обследования. Достоверность различий приведена в тексте
Следует отметить, что количество межполушарных связей у испытуемых 1-й группы во время выполнения заданий было достоверно ниже, чем у лиц 2-й группы (КЧ р = 0,00258; ЧЕРЕД р = 0,0141).
В результате проведенного исследования выявлен ряд особенностей спектральных характеристик и паттернов пространственного распределения когерентных связей, характерных для испытуемых с разным уровнем личностной тревожности.
У испытуемых с низкой ЛТ по сравнению с лицами с высокой ЛТ во всех регистрируемых отведениях наблюдалась более высокая мощность биопотенциалов α1- диапазона в исходном состоянии при закрытых глазах. Эти результаты подтверждают ранее полученные нами данные о большей спектральной мощности α-ритма у низкотревожных испытуемых [5].
Интересно, что подобные различия отмечались и в ситуации спокойного бодрствования с открытыми глазами после выполнения всех заданий (Ф2ОГ). В этом случае, как и при Ф1ЗГ, у низкотревожных лиц наблюдалась большая мощность α1-ритма, чем у высокотревожных.
Можно предположить, что у испытуемых 1-й группы ситуация тестирования вызывала адекватное повышение уровня тревожности, а после завершения тестирования она возвращалась в исходное состояние.
Следует отметить, что на этапах Ф1ЗГ и Ф2ОГ наибольшие различия между испытуемыми 1-й и 2-й групп имели место во фронтальных и центральных отведениях. По-видимому, это связано с особой ролью лобных и центральных зон коры в процессах оценки человеком опасности ситуации и планирования дальнейших действий. Так как оценка степени угроз является достаточно субъективной, в ряде исследований регистрируются различия во фронтально-центральных зонах коры, связанные с тревожностью и стрессом [3, 11].
Как уже говорилось выше, десинхронизация α1-ритма отражает процессы непроизвольного внимания и общий уровень активации мозга [7, 8]. С этой точки зрения большие значения мощности α1-ритма в фоновом состоянии с закрытыми глазами и после выполнения задания у низкотревожных испытуемых могут быть связаны с меньшей активацией мозговых структур и меньшим базальным уровнем непроизвольного внимания. У высокотревожных лиц системы непроизвольного внимания, связанные с поиском и оценкой возможных угроз, активированы даже в ситуациях, не требующих активной деятельности.
Анализ когерентных взаимоотношений биопотенциалов α1-диапазона ЭЭГ показал, что в фоновом состоянии с закрытыми глазами большая когерентность межполушарных связей была свойственна группе лиц с низкой ЛТ. Это согласуется с результатами исследования, в котором показано, что переживанию тревоги и печали сопутствует снижение когерентности в α-диапазоне [12]. Результаты настоящего исследования также показали, что во время выполнения заданий межполушарная когерентность, наоборот, оказалась выше у высокотревожных испытуемых. В большинстве пар отведений изменение соотношения Кког у низко- и высокотревожных испытуемых происходило за счет уменьшения когерентности у низкотревожных испытуемых. Можно предположить, что это произошло за счет изменения пространственного паттерна взаимодействия корковых зон. Если в состоянии покоя у низкотревожных испытуемых имела место синхронизация активности обоих полушарий, то при выполнении задания каждое полушарие включалось в осуществление специфических форм анализа информации, что уменьшало межполушарную когерентность у этих лиц. На всех этапах выполнения заданий у низкотревожных испытуемых имело место меньшее количество межполушарных связей, по сравнению с исходным состоянием и с состоянием спокойного бодрствования после обследования.
На основании результатов исследования можно предположить, что большая латерализация активности корковых зон при выполнении заданий, выражающаяся у низкотревожных испытуемых в снижении межполушарной когерентности на частоте α1-ритма, соотносится с меньшим уровнем тревожности. Связь межполушарных взаимоотношений со стрессом и тревожностью прослеживается в целом ряде работ [13, 14].
В настоящем обследовании показано, что у низкотревожных испытуемых переход от этапа к этапу обследования характеризуется различным паттерном когерентных связей в α1-диапазоне, что не наблюдалось у высокотревожных индивидов. Наши предыдущие исследования показали, что лабильность паттерна когерентных взаимоотношений способствует большей успешности выполнения задания [15]. В настоящем исследовании у низко- и высокотревожных испытуемых корреляция с успешностью не выявлена, однако изменчивость паттерна когерентных взаимосвязей сочеталась с меньшей тревожностью, что может свидетельствовать о способности таких индивидов более эффективно использовать психические ресурсы организма, адекватно подстраивая активность различных областей коры под требования выполняемой задачи.
Выводы
1. Спектрально-когерентные характеристики α1-ритма могут рассматриваться в качестве электрофизиологических коррелятов личностной тревожности испытуемых.
2. У низкотревожных испытуемых наблюдалась более высокая мощность α1-ритма в исходном состоянии при закрытых глазах и в состоянии спокойного бодрствования при открытых глазах после выполнения всех тестовых заданий.
3. Различия в когерентности α1-диапазона между группами низкотревожных и высокотревожных испытуемых были обусловлены в основном межполушарными взаимосвязями. В исходном состоянии когерентность потенциалов α1-диапазона была выше в ряде отведений ЭЭГ у низкотревожных лиц, а при выполнении заданий – у высокотревожных.
4. У низкотревожных испытуемых в отличие от высокотревожных наблюдалась лабильность паттерна когерентных взаимосвязей α1-диапазона в соответствии с этапами деятельности.

